镍及其化合物在工业生产中有着广泛的运用,当前世界上镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。回答下列问题:
(1)镍元素在元素周期表中位于__________ ,在基态镍原子中,其核外电子有_______ 种不同运动状态,M层电子排布式为______________________ 。
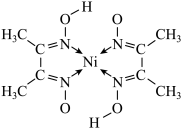
(2)在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图所示。在该结构中,氮镍之间形成的化学键是__________ ,碳原子的杂化轨道类有_______________ ,非金属元素的电负性由大到小的顺序是_________________ 。
(3)过渡金属原子可以与CO分子形成配合物,配合物价电子总数符合18电子规则。如Cr可以与CO形成Cr(CO)6分子:价电子总数(18) =Cr的价电子数(6)+CO提供电子数(2×6)。Ni原子与CO形成配合物的化学式为______________ 。该配合物常温下为液态,易溶于CCl4、苯等有机溶剂,据此判断该分子属于____________ 分子(填“极性”或“非极性”)。
(4)甲醛在Ni催化作用下加氢可得甲醇。甲醇分子内的O-C-H键角_____________ (填“大于”、“等于”或“小于”)甲醛分子内的O-C-H键角;甲醇易溶于水的原因是______________ 。
(5)NixO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为a pm.晶胞中两个Ni原子之间的最短距离为_______ pm。若晶体中的Ni离子分别为Ni2+、Ni3+,此晶体中Ni2+与Ni3+的最简整数比为____________ 。
(1)镍元素在元素周期表中位于
(2)在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图所示。在该结构中,氮镍之间形成的化学键是

(3)过渡金属原子可以与CO分子形成配合物,配合物价电子总数符合18电子规则。如Cr可以与CO形成Cr(CO)6分子:价电子总数(18) =Cr的价电子数(6)+CO提供电子数(2×6)。Ni原子与CO形成配合物的化学式为
(4)甲醛在Ni催化作用下加氢可得甲醇。甲醇分子内的O-C-H键角
(5)NixO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为a pm.晶胞中两个Ni原子之间的最短距离为
更新时间:2020-03-17 12:20:14
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】按照要求回答下列问题:
(1)基态 Cr 原子的价电子排布式为_______ ,占据最高能层的电子的电子云轮廓图形状为__ 。
(2)在BF3分子中,硼原子的杂化轨道类型为________ ,BF3和过量NaF作用可生成NaBF4,BF 的立体构型为
的立体构型为________ ,写出BF 的一种等电子体
的一种等电子体_______ 。
(3)Fe3+比 Fe2+更稳定的原因是_______________________________ 。
(4)金刚石晶胞中面心和顶点碳原子替换成硅原子即为金刚砂晶胞,其晶胞如图所示:
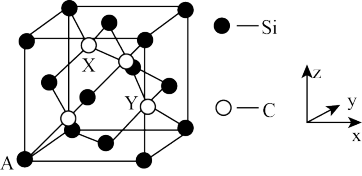
①金刚砂的化学式为_________ 。
②原子坐标参数表示晶胞内部各原子的相对位置。图中 A 原子坐标(0,0,0),则金刚砂晶胞中碳原子 X 的原子坐标为____________ 。
(1)基态 Cr 原子的价电子排布式为
(2)在BF3分子中,硼原子的杂化轨道类型为
 的立体构型为
的立体构型为 的一种等电子体
的一种等电子体(3)Fe3+比 Fe2+更稳定的原因是
(4)金刚石晶胞中面心和顶点碳原子替换成硅原子即为金刚砂晶胞,其晶胞如图所示:

①金刚砂的化学式为
②原子坐标参数表示晶胞内部各原子的相对位置。图中 A 原子坐标(0,0,0),则金刚砂晶胞中碳原子 X 的原子坐标为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】化学与社会、生产、生活息息相关,请回答下列问题:
(1)向AgCl悬浊液中加氨水沉淀逐渐消失,请用离子方程式表示其过程______ ;用文字描述NH3分子的空间构型为______ 。
(2)基态Cu原子价电子排布图(轨道表示式)为______ ;气态Cu+比Cu2+稳定的原因为______ 。
(3)OF2分子中心原子上的价层电子对数为______ ;OF2的熔、沸点______ (填“高于”或“低于”)Cl2O。
(1)向AgCl悬浊液中加氨水沉淀逐渐消失,请用离子方程式表示其过程
(2)基态Cu原子价电子排布图(轨道表示式)为
(3)OF2分子中心原子上的价层电子对数为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】A、B、C、D为原子序数依次增大的前四周期元素。BA3能使湿润的红色石蕊试纸变蓝,A、B、C三种原子的电子数之和等于25,DC晶体中D+的3d能级上电子全充满。
请回答下列问题:
(1)以上四种元素中,第一电离能最大的是_______ (填元素符号);D的基态原子的核外电子排布式为_________ 。
(2)在BA3、AC中,沸点较高的是______ 。(填化学式),其原因是_______ 。DA的晶体类型是_______ 。
(3)BA4C晶体中_____ (填“含”或“不含”)配位键,在该晶体中B原子的价层电子对数为_______ 。
(4)化合物BC3的立体构型为_____ ,其中心原子的杂化轨道类型为_______ 。
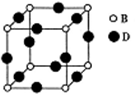
(5)由B、D形成的晶体的晶胞如图所示,已知紧邻的B原子与D原子间的距离为acm。
①该晶胞的化学式为_________ 。②B元素原子的配位数为_________ 。
③该晶体的密度为______ (用含a、NA的代数式表示,设NA为阿伏伽德罗常数的数值)g·cm-3。
请回答下列问题:
(1)以上四种元素中,第一电离能最大的是
(2)在BA3、AC中,沸点较高的是
(3)BA4C晶体中
(4)化合物BC3的立体构型为
(5)由B、D形成的晶体的晶胞如图所示,已知紧邻的B原子与D原子间的距离为acm。
①该晶胞的化学式为
③该晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】以 、
、 等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
(1)基态 原子的末成对电子有
原子的末成对电子有_______ 个。
(2) 、
、 等金属具有良好的导电性,从金属键的理论看,原因是
等金属具有良好的导电性,从金属键的理论看,原因是_______ 。
(3)邻苯二甲酸酐(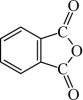 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(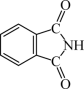 )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是_______ 。
(4)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为_______ 。
(5) 晶体中部分
晶体中部分 原子被
原子被 原子替代后可以改善半导体的性能,
原子替代后可以改善半导体的性能, 键中离子键成分的百分数小于
键中离子键成分的百分数小于 键,原因是
键,原因是_______ 。
(6)氧化亚铜的晶胞结构如下图所示,若最近的 与
与 的核间距为
的核间距为 ,则氧化亚铜晶体的密度是
,则氧化亚铜晶体的密度是_______  (
( 代表阿伏加德罗常数的值,列式即可)。
代表阿伏加德罗常数的值,列式即可)。

 、
、 等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:(1)基态
 原子的末成对电子有
原子的末成对电子有(2)
 、
、 等金属具有良好的导电性,从金属键的理论看,原因是
等金属具有良好的导电性,从金属键的理论看,原因是(3)邻苯二甲酸酐(
 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺( )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是(4)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为
(5)
 晶体中部分
晶体中部分 原子被
原子被 原子替代后可以改善半导体的性能,
原子替代后可以改善半导体的性能, 键中离子键成分的百分数小于
键中离子键成分的百分数小于 键,原因是
键,原因是(6)氧化亚铜的晶胞结构如下图所示,若最近的
 与
与 的核间距为
的核间距为 ,则氧化亚铜晶体的密度是
,则氧化亚铜晶体的密度是 (
( 代表阿伏加德罗常数的值,列式即可)。
代表阿伏加德罗常数的值,列式即可)。
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B、C均可分别与A形成10电子分子,B、C处于同一周期,两者可以形成许多种共价化合物,C、F处于同一主族,B原子最外电子层的p能级处于半满状态,C的最外层电子数是内层电子数的3倍,E最外层电子数比最内层多1。回答下列问题:
(1)E元素基态原子的电子排布式为____ 。
(2)用电子排布图表示F元素原子的价电子排布:____ 。
(3)F、G元素对应的最高价含氧酸中酸性较强的是____ (填化学式)。
(4)离子半径:D+____ (填“<”“>”或“=”,下同)B3-,第一电离能:B____ C,电负性:C____ F。
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为____ 。试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式:____ 。
(6)写出E的单质与D的最高价氧化物对应的水化物反应的化学方程式:____ 。
(1)E元素基态原子的电子排布式为
(2)用电子排布图表示F元素原子的价电子排布:
(3)F、G元素对应的最高价含氧酸中酸性较强的是
(4)离子半径:D+
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为
(6)写出E的单质与D的最高价氧化物对应的水化物反应的化学方程式:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】碱金属(Li、Na、K、Rb、Cs)及其化合物在生产、生活中有着重要的应用。
请回答:
(1)基态K原子核外有___________ 种不同的电子运动状态。
(2)卤化物CsICl2受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。解释X的熔点比Y高的原因:___________
(3)已知RbH2PO2是次磷酸的正盐,H3PO2的结构式为___________ ,其中P原子采取___________ 杂化方式。
(4)Al、B、H电负性分别为1.5、2.0、2.1,简要说明LiAlH4还原性比NaBH4强的原因:___________
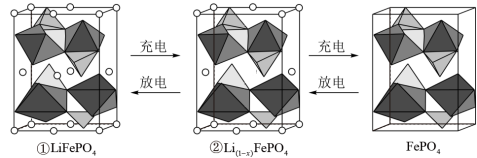
(5)锂离子电池电极材料是LiFePO4,其晶胞结构示意图如①所示。其中O围绕Fe和P分别形成4个正八面体和4个正四面体。电池充电时,LiFePO4脱出部分Li+形成Li(1-x)FePO4,其结构示意图如②所示,则Li(1-x)FePO4晶胞中n(Fe2+):n(Fe3+)=_________ 。
请回答:
(1)基态K原子核外有
(2)卤化物CsICl2受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。解释X的熔点比Y高的原因:
(3)已知RbH2PO2是次磷酸的正盐,H3PO2的结构式为
(4)Al、B、H电负性分别为1.5、2.0、2.1,简要说明LiAlH4还原性比NaBH4强的原因:
(5)锂离子电池电极材料是LiFePO4,其晶胞结构示意图如①所示。其中O围绕Fe和P分别形成4个正八面体和4个正四面体。电池充电时,LiFePO4脱出部分Li+形成Li(1-x)FePO4,其结构示意图如②所示,则Li(1-x)FePO4晶胞中n(Fe2+):n(Fe3+)=

您最近一年使用:0次
【推荐1】氟及其化合物用途非常广泛。回答下列问题:
(1)基态氟原子的价层电子排布图为___________ 。
(2)制备NSF3的反应为FCONSF2+2AgF2 NSF3+2AgF+COF2。
NSF3+2AgF+COF2。
①F、O、N、S的第一电离能从小到大的顺序是___________ 。
②COF2分子的空间构型为___________ 。
③NSF3、COF2的沸点依次为-27.1°C、-84.6°C,前者沸点较高的原因是___________ 。
(3)NHF2的一种制备方法是CO(NH2)2+2F2+H2O=NHF2+CO2+NH4HF2。
①CO(NH2)2中C的杂化方式是___________ 。
②CO(NH2)2的熔沸点比CH3CONH2的高,其原因是___________ 。
③下列说法正确的是___________ (填标号)。
A.NHF2、CO2均是极性分子
B.CO2与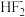 互为等电子体
互为等电子体
C.H2O与NHF2中心原子的价层电子对数相同
D.NH4HF2中存在离子键、配位键和氢键
(4)由Cs、Ag及F三种元素组成的一种超导材料的晶体结构如下图所示(Ag不是+1价):
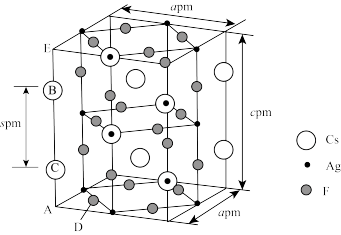
已知AC=BE,则C、D(Cs与F)间的距离为___________ pm(用含a、c、s的代数式表示,列出计算式,下同);设NA为阿伏加德罗常数的值,则晶体的密度为___________ g·cm-3。
(1)基态氟原子的价层电子排布图为
(2)制备NSF3的反应为FCONSF2+2AgF2
 NSF3+2AgF+COF2。
NSF3+2AgF+COF2。①F、O、N、S的第一电离能从小到大的顺序是
②COF2分子的空间构型为
③NSF3、COF2的沸点依次为-27.1°C、-84.6°C,前者沸点较高的原因是
(3)NHF2的一种制备方法是CO(NH2)2+2F2+H2O=NHF2+CO2+NH4HF2。
①CO(NH2)2中C的杂化方式是
②CO(NH2)2的熔沸点比CH3CONH2的高,其原因是
③下列说法正确的是
A.NHF2、CO2均是极性分子
B.CO2与
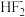 互为等电子体
互为等电子体C.H2O与NHF2中心原子的价层电子对数相同
D.NH4HF2中存在离子键、配位键和氢键
(4)由Cs、Ag及F三种元素组成的一种超导材料的晶体结构如下图所示(Ag不是+1价):

已知AC=BE,则C、D(Cs与F)间的距离为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】化合物I(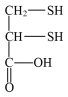 )易与Cu2+结合生成化合物II(
)易与Cu2+结合生成化合物II( )。请回答:
)。请回答:
(1)Cu原子的M电子层中有_______ 个能级,Cu原子的核外电子排布式为_______ 。
(2)下列说法正确的是_______。
(3)化合物I中同周期的两种元素的电负性大小为_______ 。
(4)金属铜的熔点高于钾的原因是_______ 。
(5)Cu可以形成一种离子化合物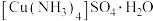 。若要确定它是晶体还是非晶体,最科学的方法是对它进行
。若要确定它是晶体还是非晶体,最科学的方法是对它进行_______ 实验;其阴离子的空间构型是_______ 。
(6)CX4的熔沸点如下表所示:
分析上述三种CX4的熔沸点变化原因:_______ 。
 )易与Cu2+结合生成化合物II(
)易与Cu2+结合生成化合物II( )。请回答:
)。请回答:(1)Cu原子的M电子层中有
(2)下列说法正确的是_______。
| A.化合物I中S原子采取sp3杂化 | B.化合物I中碳原子的杂化类型有sp3和sp2 |
| C.化合物II中C-C-C键角是180° | D.化合物II中存在离子键和共价键 |
(4)金属铜的熔点高于钾的原因是
(5)Cu可以形成一种离子化合物
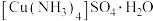 。若要确定它是晶体还是非晶体,最科学的方法是对它进行
。若要确定它是晶体还是非晶体,最科学的方法是对它进行(6)CX4的熔沸点如下表所示:
| CX4 |  |  | 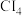 |
| 熔点/℃ | -22.8 | 88 | 170 |
| 沸点/℃ | 76.8 | 190 | 329 |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】我国云南镍白铜(铜镍合金)闻名中外,曾主要用于制作仿银饰品和造币。请回答:
(1)铜元素在元素周期表中的位置为______ 。
(2)基态镍原子的价层电子排布式为______ ,未成对的电子数为______ ,位于周期表______ 区。
(3)铜元素的第二电离能为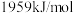 ,镍元素的第二电离能为
,镍元素的第二电离能为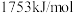 ,铜的第二电离能较大,其主要原因是
,铜的第二电离能较大,其主要原因是______ 。
(4)向硫酸铜溶液逐渐滴加氨水可得到 溶液,
溶液, 中阴离子的立体构型是
中阴离子的立体构型是______ ,NH3中N的杂化方式为______ 。
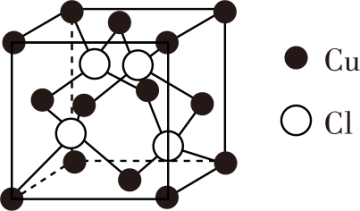
(5)铜原子与氯原子形成化合物的晶胞如下图所示。该晶体的化学式为______ ,每个铜原子周围距离最近的铜原子数目为______ 个。已知该晶体的密度为 ,阿伏加德罗常数的值为NA,则该晶体中铜原子和氯原子之间的最短距离为
,阿伏加德罗常数的值为NA,则该晶体中铜原子和氯原子之间的最短距离为______ pm(列出计算式即可)。
(1)铜元素在元素周期表中的位置为
(2)基态镍原子的价层电子排布式为
(3)铜元素的第二电离能为
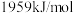 ,镍元素的第二电离能为
,镍元素的第二电离能为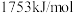 ,铜的第二电离能较大,其主要原因是
,铜的第二电离能较大,其主要原因是(4)向硫酸铜溶液逐渐滴加氨水可得到
 溶液,
溶液, 中阴离子的立体构型是
中阴离子的立体构型是(5)铜原子与氯原子形成化合物的晶胞如下图所示。该晶体的化学式为
 ,阿伏加德罗常数的值为NA,则该晶体中铜原子和氯原子之间的最短距离为
,阿伏加德罗常数的值为NA,则该晶体中铜原子和氯原子之间的最短距离为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】材料是人类文明进步的阶梯,第IIIA、IVA、VA族元素是组成特殊材料的重要元素。请回答下列问题:
(1)基态Ge原子的价层电子排布图为___________ ;基态As原子核外电子占据的能量最高的能级的电子云形状为___________ 。
(2)Si、P、S、Cl的第一电离能由大到小的顺序为___________ 。
(3)M与Ga位于同周期, 的一种配合物组成为
的一种配合物组成为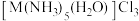 。
。
①下列有关 、
、 的说法正确的是
的说法正确的是___________ (填字母)。
a.分子空间结构相同
b.中心原子杂化轨道类型相同
c.键角大小相同
②1mol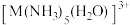 含
含___________ mol 键。
键。
③配合物T与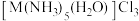 组成元素相同,中心离子的配位数相同。1molT溶于水,加入足量
组成元素相同,中心离子的配位数相同。1molT溶于水,加入足量 溶液可生成2mol
溶液可生成2mol 。则T的化学式为
。则T的化学式为___________ 。
(4)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如图所示,该晶胞中B原子与相邻的P原子构成___________ (填“立方体”“正四面体”或“正八面体”)。
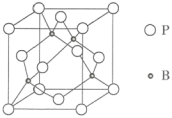
已知该晶体的密度为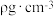 ,设
,设 是阿伏加德罗常数的值。BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为
是阿伏加德罗常数的值。BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为___________ pm(列式即可)。
(1)基态Ge原子的价层电子排布图为
(2)Si、P、S、Cl的第一电离能由大到小的顺序为
(3)M与Ga位于同周期,
 的一种配合物组成为
的一种配合物组成为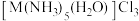 。
。①下列有关
 、
、 的说法正确的是
的说法正确的是a.分子空间结构相同
b.中心原子杂化轨道类型相同
c.键角大小相同
②1mol
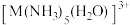 含
含 键。
键。③配合物T与
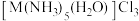 组成元素相同,中心离子的配位数相同。1molT溶于水,加入足量
组成元素相同,中心离子的配位数相同。1molT溶于水,加入足量 溶液可生成2mol
溶液可生成2mol 。则T的化学式为
。则T的化学式为(4)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如图所示,该晶胞中B原子与相邻的P原子构成

已知该晶体的密度为
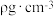 ,设
,设 是阿伏加德罗常数的值。BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为
是阿伏加德罗常数的值。BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】回答下列问题
(1)原子形成化合物时,电子云间的相互作用对物质的结构和性质会产生影响。碳原子有4个价电子,在形成化合物时价电子均参与成键,但杂化方式不一定相同。在乙烷、乙烯、乙炔和苯四种分子中,碳原子采取 杂化的是
杂化的是_______ (写结构简式),。试写出一种有机物分子的结构简式,要求同时含有三种不同杂化方式的碳原子:_______ 。
(2)金属钛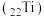 号称航空材料。回答下列问题:
号称航空材料。回答下列问题:
①纳米 是一种应用广泛的催化剂,纳米
是一种应用广泛的催化剂,纳米 催化的一个实例如图所示。
催化的一个实例如图所示。 杂化方式的碳原子个数为
杂化方式的碳原子个数为_______ ,化合物乙中采取 杂化的原子的第一电离能由小到大的顺序为
杂化的原子的第一电离能由小到大的顺序为_______ 。
②有一种氮化钛晶体的晶胞如图所示,该晶体的化学式为_______ ,该晶体中 原子周围距离最近且相等的
原子周围距离最近且相等的 原子的个数为
原子的个数为_______ 。已知晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶胞边长为
,则晶胞边长为_______ (用含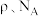 的式子表示)
的式子表示) 。
。
(1)原子形成化合物时,电子云间的相互作用对物质的结构和性质会产生影响。碳原子有4个价电子,在形成化合物时价电子均参与成键,但杂化方式不一定相同。在乙烷、乙烯、乙炔和苯四种分子中,碳原子采取
 杂化的是
杂化的是(2)金属钛
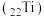 号称航空材料。回答下列问题:
号称航空材料。回答下列问题:①纳米
 是一种应用广泛的催化剂,纳米
是一种应用广泛的催化剂,纳米 催化的一个实例如图所示。
催化的一个实例如图所示。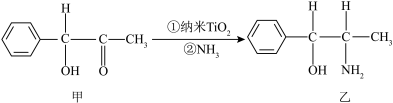
 杂化方式的碳原子个数为
杂化方式的碳原子个数为 杂化的原子的第一电离能由小到大的顺序为
杂化的原子的第一电离能由小到大的顺序为②有一种氮化钛晶体的晶胞如图所示,该晶体的化学式为
 原子周围距离最近且相等的
原子周围距离最近且相等的 原子的个数为
原子的个数为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶胞边长为
,则晶胞边长为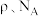 的式子表示)
的式子表示) 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】三聚氰胺俗称“蛋白精”,工业上通过下列流程合成三聚氰胺:

请回答下列问题:
(1)基态Ca原子的电子排布式为__________________ ,CaC2的电子式为__________ 。
(2)CaCN2中阴离子为 ,已知CO2与
,已知CO2与 互为等电子体,由此可以推知
互为等电子体,由此可以推知 的立体构型为
的立体构型为____________________________________________________ 。
(3)H2NCN与水反应生成CO(NH2)2的化学方程式为_____________________________ 。
(4)三聚氰胺分子中碳原子的杂化方式是______ ;分子中处于同一平面的氮原子有______ 个。
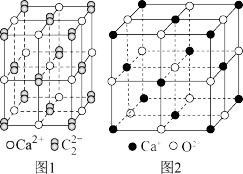
(5)CaC2晶体的晶胞结构与NaCl晶体的相似(如图1所示),但CaC2晶体中含有哑铃形的 ,使晶胞沿一个方向拉长。1个Ca2+周围距离最近且等距离的
,使晶胞沿一个方向拉长。1个Ca2+周围距离最近且等距离的 数目为
数目为______ 。
(6)CaO晶体的晶胞结构如图2所示,边长为acm,用NA表示阿伏加德罗常数的值,则CaO晶体的密度可表示为________________ g∙cm-3(列出计算式)。

请回答下列问题:
(1)基态Ca原子的电子排布式为
(2)CaCN2中阴离子为
 ,已知CO2与
,已知CO2与 互为等电子体,由此可以推知
互为等电子体,由此可以推知 的立体构型为
的立体构型为(3)H2NCN与水反应生成CO(NH2)2的化学方程式为
(4)三聚氰胺分子中碳原子的杂化方式是
(5)CaC2晶体的晶胞结构与NaCl晶体的相似(如图1所示),但CaC2晶体中含有哑铃形的
 ,使晶胞沿一个方向拉长。1个Ca2+周围距离最近且等距离的
,使晶胞沿一个方向拉长。1个Ca2+周围距离最近且等距离的 数目为
数目为(6)CaO晶体的晶胞结构如图2所示,边长为acm,用NA表示阿伏加德罗常数的值,则CaO晶体的密度可表示为

您最近一年使用:0次



