I.焦炭可用于制备电石、生产水煤气等。完成下列填空:
(1)电石的主要成分是CaC2,CaC2的晶体类型是________ ;其与水反应的化学方程式为____________ 。
(2)制备电石还需要用到CaCO3。组成CaCO3的三种元素原子半径按从大到小的顺序排列为________ 。氧原子的核外电子排布式为__________ 。
(3)与同主族元素Mg相比,Ca的金属性更______ (填“强”或者“弱”)。能证明这一结论的实验事实是__________ 。
II.用焦炭生产水煤气的反应为:C(s)+H2O(g)⇌CO(g)+H2(g)。完成下列填空:
(4)一定温度下,在一个固定容积的密闭容器中发生上述反应,下列不能判断该反应达到平衡状态的是________ 。(选填编号)
a.容器中的压强不再改变 b.混合气体的密度不再改变
c.v正(CO)=v逆(H2O) d.c(CO)=c(H2)
(5)将不同量的C (s)和H2O (g)分别加入到体积为2 L的恒容密闭容器中,进行反应,得到如下数据:
①实验1中以v(H2) 表示的到达平衡时的平均反应速率为_______ 。
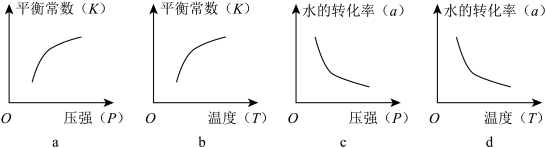
②下列图像正确的是________ 。(选填编号)
(1)电石的主要成分是CaC2,CaC2的晶体类型是
(2)制备电石还需要用到CaCO3。组成CaCO3的三种元素原子半径按从大到小的顺序排列为
(3)与同主族元素Mg相比,Ca的金属性更
II.用焦炭生产水煤气的反应为:C(s)+H2O(g)⇌CO(g)+H2(g)。完成下列填空:
(4)一定温度下,在一个固定容积的密闭容器中发生上述反应,下列不能判断该反应达到平衡状态的是
a.容器中的压强不再改变 b.混合气体的密度不再改变
c.v正(CO)=v逆(H2O) d.c(CO)=c(H2)
(5)将不同量的C (s)和H2O (g)分别加入到体积为2 L的恒容密闭容器中,进行反应,得到如下数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | C | H2 | CO | |||
| 1 | 650 | 0.01 | 0.02 | 0.008 | 5 | |
| 2 | 800 | 0.02 | 0.03 | 0.017 | 3 | |
①实验1中以v(H2) 表示的到达平衡时的平均反应速率为
②下列图像正确的是

更新时间:2020-03-22 12:44:51
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】回答下列问题:
(1)利用水煤气合成二甲醚的反应如下:
①2H2(g)+CO(g) CH3OH(g) ΔH=-90.8kJ/mol
CH3OH(g) ΔH=-90.8kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-23.5kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-23.5kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.3kJ/mol
CO2(g)+H2(g) ΔH=-41.3kJ/mol
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH=
CH3OCH3(g)+CO2(g)的ΔH=____ kJ/mol;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是____ (多选)。
a.升温加压 b.加入催化剂 c.增加H2的浓度 d.增加CO的浓度 e.分离出二甲醚
(2)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如表:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如表:
①比较此时正逆反应速率的大小:v正___ v逆(填“>”“<”或“=”)。
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=____ mol/L;该时间内反应速率v(CH3OH)=____ mol(L·min)。
(3)汽车尾气中NOx和CO的生成及转化为:已知汽缸中生成NO的反应为N2(g)+O2(g) 2NO(g) ΔH>0。
2NO(g) ΔH>0。
①若1mol空气含有0.8molN2和0.2molO2,1300°C时在密闭容器内反应达到平衡。测得NO为8×10-4mol。计算该温度下的平衡常数K=____ ;汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是____ 。
②汽车燃油不完全燃烧时产生CO,若设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)。已知该反应的ΔH>0,判断该设想能否实现并说明依据:____ 。
(1)利用水煤气合成二甲醚的反应如下:
①2H2(g)+CO(g)
 CH3OH(g) ΔH=-90.8kJ/mol
CH3OH(g) ΔH=-90.8kJ/mol②2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH=-23.5kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-23.5kJ/mol③CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH=-41.3kJ/mol
CO2(g)+H2(g) ΔH=-41.3kJ/mol总反应:3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g)的ΔH=
CH3OCH3(g)+CO2(g)的ΔH=a.升温加压 b.加入催化剂 c.增加H2的浓度 d.增加CO的浓度 e.分离出二甲醚
(2)已知反应②2CH3OH(g)
 CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如表:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如表:| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol·L-1) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=
(3)汽车尾气中NOx和CO的生成及转化为:已知汽缸中生成NO的反应为N2(g)+O2(g)
 2NO(g) ΔH>0。
2NO(g) ΔH>0。①若1mol空气含有0.8molN2和0.2molO2,1300°C时在密闭容器内反应达到平衡。测得NO为8×10-4mol。计算该温度下的平衡常数K=
②汽车燃油不完全燃烧时产生CO,若设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)。已知该反应的ΔH>0,判断该设想能否实现并说明依据:
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一个容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2,在一定条件下发生反应:N2(g)+3H2(g) 2NH3(g)ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=
2NH3(g)ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=____ 。平衡时H2的转化率为____ 。
(2)平衡后,若要提高H2的转化率,可以采取的措施有___ 。
A.加了催化剂
B.增大容器体积
C.降低反应体系的温度
D.加入一定量N2
(3)若在2L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g) 2NH3(g)ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g)ΔH<0,其化学平衡常数K与温度T的关系如表所示:
请完成下列问题:
①试比较K1、K2的大小,K1____ K2(填“<”、“>”或“=”);
②下列各项能作为判断该反应达到化学平衡状态的依据是___ (填序号字母)。
A.容器内N2、H2、NH3的物质的量浓度之比为1∶3∶2
B.v(N2)正=3v(H2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃时,反应2NH3(g) N2(g)+3H2(g)的化学平衡常数为
N2(g)+3H2(g)的化学平衡常数为___ 。若某时刻测得NH3、N2和H2物质的量均 为2mol时,则该反应的v(N2)正___ v(N2)逆(填“<”、“>”或“=”)。
(1)若在一个容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2,在一定条件下发生反应:N2(g)+3H2(g)
 2NH3(g)ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=
2NH3(g)ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=(2)平衡后,若要提高H2的转化率,可以采取的措施有
A.加了催化剂
B.增大容器体积
C.降低反应体系的温度
D.加入一定量N2
(3)若在2L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)
 2NH3(g)ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g)ΔH<0,其化学平衡常数K与温度T的关系如表所示:| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1
②下列各项能作为判断该反应达到化学平衡状态的依据是
A.容器内N2、H2、NH3的物质的量浓度之比为1∶3∶2
B.v(N2)正=3v(H2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃时,反应2NH3(g)
 N2(g)+3H2(g)的化学平衡常数为
N2(g)+3H2(g)的化学平衡常数为
您最近半年使用:0次
【推荐3】500℃时,在 的密闭容器中,使
的密闭容器中,使 和足量的
和足量的 在催化剂的条件下发生反应,
在催化剂的条件下发生反应, 和生成物的物质的量随时间变化的关系曲线如图所示,回答下列问题:
和生成物的物质的量随时间变化的关系曲线如图所示,回答下列问题:
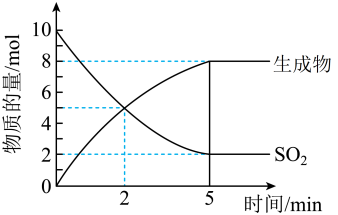
(1)结合数据分析,写出 和足量的
和足量的 反应的化学方程式
反应的化学方程式___________ 。
(2)在前 内,以
内,以 的浓度变化表示的化学反应速率是
的浓度变化表示的化学反应速率是___________ 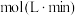 ,加快该反应速率的措施有
,加快该反应速率的措施有___________ (至少写出一条)。
(3)已知:转化率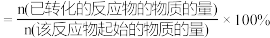 ,则第
,则第 末,
末, 的转化率为
的转化率为___________ 。
(4)该反应在___________ (填“2”或“5”) 达到化学平衡状态。
达到化学平衡状态。
(5)反应达到平衡状态的依据是___________ (填字母序号)。
a.单位时间内消耗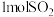 ,同时生成
,同时生成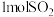
b.反应物浓度与生成物浓度相等
c.反应物浓度与生成物浓度均不再变化
(6)用微观示意图表示上述反应:在图下图框内画出反应中达到平衡后的分子。
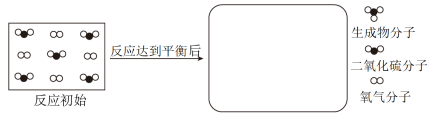
______________ 。
 的密闭容器中,使
的密闭容器中,使 和足量的
和足量的 在催化剂的条件下发生反应,
在催化剂的条件下发生反应, 和生成物的物质的量随时间变化的关系曲线如图所示,回答下列问题:
和生成物的物质的量随时间变化的关系曲线如图所示,回答下列问题:
(1)结合数据分析,写出
 和足量的
和足量的 反应的化学方程式
反应的化学方程式(2)在前
 内,以
内,以 的浓度变化表示的化学反应速率是
的浓度变化表示的化学反应速率是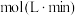 ,加快该反应速率的措施有
,加快该反应速率的措施有(3)已知:转化率
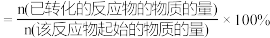 ,则第
,则第 末,
末, 的转化率为
的转化率为(4)该反应在
 达到化学平衡状态。
达到化学平衡状态。(5)反应达到平衡状态的依据是
a.单位时间内消耗
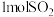 ,同时生成
,同时生成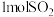
b.反应物浓度与生成物浓度相等
c.反应物浓度与生成物浓度均不再变化
(6)用微观示意图表示上述反应:在图下图框内画出反应中达到平衡后的分子。

您最近半年使用:0次
【推荐1】某合成气的主要成分是一氧化碳和氢气,可用于合成甲醚等清洁燃料。由天然气获得该合成气过程中可能发生的反应如下,请回答下列问题:
①CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+206.1kJ•mol-1
CO(g)+3H2(g) △H1=+206.1kJ•mol-1
②CH4(g)+CO2(g) 2CO(g)+2H2(g) △H2=+247.3kJ•mol-1
2CO(g)+2H2(g) △H2=+247.3kJ•mol-1
(1)下列操作中,能提高 平衡转化率的是___________ (填标号)。
平衡转化率的是___________ (填标号)。
(2)已知在容积为1L的恒容密闭容器中投入等物质的量的H2O和CH4发生反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示,该反应第一次达平衡时的总压强为P0。则反应第一次到达平衡时的分压平衡常数Kp=___________ 。
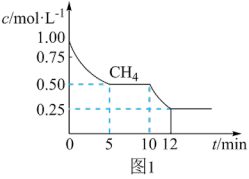
(3)10min时,改变的外界条件可能是___________ 。
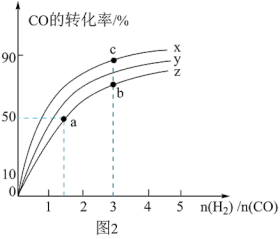
(4)一定温度下的恒容容器中,分别研究在PX、PY、PZ三种压强下CO(g)+3H2(g) CH4(g)+H2O(g) △H1=-206.1kJ•mol-1的反应规律。如图2是上述三种压强下H2和CO的起始组成[
CH4(g)+H2O(g) △H1=-206.1kJ•mol-1的反应规律。如图2是上述三种压强下H2和CO的起始组成[ ]与CO平衡转化率的关系,则PX、PY、PZ的大小关系是
]与CO平衡转化率的关系,则PX、PY、PZ的大小关系是___________ ,原因是___________ 。
II.如图3所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变,已知甲容器中CH4的转化率随时间的变化如图4所示:
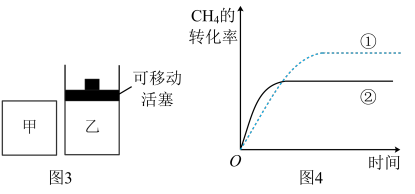
(5)图4中表示乙容器中CH4的转化率随时间变化的图像是___________ (填序号)。
III.在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
(6)在80℃时,测得某时刻Ni(CO)4、CO浓度均为0.5mol•L-1,则此时v正___________ v逆,(填“>”“<”或“=”)。
(7)能说明该反应已达平衡状态的是___________。
①CH4(g)+H2O(g)
 CO(g)+3H2(g) △H1=+206.1kJ•mol-1
CO(g)+3H2(g) △H1=+206.1kJ•mol-1②CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H2=+247.3kJ•mol-1
2CO(g)+2H2(g) △H2=+247.3kJ•mol-1(1)下列操作中,能提高
 平衡转化率的是___________ (填标号)。
平衡转化率的是___________ (填标号)。A.增加 用量 用量 | B.恒温恒压下通入惰性气体 |
C.移除 | D.加入催化剂 |

(3)10min时,改变的外界条件可能是
(4)一定温度下的恒容容器中,分别研究在PX、PY、PZ三种压强下CO(g)+3H2(g)
 CH4(g)+H2O(g) △H1=-206.1kJ•mol-1的反应规律。如图2是上述三种压强下H2和CO的起始组成[
CH4(g)+H2O(g) △H1=-206.1kJ•mol-1的反应规律。如图2是上述三种压强下H2和CO的起始组成[ ]与CO平衡转化率的关系,则PX、PY、PZ的大小关系是
]与CO平衡转化率的关系,则PX、PY、PZ的大小关系是
II.如图3所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变,已知甲容器中CH4的转化率随时间的变化如图4所示:

(5)图4中表示乙容器中CH4的转化率随时间变化的图像是
III.在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)
 Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
(7)能说明该反应已达平衡状态的是___________。
| A.体系的压强不再改变 | B.c(Ni)不再改变 |
| C.混合气体的平均相对分子质量不再改变 | D.v(CO):v(Ni(CO)4)=4:1 |
您最近半年使用:0次
【推荐2】氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一
I.NO和CO气体均为汽车尾气的成分,目前降低尾气的可行方法是在汽车排气管上安装催化转化器,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g) △H
N2(g)+2CO2(g) △H
已知反应中相关键能数据如下:
(1)由此计算△H=__________ 。
(2)在一定温度下,将2.0molNO、2.4molCO通入到容积固定为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示:
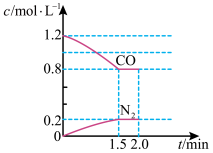
①有害气体NO的转化率为__________ 。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是__________ (填序号)。
a.缩小容器体积 b.催化剂 c.降低温度 d.再通入2.0molNO
③ 若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,平衡将__________ (填“正向” 或“逆向”)移动。
Ⅱ.SCR(选择性催化还原)脱硝法是工业上消除氮氧化物的常用方法,反应原理为:4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) △H<0
(3)该法可能发生副反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ,减少副反应的主要措施是
4NO(g)+6H2O(g) ,减少副反应的主要措施是___________ (写一条即可)。
(4)其他条件相同,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图。
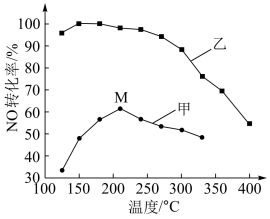
①工业上选择催化剂__________ (填“甲”或“乙”),原因是____________ 。
②在催化剂甲作用下,图中M点处(对应温度为210℃)NO的转化率______ (填“可能是”、“一定是”或“一定不是”) 该温度下的平衡转化率。高于210℃时,NO转化率降低的原因可能是__________ 。(写一条即可)
I.NO和CO气体均为汽车尾气的成分,目前降低尾气的可行方法是在汽车排气管上安装催化转化器,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)
 N2(g)+2CO2(g) △H
N2(g)+2CO2(g) △H已知反应中相关键能数据如下:
| 化学键 | C O O | N≡O | N≡N | C=O |
| 键能/kJ·mol-1 | 1076 | 632 | 946 | 750 |
(2)在一定温度下,将2.0molNO、2.4molCO通入到容积固定为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示:

①有害气体NO的转化率为
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是
a.缩小容器体积 b.催化剂 c.降低温度 d.再通入2.0molNO
③ 若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,平衡将
Ⅱ.SCR(选择性催化还原)脱硝法是工业上消除氮氧化物的常用方法,反应原理为:4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) △H<0
(3)该法可能发生副反应4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) ,减少副反应的主要措施是
4NO(g)+6H2O(g) ,减少副反应的主要措施是(4)其他条件相同,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图。

①工业上选择催化剂
②在催化剂甲作用下,图中M点处(对应温度为210℃)NO的转化率
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】氢气既是一种优质的能源,又是一种重要化工原料,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,甲烷和水蒸气反应的热化学方程式是:CH4(g)+2H2O(g) CO2(g)+4H2 (g) △H=+165.0kJ·mol-1
CO2(g)+4H2 (g) △H=+165.0kJ·mol-1
已知反应器中存在如下反应过程:
ⅰ.CH4(g)+H2O(g) CO(g)+3H2 (g) △H1=+206.4kJ·mol-1
CO(g)+3H2 (g) △H1=+206.4kJ·mol-1
ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) △H2
CO2(g)+H2(g) △H2
根据上述信息计算:△H2=____ 。
(2)欲增大CH4转化为H2的平衡转化率,可采取的措施有____ (填标号)。
A.适当增大反应物投料比n(H2O):n(CH4) B.提高压强 C.分离出CO2
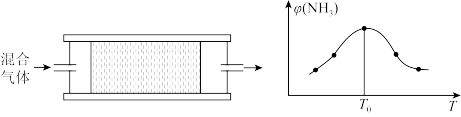
(3)H2用于工业合成氨:N2+3H2 2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是
2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是____ 。
(4)某温度下,n(N2):n(H2)=1:3的混合气体在刚性容器内发生反应,起始气体总压为2×107Pa,平衡时总压为开始的90%,则 的转化率为
的转化率为____ 。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,甲烷和水蒸气反应的热化学方程式是:CH4(g)+2H2O(g)
 CO2(g)+4H2 (g) △H=+165.0kJ·mol-1
CO2(g)+4H2 (g) △H=+165.0kJ·mol-1已知反应器中存在如下反应过程:
ⅰ.CH4(g)+H2O(g)
 CO(g)+3H2 (g) △H1=+206.4kJ·mol-1
CO(g)+3H2 (g) △H1=+206.4kJ·mol-1ⅱ.CO(g)+H2O(g)
 CO2(g)+H2(g) △H2
CO2(g)+H2(g) △H2| 化学键 | H—H | O—H | C—H | C≡O |
| 键能E/(kJ·mol-1) | 436 | 465 | a | 1076 |
(2)欲增大CH4转化为H2的平衡转化率,可采取的措施有
A.适当增大反应物投料比n(H2O):n(CH4) B.提高压强 C.分离出CO2
(3)H2用于工业合成氨:N2+3H2
 2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是
2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是
(4)某温度下,n(N2):n(H2)=1:3的混合气体在刚性容器内发生反应,起始气体总压为2×107Pa,平衡时总压为开始的90%,则
 的转化率为
的转化率为
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】A、B、C、D、E为五种短周期主族元素,且原子序数依次增大,五种元素的原子序数之和为39,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E元素的周期序数与主族序数相等。
(1)A2C2的结构式为___________ 。
(2)E元素在元素周期表中的位置为___________ 。
(3)C、D、E三种元素的简单离子半径由小到大的顺序为___________ (填离子符号)。
(4)若要比较D和E的金属性强弱,下列实验方案不可行的是___________ (填标号)。
A.将D的单质置于E的盐溶液中,若D的单质不能置换出E的单质,说明D的金属性弱
B.将少量D、E的单质分别投入水中,若D反应而E不反应,说明D的金属性强
C.比较相同条件下D和E的最高价氧化物对应水化物的碱性,若D的最高价氧化物对应水化物的碱性强,说明D的金属性强
(5)用 和
和 组成以稀硫酸为电解质溶液的质子交换膜燃料电池,结构如图所示:
组成以稀硫酸为电解质溶液的质子交换膜燃料电池,结构如图所示: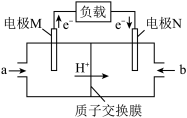
电极N是___________ (填“正极”或“负极”),电极M上的电极反应式为___________ 。
(1)A2C2的结构式为
(2)E元素在元素周期表中的位置为
(3)C、D、E三种元素的简单离子半径由小到大的顺序为
(4)若要比较D和E的金属性强弱,下列实验方案不可行的是
A.将D的单质置于E的盐溶液中,若D的单质不能置换出E的单质,说明D的金属性弱
B.将少量D、E的单质分别投入水中,若D反应而E不反应,说明D的金属性强
C.比较相同条件下D和E的最高价氧化物对应水化物的碱性,若D的最高价氧化物对应水化物的碱性强,说明D的金属性强
(5)用
 和
和 组成以稀硫酸为电解质溶液的质子交换膜燃料电池,结构如图所示:
组成以稀硫酸为电解质溶液的质子交换膜燃料电池,结构如图所示:
电极N是
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】元素周期律(表)是认识元素化合物性质的重要理论。随着原子序数的递增,8种短周期元素(用字母表示)原子半径的相对大小、最高正化合价或最低负化合价的变化如下图所示。
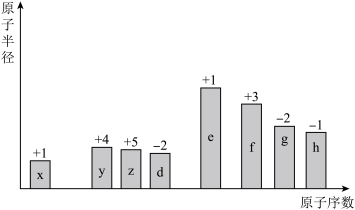
已知:x为非金属元素,d元素原子的最外层电子数为内层电子数的3倍。
(1)x、e、d三种元素形成的离子化合物的电子式为___________ 。化合物yd2中化学键类型有___________ (填“离子键”或“共价键”),
(2)f元素形成的最高价氧化物对应水化物与NaOH溶液反应的离子方程式为___________ 。
(3)d、e简单离子的半径较大的是___________ (用化学式表示,下同);y、z的最高价氧化物的水化物的酸性较弱的是___________ ;d、g与x形成的化合物热稳定性较差的是___________ 。

已知:x为非金属元素,d元素原子的最外层电子数为内层电子数的3倍。
(1)x、e、d三种元素形成的离子化合物的电子式为
(2)f元素形成的最高价氧化物对应水化物与NaOH溶液反应的离子方程式为
(3)d、e简单离子的半径较大的是
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】下列为元素周期表中的一部分,用化学式或元素符号回答下列问题。
(1)在这11种元素中,化学性质最不活泼的是___________ ,原子半径最大的是___________ 。
(2)①②⑤中,最高价氧化物的水化物中碱性最强的是___________ 。
(3)⑦⑪中形成的简单离子半径由大到小的顺序是___________ 。
(4)①和⑨的最高价氧化物对应的水化物化学式分别为___________ 和___________ 。
(5)⑧⑨⑪三种元素形成的气态氢化物最稳定的是___________ 。
(6)上述元素可形成的氧化物中,具有两性的物质与氢氧化钠溶液反应的离子方程式为___________ 。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑦ | ⑪ | |||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(2)①②⑤中,最高价氧化物的水化物中碱性最强的是
(3)⑦⑪中形成的简单离子半径由大到小的顺序是
(4)①和⑨的最高价氧化物对应的水化物化学式分别为
(5)⑧⑨⑪三种元素形成的气态氢化物最稳定的是
(6)上述元素可形成的氧化物中,具有两性的物质与氢氧化钠溶液反应的离子方程式为
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】已知 为短周期主族元素,
为短周期主族元素, 、
、 为第四周期元素,它们的原子序数依次增大。
为第四周期元素,它们的原子序数依次增大。
(1)已知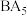 为离子化合物,写出其电子式
为离子化合物,写出其电子式___________ 。
(2)B基态原子中能量最高的电子,其电子云在空间有___________ 个方向,原子轨道呈___________ 形。
(3)实验室制备 的单质的离子反应方程式为
的单质的离子反应方程式为___________ 。
(4)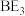 在常温下是一种淡黄色的液体,其遇水即发生反应可生成一种具有漂白性的物质,写出反应的化学方程式
在常温下是一种淡黄色的液体,其遇水即发生反应可生成一种具有漂白性的物质,写出反应的化学方程式___________ ;该反应说明其中B和 中非金属性较强的是
中非金属性较强的是___________ (填元素的符号)。
(5)C与D的第一电离能大小为___________ 。D与 的最高价氧化物对应水化物相互反应的离子方程式为
的最高价氧化物对应水化物相互反应的离子方程式为___________ 。
(6) 价电子排布图为
价电子排布图为___________ ,位于___________ 区。 元素的原子结构示意图为
元素的原子结构示意图为___________ ,前四周期中未成对电子数最多的元素在周期表中位置为___________ 。
 为短周期主族元素,
为短周期主族元素, 、
、 为第四周期元素,它们的原子序数依次增大。
为第四周期元素,它们的原子序数依次增大。| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外 电子数比 电子数比 电子数少1 电子数少1 |
C原子的第一至第四电离能分别是: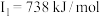 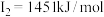 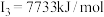 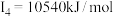 |
| D元素简单离子半径是该周期中最小的 |
| E元素是该周期电负性最大的元素 |
| F所在族的元素种类是周期表中最多的 |
| G在周期表的第十一列 |
 为离子化合物,写出其电子式
为离子化合物,写出其电子式(2)B基态原子中能量最高的电子,其电子云在空间有
(3)实验室制备
 的单质的离子反应方程式为
的单质的离子反应方程式为(4)
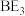 在常温下是一种淡黄色的液体,其遇水即发生反应可生成一种具有漂白性的物质,写出反应的化学方程式
在常温下是一种淡黄色的液体,其遇水即发生反应可生成一种具有漂白性的物质,写出反应的化学方程式 中非金属性较强的是
中非金属性较强的是(5)C与D的第一电离能大小为
 的最高价氧化物对应水化物相互反应的离子方程式为
的最高价氧化物对应水化物相互反应的离子方程式为(6)
 价电子排布图为
价电子排布图为 元素的原子结构示意图为
元素的原子结构示意图为
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】硫是一种重要的非金属元素,广泛存在于自然界,回答下列问题:
(1)基态硫原子的价层电子排布图是_______ 。
(2)①硫单质的一种结构为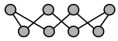 ,杂化方式为
,杂化方式为_______ ;CS2中C的杂化方式为_______ 。
② 、CS2、
、CS2、 键角由大到小的顺序是
键角由大到小的顺序是_______ 。
(3)ZnS晶胞如图所示:
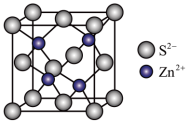
①由图可知,Zn2+填在了S2-形成的_______ 空隙中。
A.正四面体 B.正六面体 C.正八面体
②已知晶胞密度为ρg/cm3,阿伏加德罗常数为NA,则晶胞边长为_______ pm。
(1)基态硫原子的价层电子排布图是
(2)①硫单质的一种结构为
 ,杂化方式为
,杂化方式为②
 、CS2、
、CS2、 键角由大到小的顺序是
键角由大到小的顺序是(3)ZnS晶胞如图所示:

①由图可知,Zn2+填在了S2-形成的
A.正四面体 B.正六面体 C.正八面体
②已知晶胞密度为ρg/cm3,阿伏加德罗常数为NA,则晶胞边长为
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】卤素是典型的非金属元素,它们在自然界中大多以盐的形式存在。回答下列问题:
(1)卤素互化物是指两种卤素形成的化合物,因中心原子的成单电子数为奇数,故配体数目也为奇数,如IF7、ICl3、ClF3等。基态溴原子的价电子排布式为________ ,分析上述卤素互化物中中心原子和配体的电负性特点,推测卤素互化物BrXa中,X可能是__________ (填元素符号);
(2)CsBrCl2属于多卤化物,受热分解存在如下两种可能:
CsBrCl2= CsBr+Cl2①
CsBiCl2=CsCl+BrCl ②
由于晶格能的原因,实际进行的是反应②,则晶格能:CsCl________ CsBr。(填“>”或 “<”)
(3)(CN)2、(SCN)2的性质与卤素单质相似,称为拟卤素。其分子内各原子均达到8电子结构,则(CN)2分子中σ键和π键的个数比为___________ ,SCN-离子的空间构型为_______________ 形,C原子的轨道杂化方式为_____________ 。 SCN-离子用于检验Fe3+时,SCN-与Fe3+间形成的化学键为_____________ 键;
(4)一种天然宝石萤石的主要成分是CaF2。下图是CaF2的晶胞结构示意图,其中与每个Ca2+距离最近的Ca2+有__________ 个;该晶胞边长为α cm,晶体密度为________ g•cm-3(用NA表示阿伏伽德罗常数值)。
(1)卤素互化物是指两种卤素形成的化合物,因中心原子的成单电子数为奇数,故配体数目也为奇数,如IF7、ICl3、ClF3等。基态溴原子的价电子排布式为
(2)CsBrCl2属于多卤化物,受热分解存在如下两种可能:
CsBrCl2= CsBr+Cl2①
CsBiCl2=CsCl+BrCl ②
由于晶格能的原因,实际进行的是反应②,则晶格能:CsCl
(3)(CN)2、(SCN)2的性质与卤素单质相似,称为拟卤素。其分子内各原子均达到8电子结构,则(CN)2分子中σ键和π键的个数比为
(4)一种天然宝石萤石的主要成分是CaF2。下图是CaF2的晶胞结构示意图,其中与每个Ca2+距离最近的Ca2+有
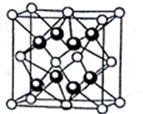
您最近半年使用:0次



