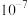下列说法正确的是( )

| A.pH均等于3的醋酸与盐酸溶液等体积混合后,溶液的pH变大 |
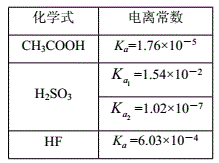
| B.已知某温度下常见弱酸的电离平衡常数如表:相同物质的量浓度的CH3COONa、NaF、Na2SO3、NaHSO3水溶液,溶液中离子总数由小到大排列的顺序是Na2SO3<CH3COONa<NaF<NaHSO3 |
| C.若H2A为二元弱酸,则1mol·L-1NaHA溶液中存在:c(Na+)=c(H2A)+c(HA-)+c(A2-) |
| D.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
19-20高二·浙江·期末 查看更多[1]
(已下线)【新东方】 2020-28
更新时间:2020-02-29 17:31:19
|
相似题推荐
单选题
|
较难
(0.4)
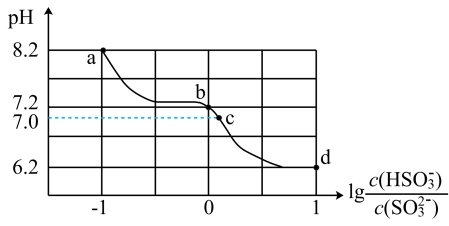
【推荐1】常温下,用20mL0.1mol·L-1Na2SO3溶液吸收SO2气体。吸收液的pH与 的关系如图所示。下列说法不正确的是
的关系如图所示。下列说法不正确的是
 的关系如图所示。下列说法不正确的是
的关系如图所示。下列说法不正确的是
| A.常温下,H2SO3的第二步电离常数为1.0×10-7.2 |
B.b点对应溶液中:c(Na+)>c(HSO )>c(OH-) )>c(OH-) |
C.c点对应溶液中:c(Na+)=c(HSO )+c(SO )+c(SO ) ) |
| D.通入SO2气体的过程中,水的电离平衡逆向移动 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】已知联氨(N2H4)为二元弱碱,常温下将盐酸滴加到联氨(N2H4)的水溶液中,混合溶液中微粒的物质的量分数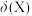 随
随 变化的关系如图所示。下列叙述错误的是
变化的关系如图所示。下列叙述错误的是

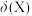 随
随 变化的关系如图所示。下列叙述错误的是
变化的关系如图所示。下列叙述错误的是
A.反应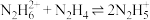 的 的 (已知 (已知 ) ) |
B.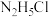 溶液中存在: 溶液中存在: |
C.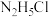 溶液中: 溶液中: |
D. |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】室温下,甘氨酸在水溶液中主要以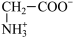 、
、 和
和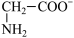 三种微粒形式存在,实验测得不同pH甘氨酸溶液中各成分分布分数δ与pH关系如图所示。下列说法正确的是( )
三种微粒形式存在,实验测得不同pH甘氨酸溶液中各成分分布分数δ与pH关系如图所示。下列说法正确的是( )

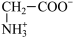 、
、 和
和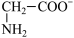 三种微粒形式存在,实验测得不同pH甘氨酸溶液中各成分分布分数δ与pH关系如图所示。下列说法正确的是( )
三种微粒形式存在,实验测得不同pH甘氨酸溶液中各成分分布分数δ与pH关系如图所示。下列说法正确的是( )
| A.a点溶液中,水的电离程度大于b点 |
B.c点溶液中,c(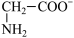 )>c( )>c(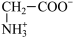 ) ) |
C.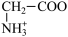 +H2O +H2O 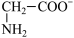 +H3O+的平衡常数为x +H3O+的平衡常数为x |
D.a点溶液中,存在关系式:c( )+c(H+)=c( )+c(H+)=c(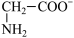 )+c(OH-) )+c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】下列说法正确的是
| A.硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性:c (SO42-)> c (Na+)> c (NH4+)> c (OH-) =c (H+) |
| B.常温下0.4mol/LHB溶液 和0.2mol/LNaOH溶液等体积混合后溶液的PH=3则溶液中微粒浓度存在下面关系:c(HB)>c(Na+)>c(B-)>c(H+) >c(OH-) |
| C.在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液的PH< 7 |
| D.用惰性电极电解含有一定浓度的CuSO4溶液,一段时间后需加入0.1molCu(OH)2才可以恢复至原来的浓度和体积,则在电解过程中转移了0.4mol电子 |
您最近一年使用:0次

 NaOH溶液滴定某二元弱酸
NaOH溶液滴定某二元弱酸 ,pH与粒子的分布分数δ[如
,pH与粒子的分布分数δ[如
 ],
], 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
 时,应选择酚酞溶液作指示剂
时,应选择酚酞溶液作指示剂 的数量级为
的数量级为