解题方法
1 . 银及其化合物在催化与电化学等领域中具有重要应用。已知:①在银催化下,乙烯与氧气反应生成乙醛(CH3-CHO)和环氧乙烷(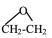 )。下图所示是两反应分步进行的历程图:
)。下图所示是两反应分步进行的历程图:
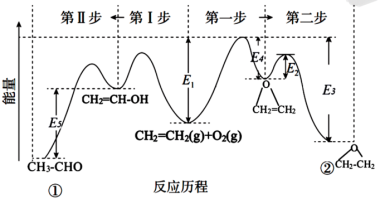
i:2CH2=CH2(g)+O2(g)⇌2CH2=CH-OH(g) ΔH1
ii:CH2=CH-OH(g) ⇌CH3-CHO(g) ΔH2
③乙烯与氧气反应生成环氧乙烷的分步反应方程式为:
iii:2CH2=CH2(g)+O2(g) 2
2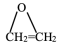 (g) ΔH3
(g) ΔH3
iv: (g)
(g)
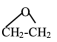 (g) ΔH4
(g) ΔH4
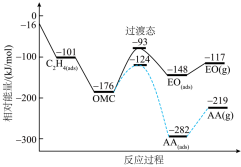
(2)根据已知条件③,乙烯与氧气反应生成环氧乙烷的热化学方程式为:
(3)根据已知条件④,中间体OMC生成吸附态AA(ads)的活化能为
 。
。(4)某温度下,在一体积为1L的恒容密闭容器中,充入1.8molCH2=CH2(g)和0.8molO2(g)发生反应:2CH2=CH2(g)+O2(g)⇌2CH3-CHO(g) ΔH,反应进行10min后到达平衡,体系中各气体的体积分数随反应温度的变化如下图所示
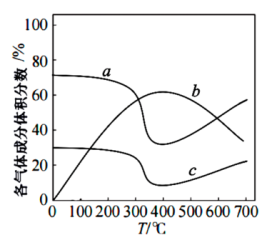
②温度为400℃,达到平衡时,化学反应速率v(O2)=
③温度为600℃,该反应的平衡常数Kc=
(5)乙醛燃料电池有广泛的应用前景,其工作原理如图所示
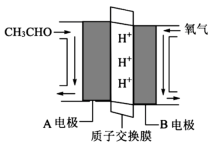
②A电极上的电极方程式为:
您最近一年使用:0次
名校
解题方法
2 . 氮氧化物(NOx)进入同温层可对臭氧层造成破坏,对人类生活造成不利影响,目前工业上可采用多种方法对废气中的氮氧化物进行脱除,回答下列问题:
(1)SCR法主要是针对柴油发动机产生的NOx的处理工艺,原理是NOx和NH3在选择性催化剂表面转化为N2和H2O,反应历程中的能量变化如下图所示:___________ ,SCR法会产生高分散度的烟尘,会使催化剂的活性下降,原因是___________ 。
(2)甲烷脱硝: ΔH
ΔH
①已知甲烷的燃烧热为890.3kJ/mol,
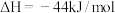 ,
,
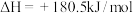 ,则甲烷脱硝反应的
,则甲烷脱硝反应的
___________ kJ/mol。
②800K时,为提高NO的平衡转化率,理论上可以采取的措施有:___________ 。
A.恒容时增加O2 B.恒压时通入一定量的Ar
C.移去部分H2O(g) D.选择合适的催化剂
③一定温度下,将按一定比例混合的反应气匀速通过恒容催化反应器,测得NO去除率同CH4转化率随反应温度的变化关系如下图所示:___________ ;若反应气中 ,起始总压为66kPa,甲烷的平衡转化率为80%(若不考虑过程中存在的其他副反应),计算该温度下反应的分压平衡常数Kp=
,起始总压为66kPa,甲烷的平衡转化率为80%(若不考虑过程中存在的其他副反应),计算该温度下反应的分压平衡常数Kp=___________ (以分压表示,分压=总压×物质的量分数,保留两位有效数字)。
(3)催化电解NO吸收液可将NO还原为NH3,其催化机理如图3所示,在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%)随电解电压的变化如图4所示。已知 表示电解生还原产物X所转移电子的物质的量,F表示法拉第常数;Q总表示电解过程中通过的总电量。
表示电解生还原产物X所转移电子的物质的量,F表示法拉第常数;Q总表示电解过程中通过的总电量。___________ 。
②当电解电压为U1时,电解生成的H2和NH3的物质的量之比为___________ 。
(1)SCR法主要是针对柴油发动机产生的NOx的处理工艺,原理是NOx和NH3在选择性催化剂表面转化为N2和H2O,反应历程中的能量变化如下图所示:

(2)甲烷脱硝:
 ΔH
ΔH①已知甲烷的燃烧热为890.3kJ/mol,

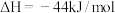 ,
,
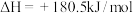 ,则甲烷脱硝反应的
,则甲烷脱硝反应的
②800K时,为提高NO的平衡转化率,理论上可以采取的措施有:
A.恒容时增加O2 B.恒压时通入一定量的Ar
C.移去部分H2O(g) D.选择合适的催化剂
③一定温度下,将按一定比例混合的反应气匀速通过恒容催化反应器,测得NO去除率同CH4转化率随反应温度的变化关系如下图所示:

 ,起始总压为66kPa,甲烷的平衡转化率为80%(若不考虑过程中存在的其他副反应),计算该温度下反应的分压平衡常数Kp=
,起始总压为66kPa,甲烷的平衡转化率为80%(若不考虑过程中存在的其他副反应),计算该温度下反应的分压平衡常数Kp=(3)催化电解NO吸收液可将NO还原为NH3,其催化机理如图3所示,在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%)随电解电压的变化如图4所示。已知
 表示电解生还原产物X所转移电子的物质的量,F表示法拉第常数;Q总表示电解过程中通过的总电量。
表示电解生还原产物X所转移电子的物质的量,F表示法拉第常数;Q总表示电解过程中通过的总电量。
②当电解电压为U1时,电解生成的H2和NH3的物质的量之比为
您最近一年使用:0次
名校
解题方法
3 . 甲醇是最为常见、应用场景最为广泛的基础化学品之一,甲醇与乙烯、丙烯和氨是用于生产所有其他化学品的四种关键基础化学品。
(1)已知反应I: ;
;
反应Ⅱ: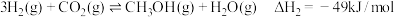 ;
;
则反应Ⅲ: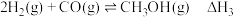
___________  ;
;
(2)常温常压下利用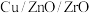 催化剂实现二氧化碳加氢制甲醇的反应历程和能量变化图如下(其中吸附在催化剂表面上的粒子用*标注)
催化剂实现二氧化碳加氢制甲醇的反应历程和能量变化图如下(其中吸附在催化剂表面上的粒子用*标注)___________ 。
(3)在恒容密闭容器中充入 和
和 。发生反应I和Ⅱ,测得平衡时
。发生反应I和Ⅱ,测得平衡时 的转化率、
的转化率、 和
和 的选择性随温度变化如下图所示
的选择性随温度变化如下图所示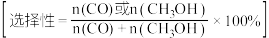 。
。 选择性的曲线是
选择性的曲线是___________ 。(填字母)
② 时,反应I的平衡常数为
时,反应I的平衡常数为___________ (保留2位有效数字)。
③ 过程中,
过程中, 转化率变化的原因是
转化率变化的原因是___________ 。
(4)工业上用甲醇燃料电池采用电解法处理含 和
和 的碱性废水,将
的碱性废水,将 转化为无污染的物质,其原理如下图所示。
转化为无污染的物质,其原理如下图所示。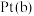 电极与石墨电极
电极与石墨电极___________ 相连(填“M”或“N”)
②甲醇燃料电池工作时,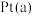 电极的电极反应式为
电极的电极反应式为___________
③消耗标准状况下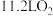 ,理论上可处理含
,理论上可处理含___________ 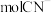 的废水。
的废水。
(1)已知反应I:
 ;
;反应Ⅱ:
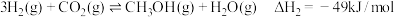 ;
;则反应Ⅲ:
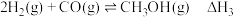
 ;
;(2)常温常压下利用
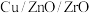 催化剂实现二氧化碳加氢制甲醇的反应历程和能量变化图如下(其中吸附在催化剂表面上的粒子用*标注)
催化剂实现二氧化碳加氢制甲醇的反应历程和能量变化图如下(其中吸附在催化剂表面上的粒子用*标注)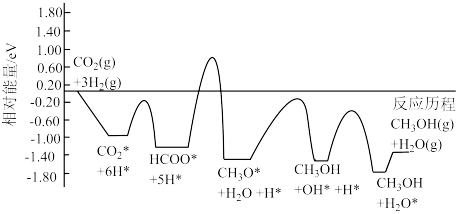
(3)在恒容密闭容器中充入
 和
和 。发生反应I和Ⅱ,测得平衡时
。发生反应I和Ⅱ,测得平衡时 的转化率、
的转化率、 和
和 的选择性随温度变化如下图所示
的选择性随温度变化如下图所示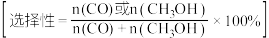 。
。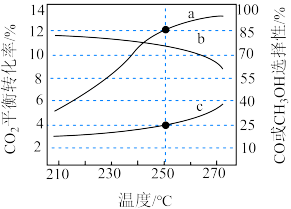
 选择性的曲线是
选择性的曲线是②
 时,反应I的平衡常数为
时,反应I的平衡常数为③
 过程中,
过程中, 转化率变化的原因是
转化率变化的原因是(4)工业上用甲醇燃料电池采用电解法处理含
 和
和 的碱性废水,将
的碱性废水,将 转化为无污染的物质,其原理如下图所示。
转化为无污染的物质,其原理如下图所示。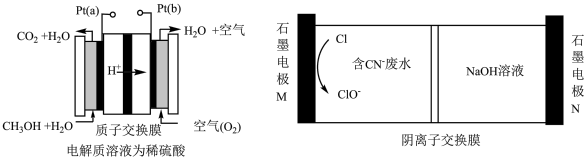
 电极与石墨电极
电极与石墨电极②甲醇燃料电池工作时,
 电极的电极反应式为
电极的电极反应式为③消耗标准状况下
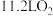 ,理论上可处理含
,理论上可处理含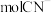 的废水。
的废水。
您最近一年使用:0次
4 .  、CO、
、CO、 等都是重要的能源,也是重要的化工原料。
等都是重要的能源,也是重要的化工原料。
(1)25℃,101kPa时, 完全燃烧生成二氧化碳气体和液态水放出445.1kJ热量。写出该反应的热化学反应方程式:
完全燃烧生成二氧化碳气体和液态水放出445.1kJ热量。写出该反应的热化学反应方程式:___________ 。
(2)水煤气中的CO和 在高温下反应可生成甲烷。在体积为2L的恒容密闭容器中,充入1molCO和
在高温下反应可生成甲烷。在体积为2L的恒容密闭容器中,充入1molCO和 ,一定温度下发生反应:
,一定温度下发生反应: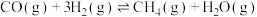 。测得CO和
。测得CO和 的转化率随时间变化如图所示:
的转化率随时间变化如图所示:___________ ,6min时, 的转化率为
的转化率为___________ 。
②下列叙述中能说明上述反应达到化学平衡状态的是___________ (填字母)。
a.容器中混合气体的密度保持不变 b.容器中混合气体的总压强保持不变
c.容器中 d.单位时间内每消耗1molCO,同时生成
d.单位时间内每消耗1molCO,同时生成
e.容器中混合气体的平均相对分子质量保持不变
(3)甲烷燃料电池装置如图,通入氧气的电极为电池的___________ (填“正极”或“负极”)。通入 一端电极反应方程式为:
一端电极反应方程式为:___________ 。
 、CO、
、CO、 等都是重要的能源,也是重要的化工原料。
等都是重要的能源,也是重要的化工原料。(1)25℃,101kPa时,
 完全燃烧生成二氧化碳气体和液态水放出445.1kJ热量。写出该反应的热化学反应方程式:
完全燃烧生成二氧化碳气体和液态水放出445.1kJ热量。写出该反应的热化学反应方程式:(2)水煤气中的CO和
 在高温下反应可生成甲烷。在体积为2L的恒容密闭容器中,充入1molCO和
在高温下反应可生成甲烷。在体积为2L的恒容密闭容器中,充入1molCO和 ,一定温度下发生反应:
,一定温度下发生反应: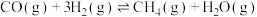 。测得CO和
。测得CO和 的转化率随时间变化如图所示:
的转化率随时间变化如图所示:
 的转化率为
的转化率为②下列叙述中能说明上述反应达到化学平衡状态的是
a.容器中混合气体的密度保持不变 b.容器中混合气体的总压强保持不变
c.容器中
 d.单位时间内每消耗1molCO,同时生成
d.单位时间内每消耗1molCO,同时生成
e.容器中混合气体的平均相对分子质量保持不变
(3)甲烷燃料电池装置如图,通入氧气的电极为电池的
 一端电极反应方程式为:
一端电极反应方程式为: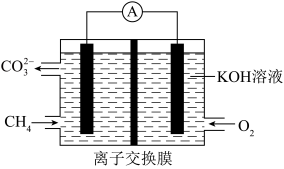
您最近一年使用:0次
解题方法
5 . 氮氧化物 是常见的大气污染物,目前气态含氮化合物及相关转化成为科学家研究的热门问题。
是常见的大气污染物,目前气态含氮化合物及相关转化成为科学家研究的热门问题。
Ⅰ. 还原法。反应原理为:
还原法。反应原理为: 。该反应的能量变化过程如下图:
。该反应的能量变化过程如下图:
______  (用图中字母a、b、c、d表示)。该反应在
(用图中字母a、b、c、d表示)。该反应在______ (填“高温”、“低温”或“任意温度”)条件下有利于自发进行。
Ⅱ. 氧化法。其原理为
氧化法。其原理为
 。在T℃、
。在T℃、 条件下,向一恒压密闭容器中按物质的量之比为2:1通入
条件下,向一恒压密闭容器中按物质的量之比为2:1通入 和
和 的混合气体,体系中气体的含量与时间变化关系如图所示。
的混合气体,体系中气体的含量与时间变化关系如图所示。 达到平衡,则0~20min内
达到平衡,则0~20min内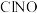 的平约反应速率
的平约反应速率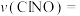
______  ,该反应的平衡常数
,该反应的平衡常数
______ [对于反应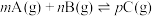
 为平衡物质的量分数]。
为平衡物质的量分数]。
(3)若起始条件相同,在恒容密闭容器中发生上述反应,则达到平衡时NO的含量符合上图中______ 点(填“a”、“b”、“c”或“d”)。
Ⅲ.配合物吸收法。其原理如下: 对
对 的配合能力很强,而
的配合能力很强,而 对
对 的配合能力极低。
的配合能力极低。
(4)与 反应的
反应的 和与
和与 反应的
反应的 物质的量之比为
物质的量之比为______ 。
(5)钴氨溶液经过多次循环吸收NO后,其吸收NO的能力会降低,为了恢复钴氨溶液吸收NO的能力,需采取的方法是______ 。
Ⅳ.电解处理法。其原理为用6%的稀硝酸吸收 生成亚硝酸,再将吸收液导入电解槽中进行电解,使之转化为硝酸。电解装置如右图所示。
生成亚硝酸,再将吸收液导入电解槽中进行电解,使之转化为硝酸。电解装置如右图所示。______ 。
 是常见的大气污染物,目前气态含氮化合物及相关转化成为科学家研究的热门问题。
是常见的大气污染物,目前气态含氮化合物及相关转化成为科学家研究的热门问题。Ⅰ.
 还原法。反应原理为:
还原法。反应原理为: 。该反应的能量变化过程如下图:
。该反应的能量变化过程如下图:

 (用图中字母a、b、c、d表示)。该反应在
(用图中字母a、b、c、d表示)。该反应在Ⅱ.
 氧化法。其原理为
氧化法。其原理为
 。在T℃、
。在T℃、 条件下,向一恒压密闭容器中按物质的量之比为2:1通入
条件下,向一恒压密闭容器中按物质的量之比为2:1通入 和
和 的混合气体,体系中气体的含量与时间变化关系如图所示。
的混合气体,体系中气体的含量与时间变化关系如图所示。
 达到平衡,则0~20min内
达到平衡,则0~20min内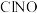 的平约反应速率
的平约反应速率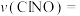
 ,该反应的平衡常数
,该反应的平衡常数
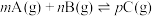
 为平衡物质的量分数]。
为平衡物质的量分数]。(3)若起始条件相同,在恒容密闭容器中发生上述反应,则达到平衡时NO的含量符合上图中
Ⅲ.配合物吸收法。其原理如下:

 对
对 的配合能力很强,而
的配合能力很强,而 对
对 的配合能力极低。
的配合能力极低。(4)与
 反应的
反应的 和与
和与 反应的
反应的 物质的量之比为
物质的量之比为(5)钴氨溶液经过多次循环吸收NO后,其吸收NO的能力会降低,为了恢复钴氨溶液吸收NO的能力,需采取的方法是
Ⅳ.电解处理法。其原理为用6%的稀硝酸吸收
 生成亚硝酸,再将吸收液导入电解槽中进行电解,使之转化为硝酸。电解装置如右图所示。
生成亚硝酸,再将吸收液导入电解槽中进行电解,使之转化为硝酸。电解装置如右图所示。
您最近一年使用:0次
6 . 煤气中主要的含硫杂质有 以及COS(有机硫),煤气燃烧后含硫杂质会转化成
以及COS(有机硫),煤气燃烧后含硫杂质会转化成 从而引起大气污染,因此煤气中
从而引起大气污染,因此煤气中 的脱出程度已成为煤气洁净度的一个重要指标。请回答下列问题:
的脱出程度已成为煤气洁净度的一个重要指标。请回答下列问题:
(1)脱除煤气中CoS的方法有 的KOH溶液氧化法,
的KOH溶液氧化法, 还原法、水解法等。已知:
还原法、水解法等。已知: 、COS、
、COS、 、CO的燃烧热依次为285kJ/mol,299kJ/mol,586kJ/mol、283kJ/mol;
、CO的燃烧热依次为285kJ/mol,299kJ/mol,586kJ/mol、283kJ/mol; 还原COS发生的反应为
还原COS发生的反应为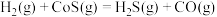 ,该反应的
,该反应的
___________  。
。
(2)较普遍采用的 处理方法是克劳斯工艺即高温热分解
处理方法是克劳斯工艺即高温热分解 ,原理为:
,原理为: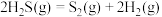 。在1470K、l00kPa反应条件下,将
。在1470K、l00kPa反应条件下,将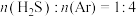 的混合气进行
的混合气进行 热分解反应。平衡时混合气中
热分解反应。平衡时混合气中 与
与 的分压相等,
的分压相等, 平衡转化率为
平衡转化率为___________ ,平衡常
___________  。
。
(3)在1373K、100kPa反应条件下,对于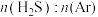 分别为4:1、1:1、1:4、1:9、1:19的
分别为4:1、1:1、1:4、1:9、1:19的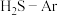 混合气,热分解反应过程中
混合气,热分解反应过程中 转化率随时间的变化如图所示。
转化率随时间的变化如图所示。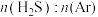 越大,
越大, 平衡转化率
平衡转化率___________ ,理由是___________ 。
②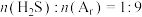 对应图中曲线
对应图中曲线___________ ,计算其在0-0.1s之间, 分压的平均变化率为
分压的平均变化率为___________  。
。
(4)我国科研团队近期开发了一种新型铠甲催化剂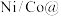 石墨烯,可以高效去除合成气中的
石墨烯,可以高效去除合成气中的 杂质并耦合产氢,其工作原理如图所示。
杂质并耦合产氢,其工作原理如图所示。___________ 。
 以及COS(有机硫),煤气燃烧后含硫杂质会转化成
以及COS(有机硫),煤气燃烧后含硫杂质会转化成 从而引起大气污染,因此煤气中
从而引起大气污染,因此煤气中 的脱出程度已成为煤气洁净度的一个重要指标。请回答下列问题:
的脱出程度已成为煤气洁净度的一个重要指标。请回答下列问题:(1)脱除煤气中CoS的方法有
 的KOH溶液氧化法,
的KOH溶液氧化法, 还原法、水解法等。已知:
还原法、水解法等。已知: 、COS、
、COS、 、CO的燃烧热依次为285kJ/mol,299kJ/mol,586kJ/mol、283kJ/mol;
、CO的燃烧热依次为285kJ/mol,299kJ/mol,586kJ/mol、283kJ/mol; 还原COS发生的反应为
还原COS发生的反应为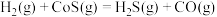 ,该反应的
,该反应的
 。
。(2)较普遍采用的
 处理方法是克劳斯工艺即高温热分解
处理方法是克劳斯工艺即高温热分解 ,原理为:
,原理为: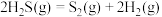 。在1470K、l00kPa反应条件下,将
。在1470K、l00kPa反应条件下,将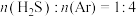 的混合气进行
的混合气进行 热分解反应。平衡时混合气中
热分解反应。平衡时混合气中 与
与 的分压相等,
的分压相等, 平衡转化率为
平衡转化率为
 。
。(3)在1373K、100kPa反应条件下,对于
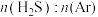 分别为4:1、1:1、1:4、1:9、1:19的
分别为4:1、1:1、1:4、1:9、1:19的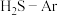 混合气,热分解反应过程中
混合气,热分解反应过程中 转化率随时间的变化如图所示。
转化率随时间的变化如图所示。
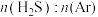 越大,
越大, 平衡转化率
平衡转化率②
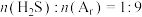 对应图中曲线
对应图中曲线 分压的平均变化率为
分压的平均变化率为 。
。(4)我国科研团队近期开发了一种新型铠甲催化剂
 石墨烯,可以高效去除合成气中的
石墨烯,可以高效去除合成气中的 杂质并耦合产氢,其工作原理如图所示。
杂质并耦合产氢,其工作原理如图所示。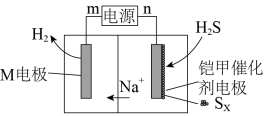
您最近一年使用:0次
7 . 从衣食住行到探索浩瀚宇宙,都有氮及其化合物的参与,但同时有毒含氮化合物的排放,也对环境产生污染。如何实现环境保护与资源利用的和谐统一,已成为我们的重要研究课题。回答下列问题:
(1)在25℃,101 kPa时,利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:
ⅰ.
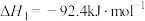
ⅱ.

ⅲ.

根据信息,写出NO(g)与NH3(g)反应生成N2(g)和H2O(l)的热化学方程式:__________ ;该反应自发进行的条件是__________ (填“高温”或“低温”)。
(2)活性炭还原法是消除氮氧化物污染的有效方法。在三个反应器中分别加入C、CaO/C、La2O3/C,通入NO使其浓度达到0.1 mol/L,不同温度下,测得反应2小时NO去除率如图所示:__________ (填“C”“ CaO/C”或“La2O3/C”),该情况下,A点__________ (填“是”或“不是”)平衡点。
②400℃时,CaO/C催化下反应速率v(NO)=__________ mol/(L·h)。
(3)臭氧脱硝存在如下两个反应:
a. ;
;
b. 。
。
T℃时,将2 mol NO2和1 mol O3混合气体充入一个1 L恒容密闭容器中发生上述反应,测得NO2的物质的量浓度随时间变化关系如下表:
若起始压强为p0,T℃下反应达到平衡时,N2O4的分压与N2O5的分压相等,则O3的体积分数=__________ (保留两位有效数字),反应b平衡常数Kp=__________ (用含p0式子表示,Kp为用平衡分压表示的平衡常数,即用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
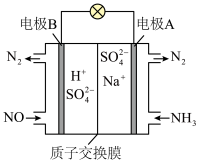
(4)工业上还可以利用原电池原理处理氮氧化合物,工作原理如图所示,则正极的电极反应式为__________ 。
(1)在25℃,101 kPa时,利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:
ⅰ.

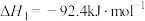
ⅱ.


ⅲ.


根据信息,写出NO(g)与NH3(g)反应生成N2(g)和H2O(l)的热化学方程式:
(2)活性炭还原法是消除氮氧化物污染的有效方法。在三个反应器中分别加入C、CaO/C、La2O3/C,通入NO使其浓度达到0.1 mol/L,不同温度下,测得反应2小时NO去除率如图所示:

②400℃时,CaO/C催化下反应速率v(NO)=
(3)臭氧脱硝存在如下两个反应:
a.
 ;
;b.
 。
。T℃时,将2 mol NO2和1 mol O3混合气体充入一个1 L恒容密闭容器中发生上述反应,测得NO2的物质的量浓度随时间变化关系如下表:
| t/h | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
| c(NO2)/(mol/L) | 2.0 | 1.4 | 1.0 | 0.70 | 0.50 | 0.40 | 0.40 |
(4)工业上还可以利用原电池原理处理氮氧化合物,工作原理如图所示,则正极的电极反应式为
您最近一年使用:0次
8 . 反应 在工业上有重要应用。
在工业上有重要应用。
(1)已知 和
和 的燃烧热分别为
的燃烧热分别为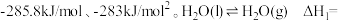
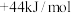 ,则
,则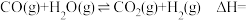
_______ 。
(2)在恒温恒容的密闭容器中发生反应: ,下列能说明该反应达平衡状态的是_______(填字母)。
,下列能说明该反应达平衡状态的是_______(填字母)。
(3)该反应常在 膜反应器中进行,其工作原理如图1所示。
膜反应器中进行,其工作原理如图1所示。 膜时具有更高转化率的原因是
膜时具有更高转化率的原因是_______ 。
②某温度下, 在
在 膜表面上的解离过程存在如下平衡:
膜表面上的解离过程存在如下平衡: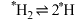 (*表示吸附在催化剂表面),其正反应的活化能远小于逆反应的活化能。下列说法错误的是
(*表示吸附在催化剂表面),其正反应的活化能远小于逆反应的活化能。下列说法错误的是_______ (填字母)。
A.Pd膜对气体分子的透过具有选择性
B.过程2的
C.加快 膜内
膜内 原子迁移有利于
原子迁移有利于 的解离
的解离
D. 原子在
原子在 膜表面上结合为
膜表面上结合为 的过程为放热反应
的过程为放热反应
③同温同压下,已知等物质的量的 和
和 通入无
通入无 膜反应器和
膜反应器和 膜反应器发生反应
膜反应器发生反应 ,无
,无 膜反应器中
膜反应器中 的平衡转化率为
的平衡转化率为 ,相同时间内
,相同时间内 膜反应器出口
膜反应器出口 和出口
和出口 中
中 的物质的量之比为1:8,则使用
的物质的量之比为1:8,则使用 膜反应器
膜反应器 的平衡转化率提高了
的平衡转化率提高了_______  。
。
(4) 也可采用电化学方法实现,反应装置如图2所示。
也可采用电化学方法实现,反应装置如图2所示。_______ (填“正极”或“负极”),该电极上的反应为_______ 。
 在工业上有重要应用。
在工业上有重要应用。(1)已知
 和
和 的燃烧热分别为
的燃烧热分别为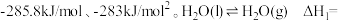
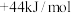 ,则
,则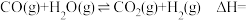
(2)在恒温恒容的密闭容器中发生反应:
 ,下列能说明该反应达平衡状态的是_______(填字母)。
,下列能说明该反应达平衡状态的是_______(填字母)。| A.容器中混合气体的平均摩尔质量不变 | B. 的体积分数保持不变 的体积分数保持不变 |
| C.体系中压强不变 | D.容器中混合气体的密度不变 |
(3)该反应常在
 膜反应器中进行,其工作原理如图1所示。
膜反应器中进行,其工作原理如图1所示。
 膜时具有更高转化率的原因是
膜时具有更高转化率的原因是②某温度下,
 在
在 膜表面上的解离过程存在如下平衡:
膜表面上的解离过程存在如下平衡: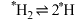 (*表示吸附在催化剂表面),其正反应的活化能远小于逆反应的活化能。下列说法错误的是
(*表示吸附在催化剂表面),其正反应的活化能远小于逆反应的活化能。下列说法错误的是A.Pd膜对气体分子的透过具有选择性
B.过程2的

C.加快
 膜内
膜内 原子迁移有利于
原子迁移有利于 的解离
的解离D.
 原子在
原子在 膜表面上结合为
膜表面上结合为 的过程为放热反应
的过程为放热反应③同温同压下,已知等物质的量的
 和
和 通入无
通入无 膜反应器和
膜反应器和 膜反应器发生反应
膜反应器发生反应 ,无
,无 膜反应器中
膜反应器中 的平衡转化率为
的平衡转化率为 ,相同时间内
,相同时间内 膜反应器出口
膜反应器出口 和出口
和出口 中
中 的物质的量之比为1:8,则使用
的物质的量之比为1:8,则使用 膜反应器
膜反应器 的平衡转化率提高了
的平衡转化率提高了 。
。(4)
 也可采用电化学方法实现,反应装置如图2所示。
也可采用电化学方法实现,反应装置如图2所示。
您最近一年使用:0次
名校
解题方法
9 . 党的二十大报告中强调“实现碳达峰碳中和是一场广泛而深刻的经济社会系统性变革”。
 的转化和利用是实现碳中和的有效途径。回答下列问题:
的转化和利用是实现碳中和的有效途径。回答下列问题:
Ⅰ.利用 合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:
合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:
①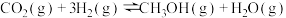
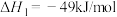
②
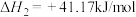
③

(1)反应③中活化能
__________ (填“>”或“<”)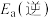 。
。
(2)在催化剂作用下,按 的比例向某密闭容器中通入一定量的原料气,只发生①②两个反应。维持压强为3.2MPa,测得不同温度下,反应经过相同时间时
的比例向某密闭容器中通入一定量的原料气,只发生①②两个反应。维持压强为3.2MPa,测得不同温度下,反应经过相同时间时 的转化率、甲醇的选择性如图所示:
的转化率、甲醇的选择性如图所示: 。
。
①从图中曲线的变化趋势分析a点之后温度升高,甲醇选择性降低的原因__________ ,在实际工业生产中压强不能过高也不能过低的原因是____________ 。
② 时,若反应在催化剂的活性范围内,反应从开始到达到a点所用时间为10min,则
时,若反应在催化剂的活性范围内,反应从开始到达到a点所用时间为10min,则 的分压=
的分压=__________ MPa,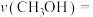
__________ MPa/min,反应②的
__________ ( 指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数×p总,最终结果用分数表示)。
指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数×p总,最终结果用分数表示)。
Ⅱ.近年来,有研究人员用 通过电催化生成多种燃料,实现
通过电催化生成多种燃料,实现 的回收利用,其工作原理如图所示:
的回收利用,其工作原理如图所示: ,则该电极反应式为
,则该电极反应式为____________________ 。

 的转化和利用是实现碳中和的有效途径。回答下列问题:
的转化和利用是实现碳中和的有效途径。回答下列问题:Ⅰ.利用
 合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:
合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:①
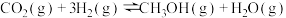
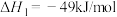
②

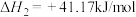
③


(1)反应③中活化能

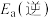 。
。(2)在催化剂作用下,按
 的比例向某密闭容器中通入一定量的原料气,只发生①②两个反应。维持压强为3.2MPa,测得不同温度下,反应经过相同时间时
的比例向某密闭容器中通入一定量的原料气,只发生①②两个反应。维持压强为3.2MPa,测得不同温度下,反应经过相同时间时 的转化率、甲醇的选择性如图所示:
的转化率、甲醇的选择性如图所示:
 。
。①从图中曲线的变化趋势分析a点之后温度升高,甲醇选择性降低的原因
②
 时,若反应在催化剂的活性范围内,反应从开始到达到a点所用时间为10min,则
时,若反应在催化剂的活性范围内,反应从开始到达到a点所用时间为10min,则 的分压=
的分压=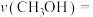

 指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数×p总,最终结果用分数表示)。
指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数×p总,最终结果用分数表示)。Ⅱ.近年来,有研究人员用
 通过电催化生成多种燃料,实现
通过电催化生成多种燃料,实现 的回收利用,其工作原理如图所示:
的回收利用,其工作原理如图所示: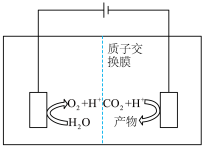
 ,则该电极反应式为
,则该电极反应式为
您最近一年使用:0次
名校
解题方法
10 .  回收与利用是实现“双碳达标”的重要途径。工业上利用
回收与利用是实现“双碳达标”的重要途径。工业上利用 催化还原制备
催化还原制备 原理:
原理:
i.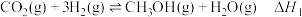
ii.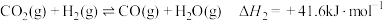
(1)反应 部分反应历程如图甲所示(已知:
部分反应历程如图甲所示(已知: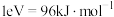 ;标“*”的为吸附在催化剂上的物质)。
;标“*”的为吸附在催化剂上的物质)。___________ 。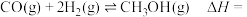
___________  。
。
(2)在恒容密闭容器中充入 和
和 ,加入固体催化剂M,若只发生反应
,加入固体催化剂M,若只发生反应 ,下列说法正确的是___________(填标号)。
,下列说法正确的是___________(填标号)。
(3)在密闭容器中充入 和
和 ,发生上述反应
,发生上述反应 和
和 ,测得
,测得 的平衡转化率与压强
的平衡转化率与压强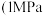 、
、 、
、 、温度
、温度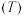 的关系如图乙所示。
的关系如图乙所示。 的曲线是
的曲线是___________ (填“ ”“
”“ ”或“
”或“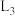 ”),判断依据是
”),判断依据是___________ 。温度升高,三条曲线逐渐靠近的主要原因是___________ 。
②W点时, 的物质的量为amol,则500℃反应ii的平衡常数
的物质的量为amol,则500℃反应ii的平衡常数 为
为___________ (用含 的代数式表示,用平衡分压代替平衡浓度计算的平衡常数为
的代数式表示,用平衡分压代替平衡浓度计算的平衡常数为 ,分压=总压
,分压=总压 物质的量分数)。
物质的量分数)。
(4)我国科学家开发了高效电催化装置,实现 在酸性条件下氢化制备
在酸性条件下氢化制备 。阴极反应式为
。阴极反应式为___________ 。
 回收与利用是实现“双碳达标”的重要途径。工业上利用
回收与利用是实现“双碳达标”的重要途径。工业上利用 催化还原制备
催化还原制备 原理:
原理:i.
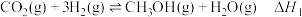
ii.
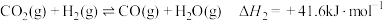
(1)反应
 部分反应历程如图甲所示(已知:
部分反应历程如图甲所示(已知: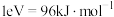 ;标“*”的为吸附在催化剂上的物质)。
;标“*”的为吸附在催化剂上的物质)。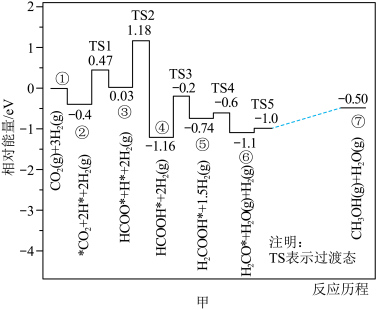
 。
。(2)在恒容密闭容器中充入
 和
和 ,加入固体催化剂M,若只发生反应
,加入固体催化剂M,若只发生反应 ,下列说法正确的是___________(填标号)。
,下列说法正确的是___________(填标号)。A.达到平衡时放出热量为 | B. 体积分数不变时一定达到平衡状态 体积分数不变时一定达到平衡状态 |
C.增大 的质量, 的质量, 的平衡转化率增大 的平衡转化率增大 | D.平衡后充入少量 ,平衡不移动 ,平衡不移动 |
(3)在密闭容器中充入
 和
和 ,发生上述反应
,发生上述反应 和
和 ,测得
,测得 的平衡转化率与压强
的平衡转化率与压强 、
、 、
、 、温度
、温度 的关系如图乙所示。
的关系如图乙所示。
 的曲线是
的曲线是 ”“
”“ ”或“
”或“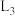 ”),判断依据是
”),判断依据是②W点时,
 的物质的量为amol,则500℃反应ii的平衡常数
的物质的量为amol,则500℃反应ii的平衡常数 为
为 的代数式表示,用平衡分压代替平衡浓度计算的平衡常数为
的代数式表示,用平衡分压代替平衡浓度计算的平衡常数为 ,分压=总压
,分压=总压 物质的量分数)。
物质的量分数)。(4)我国科学家开发了高效电催化装置,实现
 在酸性条件下氢化制备
在酸性条件下氢化制备 。阴极反应式为
。阴极反应式为
您最近一年使用:0次



