名校
解题方法
1 . 党的二十大报告中强调“实现碳达峰碳中和是一场广泛而深刻的经济社会系统性变革”。
 的转化和利用是实现碳中和的有效途径。回答下列问题:
的转化和利用是实现碳中和的有效途径。回答下列问题:
Ⅰ.利用 合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:
合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:
①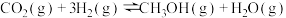
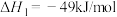
②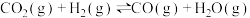
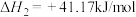
③

(1)反应③中活化能
__________ (填“>”或“<”)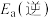 。
。
(2)在催化剂作用下,按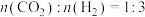 的比例向某密闭容器中通入一定量的原料气,只发生①②两个反应。维持压强为3.2MPa,测得不同温度下,反应经过相同时间时
的比例向某密闭容器中通入一定量的原料气,只发生①②两个反应。维持压强为3.2MPa,测得不同温度下,反应经过相同时间时 的转化率、甲醇的选择性如图所示:
的转化率、甲醇的选择性如图所示: 。
。
①从图中曲线的变化趋势分析a点之后温度升高,甲醇选择性降低的原因__________ ,在实际工业生产中压强不能过高也不能过低的原因是____________ 。
②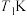 时,若反应在催化剂的活性范围内,反应从开始到达到a点所用时间为10min,则
时,若反应在催化剂的活性范围内,反应从开始到达到a点所用时间为10min,则 的分压=
的分压=__________ MPa,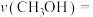
__________ MPa/min,反应②的
__________ ( 指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数×p总,最终结果用分数表示)。
指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数×p总,最终结果用分数表示)。
Ⅱ.近年来,有研究人员用 通过电催化生成多种燃料,实现
通过电催化生成多种燃料,实现 的回收利用,其工作原理如图所示:
的回收利用,其工作原理如图所示: ,则该电极反应式为
,则该电极反应式为____________________ 。

 的转化和利用是实现碳中和的有效途径。回答下列问题:
的转化和利用是实现碳中和的有效途径。回答下列问题:Ⅰ.利用
 合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:
合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:①
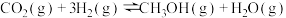
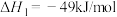
②
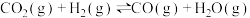
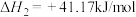
③


(1)反应③中活化能

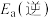 。
。(2)在催化剂作用下,按
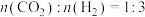 的比例向某密闭容器中通入一定量的原料气,只发生①②两个反应。维持压强为3.2MPa,测得不同温度下,反应经过相同时间时
的比例向某密闭容器中通入一定量的原料气,只发生①②两个反应。维持压强为3.2MPa,测得不同温度下,反应经过相同时间时 的转化率、甲醇的选择性如图所示:
的转化率、甲醇的选择性如图所示:
 。
。①从图中曲线的变化趋势分析a点之后温度升高,甲醇选择性降低的原因
②
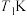 时,若反应在催化剂的活性范围内,反应从开始到达到a点所用时间为10min,则
时,若反应在催化剂的活性范围内,反应从开始到达到a点所用时间为10min,则 的分压=
的分压=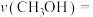

 指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数×p总,最终结果用分数表示)。
指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数×p总,最终结果用分数表示)。Ⅱ.近年来,有研究人员用
 通过电催化生成多种燃料,实现
通过电催化生成多种燃料,实现 的回收利用,其工作原理如图所示:
的回收利用,其工作原理如图所示: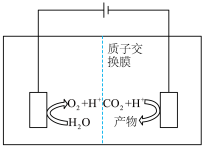
 ,则该电极反应式为
,则该电极反应式为
您最近半年使用:0次
名校
解题方法
2 .  回收与利用是实现“双碳达标”的重要途径。工业上利用
回收与利用是实现“双碳达标”的重要途径。工业上利用 催化还原制备
催化还原制备 原理:
原理:
i.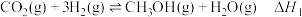
ii.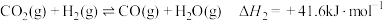
(1)反应 部分反应历程如图甲所示(已知:
部分反应历程如图甲所示(已知: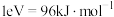 ;标“*”的为吸附在催化剂上的物质)。
;标“*”的为吸附在催化剂上的物质)。___________ 。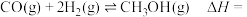
___________  。
。
(2)在恒容密闭容器中充入 和
和 ,加入固体催化剂M,若只发生反应
,加入固体催化剂M,若只发生反应 ,下列说法正确的是___________(填标号)。
,下列说法正确的是___________(填标号)。
(3)在密闭容器中充入 和
和 ,发生上述反应
,发生上述反应 和
和 ,测得
,测得 的平衡转化率与压强
的平衡转化率与压强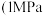 、
、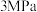 、
、 、温度
、温度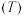 的关系如图乙所示。
的关系如图乙所示。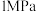 的曲线是
的曲线是___________ (填“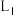 ”“
”“ ”或“
”或“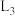 ”),判断依据是
”),判断依据是___________ 。温度升高,三条曲线逐渐靠近的主要原因是___________ 。
②W点时, 的物质的量为amol,则500℃反应ii的平衡常数
的物质的量为amol,则500℃反应ii的平衡常数 为
为___________ (用含 的代数式表示,用平衡分压代替平衡浓度计算的平衡常数为
的代数式表示,用平衡分压代替平衡浓度计算的平衡常数为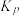 ,分压=总压
,分压=总压 物质的量分数)。
物质的量分数)。
(4)我国科学家开发了高效电催化装置,实现 在酸性条件下氢化制备
在酸性条件下氢化制备 。阴极反应式为
。阴极反应式为___________ 。
 回收与利用是实现“双碳达标”的重要途径。工业上利用
回收与利用是实现“双碳达标”的重要途径。工业上利用 催化还原制备
催化还原制备 原理:
原理:i.
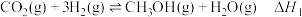
ii.
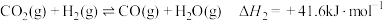
(1)反应
 部分反应历程如图甲所示(已知:
部分反应历程如图甲所示(已知: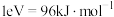 ;标“*”的为吸附在催化剂上的物质)。
;标“*”的为吸附在催化剂上的物质)。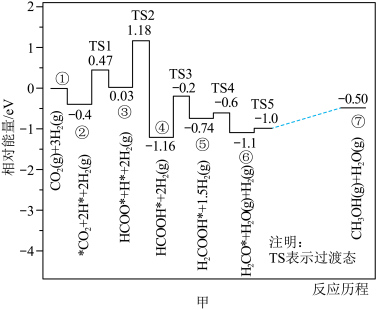
 。
。(2)在恒容密闭容器中充入
 和
和 ,加入固体催化剂M,若只发生反应
,加入固体催化剂M,若只发生反应 ,下列说法正确的是___________(填标号)。
,下列说法正确的是___________(填标号)。A.达到平衡时放出热量为 | B. 体积分数不变时一定达到平衡状态 体积分数不变时一定达到平衡状态 |
C.增大 的质量, 的质量, 的平衡转化率增大 的平衡转化率增大 | D.平衡后充入少量 ,平衡不移动 ,平衡不移动 |
(3)在密闭容器中充入
 和
和 ,发生上述反应
,发生上述反应 和
和 ,测得
,测得 的平衡转化率与压强
的平衡转化率与压强 、
、 、
、 、温度
、温度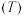 的关系如图乙所示。
的关系如图乙所示。
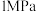 的曲线是
的曲线是 ”“
”“ ”或“
”或“ ”),判断依据是
”),判断依据是②W点时,
 的物质的量为amol,则500℃反应ii的平衡常数
的物质的量为amol,则500℃反应ii的平衡常数 为
为 的代数式表示,用平衡分压代替平衡浓度计算的平衡常数为
的代数式表示,用平衡分压代替平衡浓度计算的平衡常数为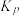 ,分压=总压
,分压=总压 物质的量分数)。
物质的量分数)。(4)我国科学家开发了高效电催化装置,实现
 在酸性条件下氢化制备
在酸性条件下氢化制备 。阴极反应式为
。阴极反应式为
您最近半年使用:0次
名校
解题方法
3 . Ⅰ.铁是生产生活、科学研究中的重要物质,研究与Fe相关的反应时要关注反应的快慢和程度,某些有铁参与的反应可设计成原电池。
(1)以下是相同条件下,等体积等浓度的H2O2溶液分解的对比实验时,放出 O2的体积随时间的变化关系示意图(线a为使用FeCl3作催化剂,线b为不使用催化剂),其中正确的图像是______(填字母)。
Ⅱ.已知下列热化学为程式:
①Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H1=﹣25 kJ·mol-1
②Fe2O3(s)+CO(g) = 2FeO(s)+CO2(g) △H2=﹣3 kJ·mol-1
(2)写出Fe被CO2氧化成FeO(s) 和 CO的热化学方程式_______ 。
一定温度下,向某密闭容器中加入足量铁并充入一定量的CO2气体,发生第(2)题的反应。反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。_____ v逆(CO2)(填“>”“<”或“=”)。
(4)0~4min内, CO的平均反应速率v(CO)=____ 。
(5)仅改变下列条件,化学反应速率减小的是___ (填字母)。
A.减少铁的质量 B.降低温度 C.保持压强不变,充入He使容器的体积增大
Ⅲ.某化学兴趣小组利用反应Cu + 2FeCl3 = CuCl2 + 2FeCl2,设计了如图所示的原电池装置。___ 极(填“正”或“负”),。
(7)写出b电极上的电极反应式______ 。
(1)以下是相同条件下,等体积等浓度的H2O2溶液分解的对比实验时,放出 O2的体积随时间的变化关系示意图(线a为使用FeCl3作催化剂,线b为不使用催化剂),其中正确的图像是______(填字母)。
A. | B.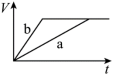 |
C.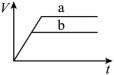 | D.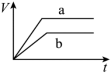 |
Ⅱ.已知下列热化学为程式:
①Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H1=﹣25 kJ·mol-1
②Fe2O3(s)+CO(g) = 2FeO(s)+CO2(g) △H2=﹣3 kJ·mol-1
(2)写出Fe被CO2氧化成FeO(s) 和 CO的热化学方程式
一定温度下,向某密闭容器中加入足量铁并充入一定量的CO2气体,发生第(2)题的反应。反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。
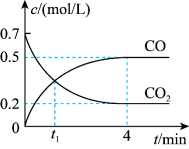
(4)0~4min内, CO的平均反应速率v(CO)=
(5)仅改变下列条件,化学反应速率减小的是
A.减少铁的质量 B.降低温度 C.保持压强不变,充入He使容器的体积增大
Ⅲ.某化学兴趣小组利用反应Cu + 2FeCl3 = CuCl2 + 2FeCl2,设计了如图所示的原电池装置。
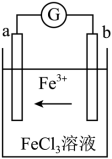
(7)写出b电极上的电极反应式
您最近半年使用:0次
名校
解题方法
4 . 环氧乙烷是重要的杀菌剂和工业合成原料。
Ⅰ.乙烯氧化法制环氧乙烷

(1)主反应的各基元反应活化能如下:
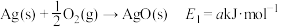 慢
慢
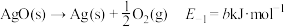 慢
慢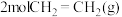 和
和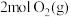 ,达到平衡时
,达到平衡时 的转化率为
的转化率为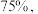
 的选择性为
的选择性为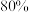 ,则平衡时用各组分的物质的量分数表示主反应的化学平衡常数
,则平衡时用各组分的物质的量分数表示主反应的化学平衡常数
______ (保留2位有效数字)。已知:环氧乙烷选择性
Ⅱ.电化学合成环氧乙烷
某电化学合成环氧乙烷同时处理酸性含铬废水的原理如图。______ 离子交换膜(填“阴”或“阳”),电极M反应为______ 。
(4)酸性废水质量每增大 ,制得环氧乙烷
,制得环氧乙烷______ g。
Ⅲ.环氧乙烷制乙二醇
水与环氧乙烷分别在酸性和碱性介质中制乙二醇(MEG)的反应机理如下图,同时生成副产物(DEG)。
酸性条件: 的作用是
的作用是______ ,中间体1结构简式______ ,DEG结构简式______ 。
Ⅰ.乙烯氧化法制环氧乙烷


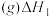
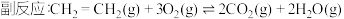

(1)主反应的各基元反应活化能如下:
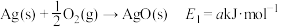 慢
慢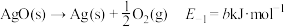 慢
慢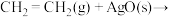

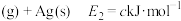 快
快

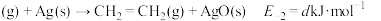 快
快

 (用含a,b,c,d的代数式表示),增大乙烯浓度
(用含a,b,c,d的代数式表示),增大乙烯浓度 的生成速率
的生成速率
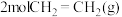 和
和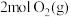 ,达到平衡时
,达到平衡时 的转化率为
的转化率为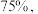
 的选择性为
的选择性为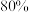 ,则平衡时用各组分的物质的量分数表示主反应的化学平衡常数
,则平衡时用各组分的物质的量分数表示主反应的化学平衡常数

Ⅱ.电化学合成环氧乙烷
某电化学合成环氧乙烷同时处理酸性含铬废水的原理如图。
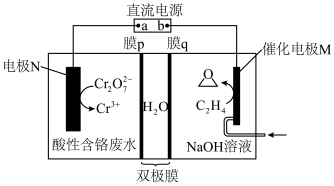
(4)酸性废水质量每增大
 ,制得环氧乙烷
,制得环氧乙烷Ⅲ.环氧乙烷制乙二醇
水与环氧乙烷分别在酸性和碱性介质中制乙二醇(MEG)的反应机理如下图,同时生成副产物(DEG)。
酸性条件:
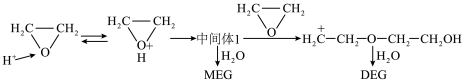

 的作用是
的作用是
您最近半年使用:0次
5 . 研究氮的相关化合物在化工生产中有重要意义。
(1)氨的催化氧化是制备硝酸的重要反应,实验中先用酒精喷灯加热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上。下列图示中,能够正确表示该反应过程能量变化的是_______ (填标号)。 ,通入等物质的量的NO和
,通入等物质的量的NO和 气体,
气体, 随时间的变化如下表:
随时间的变化如下表:
①0~2s内,v(O2)=_______ 。
②某同学由数据推测,反应在第4s时恰好达到平衡状态。该推测_______ (填“正确”或“不正确”)。
③在第5s时, 的转化率为
的转化率为_______ 。
④平衡时,容器中混合气体的压强与反应开始时的压强之比为_______ 。
能判断该反应已经达到化学平衡的是_______ 。
A.2v(NO)正=v(O2)逆
B.密闭容器中气体的颜色不变
C.密闭容器中混合气体的密度不变
D.密闭容器中混合气体的平均相对分子质量不变
(3)为减少汽车尾气的污染,逐步向着新能源汽车发展。肼(N2H4)—空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景,其工作原理如图所示,_______ 。
②电池工作时, 移向
移向_______ 电极(填“a”或“b”)。
③空气中氧气的体积分数为20%,当电池负极消耗19.2g肼(N2H4)时,消耗标准状况下空气的体积为_______ L。
(1)氨的催化氧化是制备硝酸的重要反应,实验中先用酒精喷灯加热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上。下列图示中,能够正确表示该反应过程能量变化的是
A.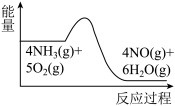 B.
B.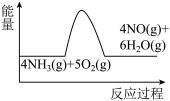 C.
C.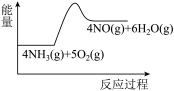
 ,通入等物质的量的NO和
,通入等物质的量的NO和 气体,
气体,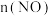 随时间的变化如下表:
随时间的变化如下表:| t/s | 0 | 1 | 2 | 3 | 4 | 5 |
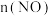 /(×10-3mol) /(×10-3mol) | 2.0 | 1.2 | 0.8 | 0.5 | 0.4 | 0.4 |
②某同学由数据推测,反应在第4s时恰好达到平衡状态。该推测
③在第5s时,
 的转化率为
的转化率为④平衡时,容器中混合气体的压强与反应开始时的压强之比为
能判断该反应已经达到化学平衡的是
A.2v(NO)正=v(O2)逆
B.密闭容器中气体的颜色不变
C.密闭容器中混合气体的密度不变
D.密闭容器中混合气体的平均相对分子质量不变
(3)为减少汽车尾气的污染,逐步向着新能源汽车发展。肼(N2H4)—空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景,其工作原理如图所示,
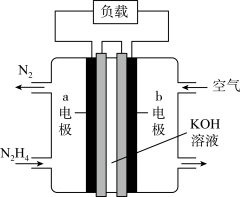
②电池工作时,
 移向
移向③空气中氧气的体积分数为20%,当电池负极消耗19.2g肼(N2H4)时,消耗标准状况下空气的体积为
您最近半年使用:0次
解题方法
6 . Ⅰ.随着碳中和目标的提出,CO2回收技术已成为科学研究热点问题,其中逆水煤气变换反应引起了广泛关注。该反应是将CO2加氢转化为CH3OH等高附加值化学品的关键步骤。
在催化剂作用下,逆水煤气变换体系中存在以下反应:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g);∆H1= ‒ 49.5 kJ∙mol-1;K1
CH3OH(g)+H2O(g);∆H1= ‒ 49.5 kJ∙mol-1;K1
②CO2(g)+H2(g) CO(g)+H2O(g);∆H2= 41.2 kJ∙mol-1;K2
CO(g)+H2O(g);∆H2= 41.2 kJ∙mol-1;K2
③CO(g)+2H2(g) CH3OH(g);∆H3= ‒ 90.7 kJ∙mol-1;K3
CH3OH(g);∆H3= ‒ 90.7 kJ∙mol-1;K3
(1)K1=___________ (用K2、K3表示)。
Ⅱ.将6 mol CO2和8 mol H2充入容积为2L的密闭容器中,分别在T1、T2温度下发生反应①,H2的物质的量变化如表所示:
(2)T1温度下,5~10min内以CO2表示该反应速率v(CO2)=___________ 。该温度下,若各物质的起始量n(CO2) = n(H2) = n(CH3OH) = n(H2O) = 2 mol,则v(正)___________ v(逆)。
A.> B.= C.<
(3)下列说法正确的是___________。
Ⅲ.一定条件下,将原料气n(CO2)∶n(H2)=1∶3进行投料,在恒容密闭容器中模拟上述三个反应,CO和CH3OH在含碳产物(CH3OH和CO)中物质的量分数及CO2的平衡转化率随温度变化的情况如图所示___________ 。曲线___________ 代表CH3OH在含碳产物中物质的量分数。
A.m B.n
(5)有利于提高CO2转化为CH3OH的平衡转化率的措施有___________。
Ⅳ.光催化CO2也可以制备甲醇、甲烷等燃料,反应原理示意图如下图所示:
(7)写出a区的电极反应式___________ 。
在催化剂作用下,逆水煤气变换体系中存在以下反应:
①CO2(g)+3H2(g)
 CH3OH(g)+H2O(g);∆H1= ‒ 49.5 kJ∙mol-1;K1
CH3OH(g)+H2O(g);∆H1= ‒ 49.5 kJ∙mol-1;K1②CO2(g)+H2(g)
 CO(g)+H2O(g);∆H2= 41.2 kJ∙mol-1;K2
CO(g)+H2O(g);∆H2= 41.2 kJ∙mol-1;K2③CO(g)+2H2(g)
 CH3OH(g);∆H3= ‒ 90.7 kJ∙mol-1;K3
CH3OH(g);∆H3= ‒ 90.7 kJ∙mol-1;K3(1)K1=
Ⅱ.将6 mol CO2和8 mol H2充入容积为2L的密闭容器中,分别在T1、T2温度下发生反应①,H2的物质的量变化如表所示:
| 物质的量/mol | T1/℃ | T2/℃ | |||||
| 0 | 5min | 10min | 15min | 20min | 25min | 30min | |
| H2 | 8.0 | 3.5 | 2.0 | 2.0 | 1.7 | 1.5 | 1.5 |
(2)T1温度下,5~10min内以CO2表示该反应速率v(CO2)=
A.> B.= C.<
(3)下列说法正确的是___________。
| A.T1 < T2 |
| B.混合气体的密度保持不变时,反应已达到平衡 |
| C.平衡后向容器中充入稀有气体,平衡不发生移动 |
| D.加入合适的催化剂可以降低反应的活化能,∆H减小 |
Ⅲ.一定条件下,将原料气n(CO2)∶n(H2)=1∶3进行投料,在恒容密闭容器中模拟上述三个反应,CO和CH3OH在含碳产物(CH3OH和CO)中物质的量分数及CO2的平衡转化率随温度变化的情况如图所示
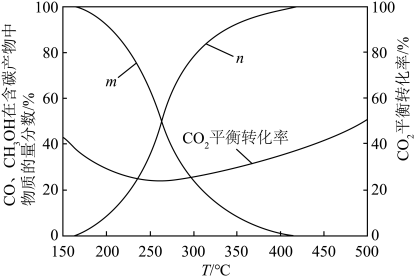
A.m B.n
(5)有利于提高CO2转化为CH3OH的平衡转化率的措施有___________。
| A.使用催化性能好的催化剂 | B.降低反应温度 |
| C.投料比不变,增加反应物的浓度 | D.增大CO2和H2的初始投料比 |
Ⅳ.光催化CO2也可以制备甲醇、甲烷等燃料,反应原理示意图如下图所示:
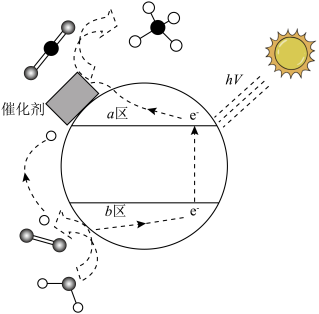
| A.H+由a区向b区移动 |
| B.b区电极反应为2H2O-4e-=O2↑+4H+ |
| C.CH4是氧化产物 |
| D.该装置实现了电能转化为化学能 |
(7)写出a区的电极反应式
您最近半年使用:0次
7 . Ⅰ 氨气被广泛用于化工、轻工、化肥、合成纤维、制药等领域,已知工业合成氨的反应为
氨气被广泛用于化工、轻工、化肥、合成纤维、制药等领域,已知工业合成氨的反应为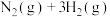

 气态分子中
气态分子中 化学键解离成气态原子所吸收的能量称为键能
化学键解离成气态原子所吸收的能量称为键能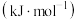 ,一些共价键的键能如下表所示。
,一些共价键的键能如下表所示。
(1)请根据上表数据计算,一定条件下,氮气与氢气生成 氨气时
氨气时___________  填“放出”或“吸收”
填“放出”或“吸收” 的热量为
的热量为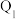 ,则
,则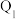 为
为___________  。
。
(2)在与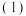 相同条件下,将
相同条件下,将 氮气和
氮气和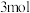 氢气放入一密闭容器中发生上述反应,放出或吸收的热量为
氢气放入一密闭容器中发生上述反应,放出或吸收的热量为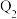 ,则
,则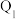 与
与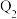 比较,正确的是
比较,正确的是___________ (填字母)。
A.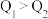 B.
B.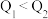 C.
C.
Ⅱ 一定条件下铁可以和
一定条件下铁可以和 发生反应:
发生反应: 。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的
。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的 气体,反应过程中
气体,反应过程中 气体和
气体和 气体的浓度与时间的关系如图所示。
气体的浓度与时间的关系如图所示。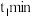 时,正、逆反应速率的大小关系为
时,正、逆反应速率的大小关系为
___________ 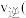 填“
填“ ”“
”“ ”或“
”或“ ”
” 。
。
(4)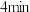 内,
内, 的平均反应速率
的平均反应速率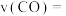
___________ 。
(5)下列条件的改变能减慢其反应速率的是___________ 。
①降低温度
 减小铁粉的质量
减小铁粉的质量
 保持压强不变,充入
保持压强不变,充入 使容器的容积增大
使容器的容积增大
 保持容积不变,充入
保持容积不变,充入 便体系压强增大
便体系压强增大
(6)下列描述能说明上述反应已达到平衡状态的是___________ 。
①
 单位时间内生成
单位时间内生成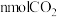 ,的同时生成
,的同时生成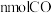
 容器中气体压强不随时间变化而变化
容器中气体压强不随时间变化而变化
④容器中气体的平均相对分子质量不随时间变化而变化
(7)燃料电池是燃料 如
如 、
、 、
、 等
等 跟氧气
跟氧气 或空气
或空气 反应将化学能转变成电能的装置,若电解质溶液是强碱溶液,下列关于一氧化碳燃料电池的说法正确的是___________
反应将化学能转变成电能的装置,若电解质溶液是强碱溶液,下列关于一氧化碳燃料电池的说法正确的是___________ 填字母
填字母 。
。
 氨气被广泛用于化工、轻工、化肥、合成纤维、制药等领域,已知工业合成氨的反应为
氨气被广泛用于化工、轻工、化肥、合成纤维、制药等领域,已知工业合成氨的反应为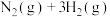

 气态分子中
气态分子中 化学键解离成气态原子所吸收的能量称为键能
化学键解离成气态原子所吸收的能量称为键能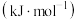 ,一些共价键的键能如下表所示。
,一些共价键的键能如下表所示。| 共价键 |  |  |  |
键能 | 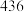 | 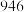 | 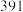 |
(1)请根据上表数据计算,一定条件下,氮气与氢气生成
 氨气时
氨气时 填“放出”或“吸收”
填“放出”或“吸收” 的热量为
的热量为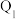 ,则
,则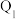 为
为 。
。(2)在与
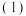 相同条件下,将
相同条件下,将 氮气和
氮气和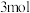 氢气放入一密闭容器中发生上述反应,放出或吸收的热量为
氢气放入一密闭容器中发生上述反应,放出或吸收的热量为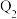 ,则
,则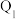 与
与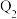 比较,正确的是
比较,正确的是A.
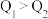 B.
B.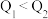 C.
C.
Ⅱ
 一定条件下铁可以和
一定条件下铁可以和 发生反应:
发生反应: 。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的
。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的 气体,反应过程中
气体,反应过程中 气体和
气体和 气体的浓度与时间的关系如图所示。
气体的浓度与时间的关系如图所示。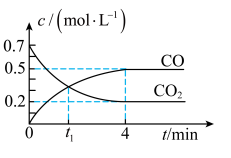
 时,正、逆反应速率的大小关系为
时,正、逆反应速率的大小关系为
 填“
填“ ”“
”“ ”或“
”或“ ”
” 。
。(4)
 内,
内, 的平均反应速率
的平均反应速率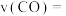
(5)下列条件的改变能减慢其反应速率的是
①降低温度
 减小铁粉的质量
减小铁粉的质量 保持压强不变,充入
保持压强不变,充入 使容器的容积增大
使容器的容积增大 保持容积不变,充入
保持容积不变,充入 便体系压强增大
便体系压强增大(6)下列描述能说明上述反应已达到平衡状态的是
①

 单位时间内生成
单位时间内生成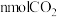 ,的同时生成
,的同时生成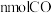
 容器中气体压强不随时间变化而变化
容器中气体压强不随时间变化而变化④容器中气体的平均相对分子质量不随时间变化而变化
(7)燃料电池是燃料
 如
如 、
、 、
、 等
等 跟氧气
跟氧气 或空气
或空气 反应将化学能转变成电能的装置,若电解质溶液是强碱溶液,下列关于一氧化碳燃料电池的说法正确的是___________
反应将化学能转变成电能的装置,若电解质溶液是强碱溶液,下列关于一氧化碳燃料电池的说法正确的是___________ 填字母
填字母 。
。A.正极反应式: |
B.负极反应式: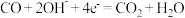 |
| C.随着放电的进行,溶液中氢氧根离子浓度保持不变 |
| D.放电时溶液中的阴离子向负极移动 |
您最近半年使用:0次
8 . I.回答下列问题
(1)下列变化中满足图示的是___________(填字母)。
(2)下图是在 101kPa、298K条件下,1mol NO₂气体和1mol CO反应生成 和 1mol NO 气体的能量变化的示意图。该反应的热化学方程式为
和 1mol NO 气体的能量变化的示意图。该反应的热化学方程式为___________ 。
(3)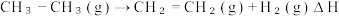 有关化学键的键能如上表所示。则该反应的反应热为ΔH=
有关化学键的键能如上表所示。则该反应的反应热为ΔH=___________ 。
Ⅱ. 近年来,我国化工技术获得重大突破,利用合成气(主要成分为 CO、CO₂和) 在催化剂的作用下合成甲醇(CH₃OH)是其中的一个研究项目。该研究发生的主要反应如下:
在催化剂的作用下合成甲醇(CH₃OH)是其中的一个研究项目。该研究发生的主要反应如下:
i. CO与H₂反应合成甲醇: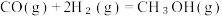
i i.CO₂与H₂反应合成甲醇:
(4)上述反应符合原子经济性的是反应___________ (i或ii)。
(5)在某一时刻采取下列措施,能使反应 i 的反应速率减小的措施是___________。
(6)一定温度下,在容积固定的密闭容器中发生反应ii,下列说法可以表明反应达到化学平衡状态的是___________。
(7)H₂还原 CO电化学法制备甲醇( 的工作原理如图所示:
的工作原理如图所示:___________ 极(填“正”或“负”),电池工作过程中  通过质子膜向
通过质子膜向___________ (填“左”或者“右”)移动,通入CO的一端发生的电极反应式为___________ 。
(1)下列变化中满足图示的是___________(填字母)。
| A.镁和稀盐酸的反应 |
B.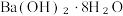 与NH₄Cl的反应 与NH₄Cl的反应 |
| C.NaOH 固体加入水中 |
| D.乙醇燃烧 |
(2)下图是在 101kPa、298K条件下,1mol NO₂气体和1mol CO反应生成
 和 1mol NO 气体的能量变化的示意图。该反应的热化学方程式为
和 1mol NO 气体的能量变化的示意图。该反应的热化学方程式为
| 化学键 | C——H | C=C | C—C | H—H |
| 键能/(kJ·mol⁻¹) | 414 | 615 | 347.7 | 436.4 |
(3)
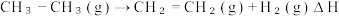 有关化学键的键能如上表所示。则该反应的反应热为ΔH=
有关化学键的键能如上表所示。则该反应的反应热为ΔH=Ⅱ. 近年来,我国化工技术获得重大突破,利用合成气(主要成分为 CO、CO₂和)
 在催化剂的作用下合成甲醇(CH₃OH)是其中的一个研究项目。该研究发生的主要反应如下:
在催化剂的作用下合成甲醇(CH₃OH)是其中的一个研究项目。该研究发生的主要反应如下:i. CO与H₂反应合成甲醇:
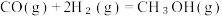
i i.CO₂与H₂反应合成甲醇:

(4)上述反应符合原子经济性的是反应
(5)在某一时刻采取下列措施,能使反应 i 的反应速率减小的措施是___________。
| A.恒温恒容下,再充入CO | B.升高温度 |
| C.恒温恒容下,向其中充入Ar | D.恒温恒压下,向其中充入 Ar |
(6)一定温度下,在容积固定的密闭容器中发生反应ii,下列说法可以表明反应达到化学平衡状态的是___________。
| A.单位时间内消耗 3molH₂, 同时生成1mol的 CH₃OH |
| B.CH₃OH 的体积分数不再发生变化 |
C.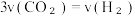 |
| D.容器内气体密度不再改变 |
(7)H₂还原 CO电化学法制备甲醇(
 的工作原理如图所示:
的工作原理如图所示: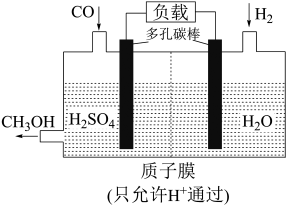
 通过质子膜向
通过质子膜向
您最近半年使用:0次
9 . 乙烯是世界上产量最大的化学产品之一,是合成纤维、合成橡胶基本化工原料。二氧化碳氧化乙烷脱氢制乙烯为生产乙烯提供了新途径。一定温度下, 与
与 在催化剂表面发生如下反应:
在催化剂表面发生如下反应:
Ⅰ.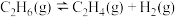
Ⅱ.
Ⅲ.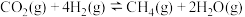
Ⅳ.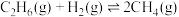
已知部分共价键的键能如下表所示:
回答下列问题:
(1)反应Ⅱ: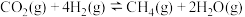

________  ,该反应的反应物和生成物中,属于
,该反应的反应物和生成物中,属于 杂化的原子种类有
杂化的原子种类有________ 种。
(2)用惰性气体与 混合作为反应气体时只发生反应Ⅰ:
混合作为反应气体时只发生反应Ⅰ: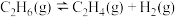 ,在923K、100kpa恒温恒压条件下,将
,在923K、100kpa恒温恒压条件下,将 的混合气体进行
的混合气体进行 脱氢反应,平衡时
脱氢反应,平衡时 的转化率为b,则该反应平衡常数
的转化率为b,则该反应平衡常数
________ kpa(用含a、b的代数式表示)。
(3)在一定条件下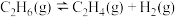
 反应达到平衡状态,当改变反应的某一条件后,下列变化能说明平衡一定向正反应方向移动的是________。
反应达到平衡状态,当改变反应的某一条件后,下列变化能说明平衡一定向正反应方向移动的是________。
(4)反应Ⅱ:
 是提高乙烯产率的关键,但同时发生副反应Ⅲ。
是提高乙烯产率的关键,但同时发生副反应Ⅲ。
①为提高反应Ⅱ的平衡转化率,应选择的反应条件为________ 。
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
②基于上述反应,在催化剂表面 与
与 发生脱氢制乙烯的总反应为:
发生脱氢制乙烯的总反应为: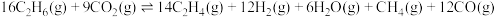 ,该反应温度常控制在600℃左右,其原因是
,该反应温度常控制在600℃左右,其原因是________ 。
(5)乙烯氯化反应合成1,2-二氯乙烷电化学装置如图所示,A、B为多孔铂电极分别通入乙烯和氯气。A电极的电极反应式为________ ,离子交换膜为________ (填“阴离子”或“阳离子”)交换膜。
 与
与 在催化剂表面发生如下反应:
在催化剂表面发生如下反应:Ⅰ.
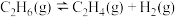
Ⅱ.

Ⅲ.
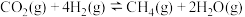
Ⅳ.
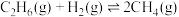
已知部分共价键的键能如下表所示:
共价键 | C-H | H-H | H-O | C=O |
键能 | 413 | 436 | 464 | 799 |
(1)反应Ⅱ:
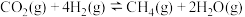

 ,该反应的反应物和生成物中,属于
,该反应的反应物和生成物中,属于 杂化的原子种类有
杂化的原子种类有(2)用惰性气体与
 混合作为反应气体时只发生反应Ⅰ:
混合作为反应气体时只发生反应Ⅰ: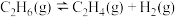 ,在923K、100kpa恒温恒压条件下,将
,在923K、100kpa恒温恒压条件下,将 的混合气体进行
的混合气体进行 脱氢反应,平衡时
脱氢反应,平衡时 的转化率为b,则该反应平衡常数
的转化率为b,则该反应平衡常数
(3)在一定条件下
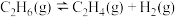
 反应达到平衡状态,当改变反应的某一条件后,下列变化能说明平衡一定向正反应方向移动的是________。
反应达到平衡状态,当改变反应的某一条件后,下列变化能说明平衡一定向正反应方向移动的是________。| A.正反应速率先增大后减小 | B.混合气体密度增大 |
| C.反应物的体积百分数增大 | D.化学平衡常数K值增大 |
(4)反应Ⅱ:

 是提高乙烯产率的关键,但同时发生副反应Ⅲ。
是提高乙烯产率的关键,但同时发生副反应Ⅲ。①为提高反应Ⅱ的平衡转化率,应选择的反应条件为
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
②基于上述反应,在催化剂表面
 与
与 发生脱氢制乙烯的总反应为:
发生脱氢制乙烯的总反应为: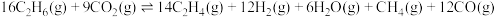 ,该反应温度常控制在600℃左右,其原因是
,该反应温度常控制在600℃左右,其原因是(5)乙烯氯化反应合成1,2-二氯乙烷电化学装置如图所示,A、B为多孔铂电极分别通入乙烯和氯气。A电极的电极反应式为
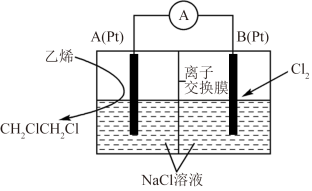
您最近半年使用:0次
10 . 氢能的开发和利用是推动我国能源结构转型,保障国家能源安全,实现“碳达峰”、“碳中和”目标的重要途径。目前,我国已成为世界第一大产氢国,主要有三类工业制氢路线:
(1)化工燃料重整制氢
已知:
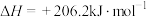

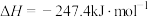
则 与
与 反应生成
反应生成 和
和 的反应热是
的反应热是___________  。
。
(2)工业副产氢
已知:工业上用水煤气法制氢气,有关化学方程式是:
反应一:
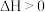
反应二:

①反应一在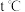 时达到化学平衡状态,则此温度下该反应的平衡常数表达式
时达到化学平衡状态,则此温度下该反应的平衡常数表达式
___________ 。
②在 时将
时将 和
和 各
各 通入体积为
通入体积为 的密闭容器中反应发生反应二,
的密闭容器中反应发生反应二, 时达到平衡状态,该反应的平衡常数是9,则
时达到平衡状态,该反应的平衡常数是9,则 的转化率是
的转化率是___________ ,用 的浓度变化表示的反应速率
的浓度变化表示的反应速率 是
是___________  。
。
(3)清洁能源电解制氢
已知:利用电解饱和食盐水可制得氢气,下图为电解装置示意图: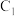 电极是极
电极是极___________ (填“阴”或“阳”),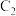 电极的电极反应式
电极的电极反应式___________ 。
②假设室温条件下电解 饱和食盐水一段时间,当两极产生的气体共
饱和食盐水一段时间,当两极产生的气体共 (标准状况下)时,溶液的
(标准状况下)时,溶液的 为
为___________ (溶液体积没有变化)。
(1)化工燃料重整制氢
已知:

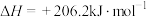

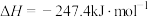
则
 与
与 反应生成
反应生成 和
和 的反应热是
的反应热是 。
。(2)工业副产氢
已知:工业上用水煤气法制氢气,有关化学方程式是:
反应一:

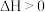
反应二:


①反应一在
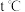 时达到化学平衡状态,则此温度下该反应的平衡常数表达式
时达到化学平衡状态,则此温度下该反应的平衡常数表达式
②在
 时将
时将 和
和 各
各 通入体积为
通入体积为 的密闭容器中反应发生反应二,
的密闭容器中反应发生反应二, 时达到平衡状态,该反应的平衡常数是9,则
时达到平衡状态,该反应的平衡常数是9,则 的转化率是
的转化率是 的浓度变化表示的反应速率
的浓度变化表示的反应速率 是
是 。
。(3)清洁能源电解制氢
已知:利用电解饱和食盐水可制得氢气,下图为电解装置示意图:

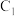 电极是极
电极是极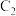 电极的电极反应式
电极的电极反应式②假设室温条件下电解
 饱和食盐水一段时间,当两极产生的气体共
饱和食盐水一段时间,当两极产生的气体共 (标准状况下)时,溶液的
(标准状况下)时,溶液的 为
为
您最近半年使用:0次