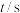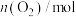(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH已知部分反应的热化学方程式如下:
CH3OH(g)+
 O2(g)=CO2(g)+2H2O(l) ΔH1 =a kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH1 =a kJ·mol-1H2(g)+
 O2(g)=H2O(l) ΔH2 =b kJ·mol-1
O2(g)=H2O(l) ΔH2 =b kJ·mol-1H2O(g) = H2O(l) ΔH3=c kJ·mol-1
则CO2(g)+3H2(g)
 H2O(g)+CH3OH(g) ΔH=
H2O(g)+CH3OH(g) ΔH=(2)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)
 2CO(g) ΔH, 反应达平衡后,测得压强、温度对CO的体积分数的影响如图1所示。
2CO(g) ΔH, 反应达平衡后,测得压强、温度对CO的体积分数的影响如图1所示。
回答下列问题:
①压强P1、P2、P3的大小关系是
②900℃、1.0MPa时,足量碳与amol CO2反应达平衡后,CO2的转化率为
 ,该反应的平衡常数Kp=
,该反应的平衡常数Kp=③以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g)
 CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如图2所示。250~300℃时,乙酸的生成速率降低的主要原因是
CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如图2所示。250~300℃时,乙酸的生成速率降低的主要原因是(3)以铅蓄电池为电源可将CO2转化为乙烯,其原理如图3所示,电解所用电极材料均为惰性电极。阴极上的电极反应式为
①CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH=+206 kJ·mol-1
CO(g)+3H2(g) ΔH=+206 kJ·mol-1②CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH=-41 kJ·mol-1
CO2(g)+H2(g) ΔH=-41 kJ·mol-1恒定压强为100 kPa时,将n(CH4)∶n(H2O)=1∶3的混合气体投入反应器中,平衡时,各组分的物质的量分数与温度的关系如下图所示。

回答下列问题:
(1)写出CH4与CO2生成H2和CO的热化学方程式:
(2)关于甲烷和水蒸气催化制氢反应,下列叙述正确的是
A.恒温、恒容条件下,加入惰性气体,压强增大,反应速率加快
B.恒温、恒容条件下,加入水蒸气,活化分子百分数增大,反应速率加快
C.升高温度,活化分子百分数增大,有效碰撞频率增大,反应速率加快
(3)系统中H2的含量,在700℃左右出现峰值,试从化学平衡的角度解释出现峰值的原因:
①低于700℃,
②高于700℃,
(4)反应①的平衡常数的表达式Kp=
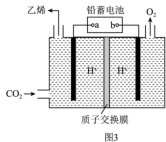
(5)利用微生物燃料电池处理某废水的工作原理如图所示。
该电池a电极反应式为
汽车尾气中含有
 、
、 、
、 等大气污染物,可发生以下反应:
等大气污染物,可发生以下反应:Ⅰ.
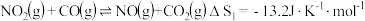
Ⅱ.

Ⅲ.
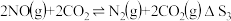
(1)
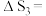
 忽略
忽略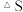 受温度的影响
受温度的影响 。
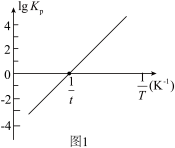
。(2)反应Ⅰ的平衡常数
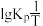 的关系如图
的关系如图 所示,则反应Ⅰ为
所示,则反应Ⅰ为 填“吸热”或“放热”
填“吸热”或“放热” 反应。温度为
反应。温度为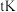 时,
时,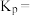
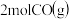 和
和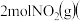 若只发生反应Ⅰ
若只发生反应Ⅰ ,测得起始压强为
,测得起始压强为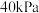 ,达到平衡时,
,达到平衡时, 的转化率为
的转化率为 的平衡分压为
的平衡分压为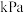 。
。
(3)将等物质的量的
 和
和 分别充入盛有催化剂
分别充入盛有催化剂 和
和 的体积相同的密闭容器中,进行反应Ⅲ,经过相同时间测量两容器中
的体积相同的密闭容器中,进行反应Ⅲ,经过相同时间测量两容器中 的含量,从而确定
的含量,从而确定 的转化率,结果如图
的转化率,结果如图 所示。试判断图像中
所示。试判断图像中 点是否一定处于平衡状态并分析原因:
点是否一定处于平衡状态并分析原因: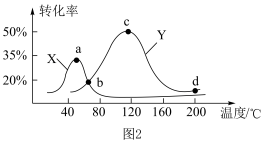
(4)间接电解法可对大气污染物
 进行无害化处理,工作原理如图
进行无害化处理,工作原理如图 所示,质子膜允许
所示,质子膜允许 和
和 通过。
通过。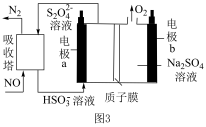
①电极
 的电极反应式为
的电极反应式为②工作时有
 通过质子膜时,理论上可处理标准状况下
通过质子膜时,理论上可处理标准状况下 的体积为
的体积为 。
。
4 . 近日,科学家开发新型催化剂实现一氧化二氮对C4馏分中2-丁烯的气相选择性氧化,反应原理如下:
反应l:CH3CH=CHCH3(g)+N2O(g)⇌CH3CH2COCH3(g)+N2(g) △H1
反应2:CH3CH=CHCH3(g)+2N2O(g)⇌2CH3CHO(g)+2N2(g) △H2<0
(1)几种共价键的键能数据如下表所示。
共价键 | C-H | C-C | C=C | C=O | N≡N | N=O | N=N |
键能/kJ·mol-1 | 413 | 347 | 614 | 745 | 945 | 607 | 418 |
已知N2O的结构与CO2相似,可表示为N=N=O。根据键能估算:△H1=
(2)某温度下,向恒压密闭容器中充入CH3CH=CHCH3(g)和N2O(g),发生上述反应1和反应2,测得平衡体系中N2的体积分数与起始投料比[
 ]的关系如图1所示,那么在M、N、Q三点中,CH3CH=CHCH3(g)的转化率由小到大排序为
]的关系如图1所示,那么在M、N、Q三点中,CH3CH=CHCH3(g)的转化率由小到大排序为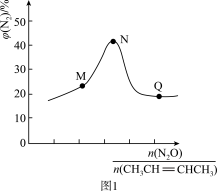
(3)已知:阿伦尼乌斯经验公式为Rlnk=-
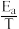 +C(R、C为常数,T为热力学温度,k为速率常数,Ea为活化能)。测得反应1在不同催化剂Cat1、Cat2作用下,Rlnk与温度的倒数关系如图2所示,以此判断催化效果较高的催化剂是
+C(R、C为常数,T为热力学温度,k为速率常数,Ea为活化能)。测得反应1在不同催化剂Cat1、Cat2作用下,Rlnk与温度的倒数关系如图2所示,以此判断催化效果较高的催化剂是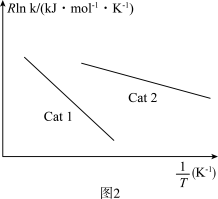
(4)在反应器中充入1mol2-丁烯和2molN2O(g),发生上述反应,测得2-丁烯的平衡转化率与温度、压强的关系如图3所示,X点时丁酮(CH3CH2COCH3)的选择性为
 。
。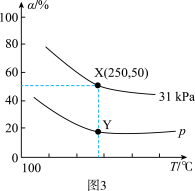
已知:[CH3CH2COCH3的选择性= ]
]
①其他条件不变,升高温度,2-丁烯的平衡转化率降低的原因是
②p
③Y点反应1的压强平衡常数Kp为
(5)以熔融碳酸盐(如K2CO3)为电解质,丁烯(C4H8/空气燃料电池的能量转化率较高。电池总反应为C4H8+6O2=4CO2+4H2O,则负极的电极方程式为
Ⅰ、乙烯气相直接水合法制乙醇
(1)已知:
①2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ/mol
②2CH3OH(g)=C2H4(g)+2H2O(g) △H2=-29.1 kJ/mol'
③C2H5OH(g)=CH3OCH3(g) △H3= + 50.6 kJ/mol
则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的△H=
(2)已知等物质的量的C2H4和H2O的混合气体在一定的条件下反应,乙烯的平衡转化率与温度、压强的关系如图。
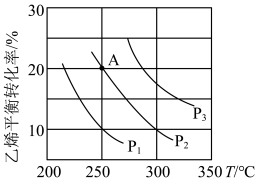
①写出一种提高C2H4平衡转化率的措施
②图中压强P1、P2、P3 由小到大的顺序为
③乙烯水合制乙醇反应在图中A点(P2=8.1MPa)的平衡常数表达式为:
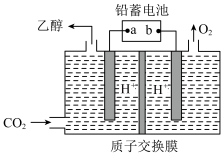
Ⅱ、电解法制乙醇
(3)以铅蓄电池为电源可将CO2转化为乙醇,其原理如图所示,电极材料均为惰性电极。该电解池阴极上的电极反应式为
(1)NH3(g)和O2(g)发生反应的反应历程如图所示。
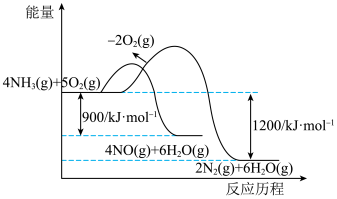
 5N2(g)+6H2O(g)的△H=
5N2(g)+6H2O(g)的△H=(2)在密闭容器中充入4molNH3和5molNO,反应4NH3(g)+6NO(g)
 5N2(g)+6H2O(g)平衡时NH3的物质的量分数随温度、压强的变化关系如图。
5N2(g)+6H2O(g)平衡时NH3的物质的量分数随温度、压强的变化关系如图。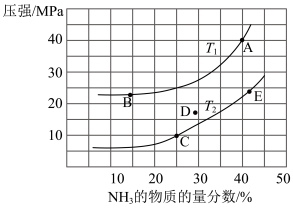
A.其他条件不变,升高温度平衡逆向移动
B.其他条件不变,增大压强,平衡不移动
C.NH3的质量不变时,则达到平衡状态
D.加入催化剂,则可以提高NO的平衡转化率
E.加入催化剂,能降低△H,加快化学反应速率
②A点NH3的平衡转化率为
③从平衡浓度的角度写出该反应的平衡常数表达式为K=
(3)以多孔石墨为电极的碱性电解池处理氮氧化物,装置如图:
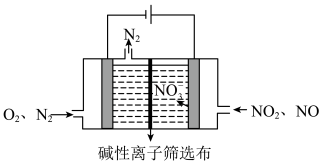
②当电路中转移2mol电子时,阴极放电的O2的质量为
(1)用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)=HNO3(aq)+HNO2(aq) ΔH=-116.1kJ·mol-1
3HNO2(aq)=HNO3(aq)+2NO(g)+H2O(l) ΔH=+75.9kJ·mol-1
反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)的ΔH=
(2)电化学氧化法是一种高效去除废水中硫化物的方法,电解NaHS溶液脱硫的原理如图1所示。碱性条件下,HS-首先被氧化生成中间产物S
 ,S
,S 容易被继续氧化而生成硫单质。
容易被继续氧化而生成硫单质。
①阳极HS-氧化为S
 的电极反应式为
的电极反应式为②电解一段时间后,阳极的石墨电极会出现电极钝化,导致电极反应不能够持续有效进行,其原因是
(3)新型氨法烟气脱硫技术采用氨吸收烟气中的SO2生成亚硫酸铵和亚硫酸氢铵。亚硫酸铵又可用于燃煤烟道气脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式
(4)在一定条件下,CO可以去除烟气中的SO2,其反应原理为2CO+SO2=2CO2+S。其他条件相同、以比表面积大的γ—Al2O3作为催化剂,研究表明,γ—Al2O3在240℃以上发挥催化作用。反应相同的时间,SO2的去除率随反应温度的变化如图2所示。
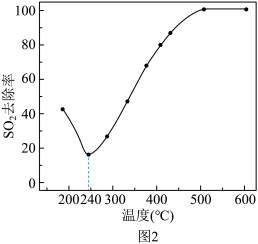
240℃以前,随着温度的升高,SO2去除率降低的原因是
I.二氧化碳合成“合成气”
(1)捕获的高浓度CO2能与CH4制备合成气(CO、H2),该过程主要涉及以下反应:
①
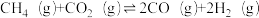 ;△H1
;△H1②
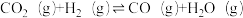 ;△H2
;△H2③
 ;△H3
;△H3④
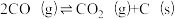 ;△H4
;△H4根据盖斯定律,反应①的△H1=
Ⅱ.二氧化碳合成低碳烯烃
(2)用可再生能源电还原CO2时,采用高浓度的K+抑制酸性电解液中的析氢反应来提高乙烯的生成率,装置如图1所示。阴极发生的反应为
每转移1mol电子,阳极生成
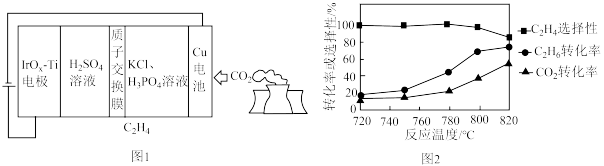
(3)以CO2、C2H6为原料合成C2H4涉及的主要反应如下:
A.
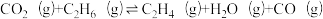 ;
; (主反应)
(主反应)B.
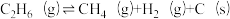 ;
;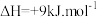 (副反应)
(副反应)其中,反应A的反应历程可分为如下两步:
A.
 ;△H1(反应速率较快)
;△H1(反应速率较快)B.
 ;
;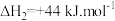 (反应速率较慢)
(反应速率较慢)相比于提高c(C2H6),则提高c(CO2)对反应A速率影响更大,原因是
向恒压密闭容器中充入CO2和C2H6合成C2H4,发生主反应,温度对催化剂KFeMn/Si2性能的影响如图2所示,工业生产综合各方面的因素,反应选择800℃的原因是
Ⅲ.二氧化碳合成甲醇
主反应:
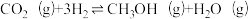 ;
;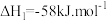
副反应:
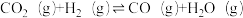 ;
;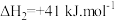
某一刚性容器中充入1molCO2和3molH2,在催化剂存在条件下进行反应,测得温度与平衡转化率、产物选择性的关系如图3所示。已知:CH3OH选择性=
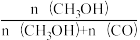
(4)240℃平衡时,生成的CH3OH的物质的量是

Ⅳ、新型二氧化碳固定法
(5)某课题组设计一种新型的固定CO2方法,如图4所示。若原料用
 ,则产物为
,则产物为(1)甲烷的制备原理之一为

 ,有关反应的热化学方程式如下:
,有关反应的热化学方程式如下:i.

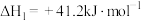 ;
;ii.

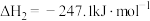 。
。①

 。
。②反应

 自发进行的条件为
自发进行的条件为③反应i:

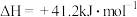 的反应速率表达式为
的反应速率表达式为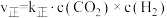 ,
,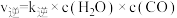 (
( 、
、 为速率常数,与温度、催化剂有关),若平衡后升高温度,则
为速率常数,与温度、催化剂有关),若平衡后升高温度,则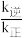
(2)乙醇的制备原理之一为
 。一定条件下,在一密闭容器中充入
。一定条件下,在一密闭容器中充入 和
和 发生该反应,图甲表示压强为
发生该反应,图甲表示压强为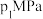 或
或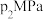 下
下 的平衡转化率与温度的关系。
的平衡转化率与温度的关系。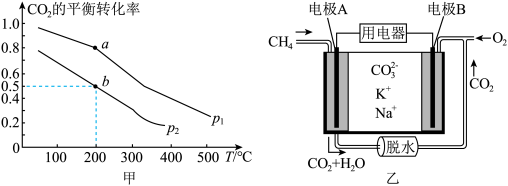

 。
。②b点对应的平衡常数

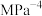 (列出含
(列出含 的算式即可,
的算式即可, 为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。
为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。③若在恒容绝热的容器中发生该反应,下列情况下反应一定达到平衡状态的是
A.容器内的压强不再改变
B.容器内气体密度不再改变
C.容器内
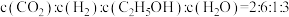
D.断开C=O键与形成H-H键的数目之比为2∶3
(3)一种高性能甲烷燃料电池的工作原理如图乙所示,以熔融碳酸盐(
 )为电解质。
)为电解质。①电势比较:电极A
②该燃料电池负极的电极反应式为
 )、肼(
)、肼( )煤油等。
)煤油等。(1)用偏二甲肼(
 )作燃料,四氧化二氮作氧化剂,生成氮气和二氧化碳气体。
)作燃料,四氧化二氮作氧化剂,生成氮气和二氧化碳气体。①写出该反应的化学方程式:
②反应物的总能量
(2)肼在碱性环境下可以形成肼—空气燃料电池,肼被氧化为
 ,该电池负极的反应式为
,该电池负极的反应式为 要转移电子的物质的量为
要转移电子的物质的量为(3)肼类推进剂在使用过程中要注意进行环境监测以免造成环境污染。臭氧是理想的烟气脱硝试剂,其脱硝反应为
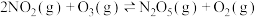 ,向甲、乙两个体积均为2.0L的恒容密闭容器中均充入2.0
,向甲、乙两个体积均为2.0L的恒容密闭容器中均充入2.0
 和1.0
和1.0
 ,分别在
,分别在 、
、 温度下,经过一段时间后达到平衡。反应过程中
温度下,经过一段时间后达到平衡。反应过程中 随时间t变化情况见下表:
随时间t变化情况见下表:
| 0 | 3 | 6 | 12 | 24 | 36 | |
甲容器( |
| 0 | 0.36 | 0.60 | 0.80 | 0.80 | 0.80 |
乙容器( |
| 0 | 0.30 | 0.50 | 0.70 | 0.85 | 0.85 |

 。(填“>”、“<”或“=”)
。(填“>”、“<”或“=”)②甲容器中,0~3s内的平均反应速率
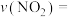
③乙容器中
 平衡转化率为
平衡转化率为④下列叙述能说明该反应达到化学平衡状态的是
A.混合气体的平均相对分子质量不变 B.v(生成
 )∶v(消耗
)∶v(消耗 )
)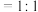
C.
 与
与 的转化率之比不变 D.混合气体密度不变
的转化率之比不变 D.混合气体密度不变E.容器内气体的总压强保持不变