 回收与利用是实现“双碳达标”的重要途径。工业上利用
回收与利用是实现“双碳达标”的重要途径。工业上利用 催化还原制备
催化还原制备 原理:
原理:i.
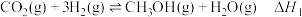
ii.
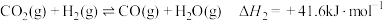
(1)反应
 部分反应历程如图甲所示(已知:
部分反应历程如图甲所示(已知: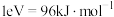 ;标“*”的为吸附在催化剂上的物质)。
;标“*”的为吸附在催化剂上的物质)。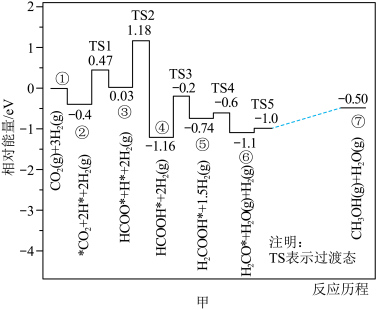
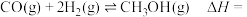
 。
。(2)在恒容密闭容器中充入
 和
和 ,加入固体催化剂M,若只发生反应
,加入固体催化剂M,若只发生反应 ,下列说法正确的是___________(填标号)。
,下列说法正确的是___________(填标号)。A.达到平衡时放出热量为 | B. 体积分数不变时一定达到平衡状态 体积分数不变时一定达到平衡状态 |
C.增大 的质量, 的质量, 的平衡转化率增大 的平衡转化率增大 | D.平衡后充入少量 ,平衡不移动 ,平衡不移动 |
(3)在密闭容器中充入
 和
和 ,发生上述反应
,发生上述反应 和
和 ,测得
,测得 的平衡转化率与压强
的平衡转化率与压强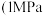 、
、 、
、 、温度
、温度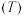 的关系如图乙所示。
的关系如图乙所示。
 的曲线是
的曲线是 ”“
”“ ”或“
”或“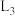 ”),判断依据是
”),判断依据是②W点时,
 的物质的量为amol,则500℃反应ii的平衡常数
的物质的量为amol,则500℃反应ii的平衡常数 为
为 的代数式表示,用平衡分压代替平衡浓度计算的平衡常数为
的代数式表示,用平衡分压代替平衡浓度计算的平衡常数为 ,分压=总压
,分压=总压 物质的量分数)。
物质的量分数)。(4)我国科学家开发了高效电催化装置,实现
 在酸性条件下氢化制备
在酸性条件下氢化制备 。阴极反应式为
。阴极反应式为相似题推荐
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(1) △H1=- 890.3 kJ/mol
2H2(g)+O2(g)=2H2O(1) △H2=-571.6 kJ/mol
C(s)+O2(g)=CO2(g) △H3=- 393.5 kJ/mol
C(s)+2H2(g)=CH4(g) △H=
(2) CH4制备合成气的原理是CH4(g)+CO2(g)
 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。①下列叙述不能表示该反应在恒温恒容条件下达到平衡状态的是
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中CO2、CO的物质的量的比值不再发生变化
d.混合气体的平均相对分子质量不再发生变化
②若1 g CH4(g)完全反应吸收热量为15.5 kJ。在恒容密闭容器中充入1 mol CH4和1 mol CO2在一定条件下反应,体系吸收热量随着时间变化如图所示。在该条件下,甲烷的最大转化率(a)为

(3)在密闭容器中只发生反应:2NO+H2=N2+2H2O,其反应速率与浓度关系式为v=kcm(NO)·cn(H2)。(k为常数,只与温度有关,m、n为反应级数,取正整数),在某温度下测得有关数据如表所示。
序数 | c(NO)/(mol/L) | c(H2)/(mol/L) | v/mol/(L·min ) |
I | 0.10 | 0.10 | 0.414 |
Ⅱ | 0.20 | 0.20 | 3.312 |
Ⅲ | 0.10 | 0.20 | 0.828 |
总反应分两步进行:第i步,2NO+H2=N2+H2O2(很慢);
第ii 步,H2O2+H2=2H2O (很快)。在上述温度下,当c(NO)=c(H2)=0.50 mol/L 时v=
(4)在2 L恒容密闭容器中充入3 mol NO(g)和3 mol CO(g),发生反应: 2NO(g)+2CO(g)
 N2(g)+2CO2(g),在一定温度下达到平衡,测得平衡体系中c(N2)=0.5 mol/L。则该条件下平衡常数K值为
N2(g)+2CO2(g),在一定温度下达到平衡,测得平衡体系中c(N2)=0.5 mol/L。则该条件下平衡常数K值为(1)羰基硫的水解反应和氢解反应是两种常用的脱硫方法:
水解反应:COS(g)+ H2O(g)
 H2S(g) +CO2(g) △H=-34kJ/mol
H2S(g) +CO2(g) △H=-34kJ/mol氢解反应:COS(g) +H2(g)
 H2S(g)+CO(g) △H=+7kJ/mol。
H2S(g)+CO(g) △H=+7kJ/mol。已知:2H2(g) +O2(g)=2H2O(g) △H=-484 kJ/mol。
写出表示CO燃烧热的热化学方程式:
(2)氢解反应达到平衡后,保持体系的温度和总压强不变,通入适量的He,正反应速率
(3)某温度下,向体积为2L的恒容密闭容器中通入2molCOS(g)和4molH2O(g),发生水解反应,5 min后反应达到平衡,测得COS(g)的转化率为75%。上述水解反应的平衡常数K=
2C(s)+O2(g)===2CO(g) ΔH1=-221.0 kJ·mol-1
N2(g)+O2(g)===2NO(g) ΔH2=+180.5 kJ/mol
2NO(g)+2CO(g)===2CO2(g)+N2(g) ΔH3=-746.0 kJ/mol
回答下列问题:
(1)用焦炭还原NO生成无污染气体的热化学方程式为
(2)在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中c(NO)(mo/L)随时间(s)的变化如下表:(已知:三个容器的反应温度分别为T甲=400 ℃、T乙=400 ℃、T丙=a ℃)
| 时间 | 0 s | 10 s | 20 s | 30 s | 40 s |
| 甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| 乙 | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| 丙 | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
甲容器中,该反应的平衡常数K=
(3)已知:8NH3(g)+6NO2(g)
 7N2(g)+12H2O(l),ΔH<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间的变化如图所示:
7N2(g)+12H2O(l),ΔH<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间的变化如图所示: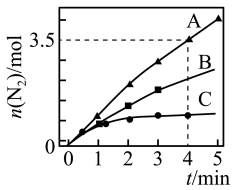
①在催化剂A的作用下0~4 min的v(NO2)=
②该反应活化能Ea(A)、Ea(B)、Ea(C)由小到大的顺序是
③下列说法不正确的是
a.使用催化剂A达平衡时,ΔH值更大
b.升高温度可使容器内气体颜色加深
c.单位时间内形成N—H键与O—H键的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡
 2SO3,因SO2在催化剂表面与O2接触而得名,反应过程示意图如下:
2SO3,因SO2在催化剂表面与O2接触而得名,反应过程示意图如下: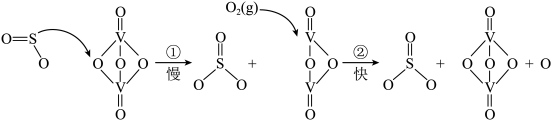
| A.SO2和SO3都属于酸性氧化物,通到BaCl2溶液中都会产生白色沉淀 |
| B.增大O2的浓度可以明显提高SO3的生成速率 |
| C.图示过程中既有V-O键的断裂又有V-O键的形成 |
| D.V2O5的作用是降低该反应的活化能,提高SO2的平衡转化率 |
Ⅱ.也可以用电化学原理,使用SO2制备硫酸,同时精制粗铜,装置如图所示。电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触,质子交换膜只允许H+通过。
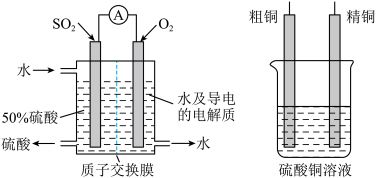
(3)假设粗铜中含有铁、锌杂质,工作一段时间后CuSO4溶液中的Cu2+浓度
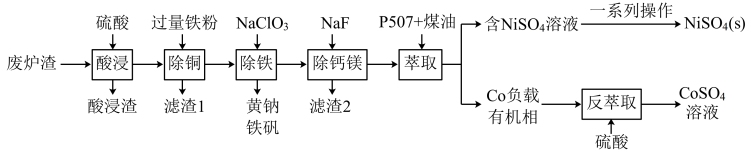
已知:i.酸浸液中的金属阳离子有Ni2+、Co2+、Cu2+、Mg2+、Ca2+等
ii.NiSO4在水中的溶解度随温度升高而增大
回答下列问题:
(1)提高“酸浸”速率的方法有
(2)“滤渣1”的主要成分是
(3)黄钠铁矾的化学式为Na2 Fe 6(SO4)4(OH)12,“除铁”的离子方程式为
(4)“除钙镁”时,随pH降低,NaF用量急剧增加,原因是
(5)镍、钴萃取率与料液pH、萃取剂体积与料液体积比Va:V0的关系曲线如下图所示,则“萃取”时应选择的pH和Va:V0分别为
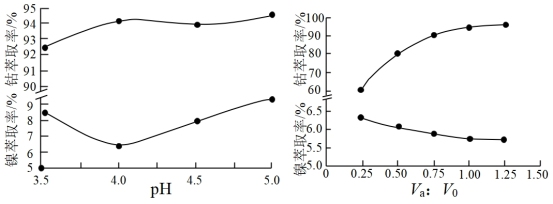
(6)获得NiSO4(s)的“一系列操作”是
(7)工艺流程中,可循环利用的物质是
I.化学链燃烧(CLC)是利用载氧体将空气中的氧传输至燃料的新技术,与传统燃烧方式相比,避免了空气和燃料的直接接触,有利于高效捕集CO2。基于CuO/Cu2O载氧体的甲烷化学链燃烧技术示意图如图。
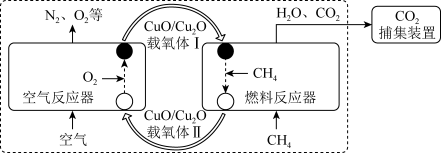
空气反应器与燃料反应器中发生的反应分别为:
①2Cu2O(s)+O2(g)
 4CuO(s) △H1=-227kJ·mol-1
4CuO(s) △H1=-227kJ·mol-1②8CuO(s)+CH4(g)
 4Cu2O(s)+CO2(g)+2H2O(g) △H2=-348kJ·mol-1
4Cu2O(s)+CO2(g)+2H2O(g) △H2=-348kJ·mol-1(1)反应②的平衡常数表达式K=
(2)氧的质量分数:载氧体I
(3)往盛有CuO/Cu2O载氧体的恒容密闭容器中充入空气【计算时空气中氧气的物质的量分数x(O2)近似为20%】,发生反应①。平衡时x(O2)随反应温度T变化的曲线如图所示。985℃时O2的平衡转化率α(O2)=
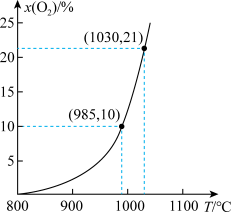
(4)根据图,平衡时x(O2)随温度升高而增大的原因是
(5)载氧体掺杂改性,可加快化学链燃烧速率。使用不同掺杂的CuO/Cu2O载氧体,反应②活化能如表所示。
| 载氧体掺杂物质 | 氧化铝 | 膨润土 |
| 活化能/kJ·mol-1 | 60 2.3 2.3 | 37.3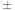 1.3 1.3 |
II.我国科学家研究Li—CO2二次电池,取得了重大科研成果,电池总反应是3CO2(g)+4Li(s)
 2Li2CO3(s)+C(s)。回答下列问题:
2Li2CO3(s)+C(s)。回答下列问题:
(6)Li—CO2电池中,Li为单质锂片,则该电池的放电过程中的CO2在
(7)已知:2CO2(g)+2Li(s)=Li2CO3(s)+CO(g) △H1=-539kJ·mol-1
 CO2(g)+
CO2(g)+ C(s)=CO(g) △H2=+86kJ·mol-1
C(s)=CO(g) △H2=+86kJ·mol-1充电过程总反应的热化学方程式为
(8)放电一段时间,吸收标准状况下33.6LCO2,测得正、负极的质量变化分别为△m1g和△m2g。假设有机电解质溶液的体积不变,则Li+的物质的量浓度
【推荐1】氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有广泛应用。回答下列问题:
(1)已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ·mol-1
2NH3(g) ΔH=-92.4kJ·mol-1
在恒温、恒容的密闭容器中,合成氨反应的各物质浓度的变化曲线如图所示。
①计算在该温度下反应2NH3(g) N2(g)+3H2(g)的平衡常数K=
N2(g)+3H2(g)的平衡常数K=
②在第25min末,保持其它条件不变,若将温度降低,在第35min末再次达到平衡。在平衡移动过程中N2浓度变化了0.5mol/L,请在图中画出25-40minNH3浓度变化曲线。
③已知:2N2(g)+6H2O(l)
 4NH3(g)+3O2(g)△H=+1530.0kJ/mol,则氢气的热值为
4NH3(g)+3O2(g)△H=+1530.0kJ/mol,则氢气的热值为
(2)① N2H4是一种高能燃料具有还原性,通常用NaClO与过量NH3反应制得,请解释为什么用过量氨气反应的原因:
②用NaClO与NH3制N2H4的反应是相当复杂的,主要分为两步:
已知第一步:NH3+ClO-=OH-+NH2Cl
请写出第二步离子方程式:
③ N2H4易溶于水,是与氨相类似的弱碱,已知其常温下电离常数K1=1.0×10-6,常温下,将0.2 mol/L N2H4·H2O与0.lmol/L,盐酸等体积混合(忽略体积变化)。则此时溶液的pH等于
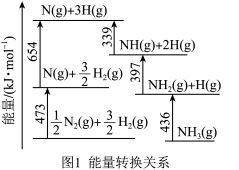
(1)根据图1数据计算反应
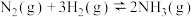 的
的
 。
。(2)在Fe的催化作用下的反应历程如下(*表示吸附态):
化学吸附:
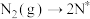 ;
;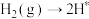 。
。表面反应:
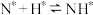 ;
;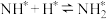 ;
;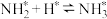
脱附:
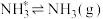 。
。其中,
 的吸附分解反应活化能高、反应速率慢,决定了合成氨的整体反应速率。实际生产中,原料气中
的吸附分解反应活化能高、反应速率慢,决定了合成氨的整体反应速率。实际生产中,原料气中 和
和 物质的量之比为1:2.8.分析说明原料气中
物质的量之比为1:2.8.分析说明原料气中 过量的两个理由
过量的两个理由(3)在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为
 ,另一种为
,另一种为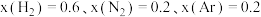 。
。
①图中压强
 由大到小的顺序为
由大到小的顺序为②进料组成中不含有惰性气体Ar的图是
③图3中,当
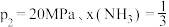 时,氮气的转化率
时,氮气的转化率
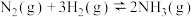 的平衡常数
的平衡常数
 (以
(以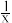 形式表示)。
形式表示)。
该反应体系中涉及以下两个反应:
Ⅰ.

Ⅱ.

回答下列问题:
(1)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
| A.增大CO的浓度,反应Ⅰ的平衡向正反应方向移动 |
| B.降低温度,反应Ⅰ和Ⅱ的正、逆反应速率都减小 |
| C.恒温恒容下充入氦气,反应Ⅰ的平衡向正反应方向移动 |
| D.增大压强,反应Ⅰ和Ⅱ重新达到平衡的时间不同 |
 (温度的倒数)的变化如图所示。
(温度的倒数)的变化如图所示。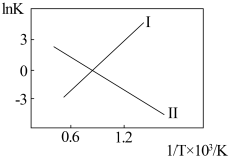
试判断升高温度,反应
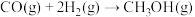 的化学平衡常数
的化学平衡常数(3)恒压下将CO2和H2按体积比1∶3混合,在不同催化剂作用下发生反应Ⅰ和反应Ⅱ,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。
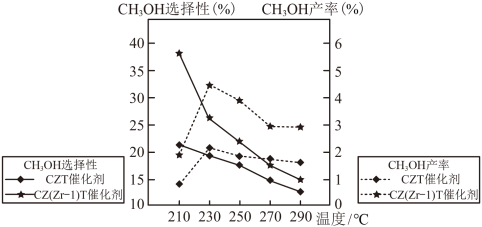
其中:CH3OH的选择性
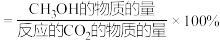
①在上述条件下合成甲醇的工业条件是
A.210℃ B.230℃ C.催化ZT D.催化剂CZ(Zr-1)T
②在230℃以上,升高温度CO2的转化率增大,但甲醇的产率降低,原因是
(4)恒温恒压密闭容器中,加入2molCO2和4molH2,只发生反应Ⅰ和反应Ⅱ,初始压强为p0,在300℃发生反应,反应达平衡时,CO2的转化率为50%,容器体积减小20%。则反应Ⅱ的平衡常数K=
(5)已知对于反应Ⅰ,
 ,
,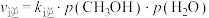 。其中
。其中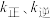 分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K下,按初始投料比
分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K下,按初始投料比 分别为3∶1、1∶1、1∶3,得到不同压强条件下H2的平衡转化率关系如图所示。
分别为3∶1、1∶1、1∶3,得到不同压强条件下H2的平衡转化率关系如图所示。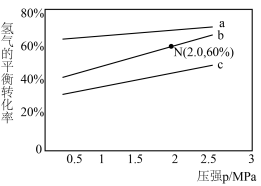
①比较a、b、c各曲线所表示的投料比大小顺序为
②计算540K的压强平衡常数

③540K条件下,某容器测得某时刻
 ,
,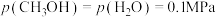 ,
, ,此时
,此时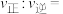
(1)与H2-O2燃料电池相比,氨易液化、运输和储存方便,安全性能更高。新型NH3-O2燃科电池原理如下图所示:OH-离子向

(2)氨的合成是当前的研究热点,目前最主要的方法是Haber-Bosch法:通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
①该反应放热,但仍选择较高温度。其原因是
②列举一条既能提高速率又能提高原料转化率的措施
(3)常温常压下电解法合成氨的原理如下图所示:
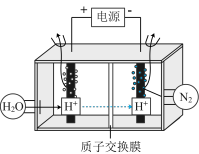
①阳极产生的气体是
②阴极生成氨的电极反应式为
③经检测在阴极表面发生了副反应,导致氨的产量降低。出该反应的电极反应式
④为了尽可能避免副反应的发生,采用的方法是改进阴极表面的催化剂,这样设计是利用了催化剂具有
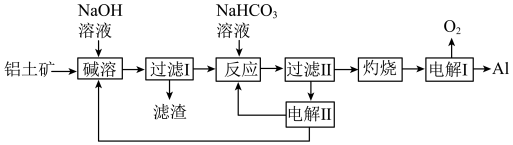
已知:SiO2在“碱溶”时转化为铝硅酸钠沉淀,过滤所得滤液中溶质的主要成分为Na[Al(OH)4]。
(1)基态Al原子的L层电子排布图为
(2)基态Fe原子的核外电子排布式为
(3)C、Na、O、Cu的第一电离能由大到小的顺序为
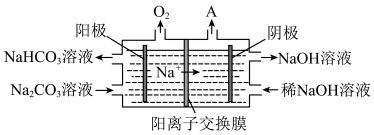
(4)“电解I”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是
(5)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为
| A | B | D | |||||||||||||||
| E | F | G | |||||||||||||||
| W | Q |
(2)
 中心原子杂化轨道类型:
中心原子杂化轨道类型: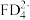 的
的 模型名称:
模型名称:(3)E、F、G三元素第一电离能从大到小的顺序是
(4)化合物AD与
 溶液反应的离子方程式为
溶液反应的离子方程式为(5)有机物甲由B、氢、D三种元素的原子按个数比为
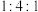 组成,可通过电解法由
组成,可通过电解法由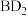 制取,用稀硫酸作电解质溶液,写出生成有机物甲的电极反应式:
制取,用稀硫酸作电解质溶液,写出生成有机物甲的电极反应式:


