名校
解题方法
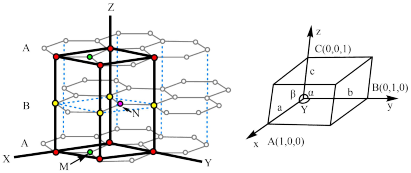
1 . 石墨和金刚石均属于碳的同素异形体,物理性质相差很大,归根结底是晶体结构不同造成的。已知石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如下图所示,图中用虚线标出了石墨的一个六方晶胞。___________ 。
(2)已知石墨的层间距为334.8 pm,C-C键长为142 pm,计算石墨晶体的密度为___________ (单位:g·cm-3)。
(3)石墨可用作锂离子电池的负极材料,充电时发生下述反应:Li1-xC6+x Li++x e-→ LiC6 其结果是,Li+嵌入石墨的A、B层间,导致石墨的层堆积方式发生改变,形成化学式为LiC6的嵌入化合物。
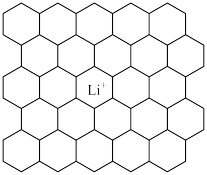
Ⅰ.下图给出了一个Li+沿C轴投影在A层上的位置,试在下图上标出与该离子临近的其他6个Li+的投影位置___________ 。
Ⅱ.在LiC6中,Li+与相邻石墨六元环的作用力属于何种键型___________ ?
Ⅲ.某石墨嵌入化合物每个六元环都对应一个Li+,写出它的化学式___________ 。
(2)已知石墨的层间距为334.8 pm,C-C键长为142 pm,计算石墨晶体的密度为
(3)石墨可用作锂离子电池的负极材料,充电时发生下述反应:Li1-xC6+x Li++x e-→ LiC6 其结果是,Li+嵌入石墨的A、B层间,导致石墨的层堆积方式发生改变,形成化学式为LiC6的嵌入化合物。
Ⅰ.下图给出了一个Li+沿C轴投影在A层上的位置,试在下图上标出与该离子临近的其他6个Li+的投影位置
Ⅱ.在LiC6中,Li+与相邻石墨六元环的作用力属于何种键型
Ⅲ.某石墨嵌入化合物每个六元环都对应一个Li+,写出它的化学式
您最近半年使用:0次
名校
解题方法
2 . 氟元素可形成多种有工业价值和科研价值的化合物,如 、
、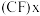 、
、 、HF、
、HF、 、
、 等。
等。
(1) 通入稀NaOH溶液中可生成
通入稀NaOH溶液中可生成 ,
, 分子的构型为
分子的构型为_______ 。
(2) 的熔点为1090℃,远高于
的熔点为1090℃,远高于 的熔点(192℃),,其原因是
的熔点(192℃),,其原因是_______ 。
(3)石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如图a所示,图中用虚线标出了石墨的一个六方晶胞。若按ABCABC方式堆积而成,则如图b所示,图中用虚线标出了石墨的一个三方晶胞。石墨与 在450℃反应,石墨层间插入F得到层状结构化合物
在450℃反应,石墨层间插入F得到层状结构化合物 ,该物质仍具有润滑性,其单层局部结构如图c所示。回答下列问题:
,该物质仍具有润滑性,其单层局部结构如图c所示。回答下列问题:
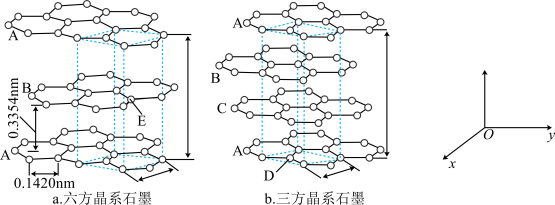
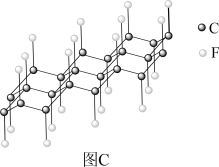
①E原子的分数坐标为_______ (以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标)。
②与石墨相比, 的导电性
的导电性_______ (填“增强”或“减弱”), 中C—C键的键长比石墨中C—C键的
中C—C键的键长比石墨中C—C键的_______ (填“长”或“短”)。
③1个三方石墨晶胞中碳原子的个数为_______ 。
④阿伏加德罗常数的值为NA,六方石墨晶体的密度为_____  (写出计算表达式,要求化简)。
(写出计算表达式,要求化简)。
 、
、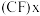 、
、 、HF、
、HF、 、
、 等。
等。(1)
 通入稀NaOH溶液中可生成
通入稀NaOH溶液中可生成 ,
, 分子的构型为
分子的构型为(2)
 的熔点为1090℃,远高于
的熔点为1090℃,远高于 的熔点(192℃),,其原因是
的熔点(192℃),,其原因是(3)石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如图a所示,图中用虚线标出了石墨的一个六方晶胞。若按ABCABC方式堆积而成,则如图b所示,图中用虚线标出了石墨的一个三方晶胞。石墨与
 在450℃反应,石墨层间插入F得到层状结构化合物
在450℃反应,石墨层间插入F得到层状结构化合物 ,该物质仍具有润滑性,其单层局部结构如图c所示。回答下列问题:
,该物质仍具有润滑性,其单层局部结构如图c所示。回答下列问题:

①E原子的分数坐标为
②与石墨相比,
 的导电性
的导电性 中C—C键的键长比石墨中C—C键的
中C—C键的键长比石墨中C—C键的③1个三方石墨晶胞中碳原子的个数为
④阿伏加德罗常数的值为NA,六方石墨晶体的密度为
 (写出计算表达式,要求化简)。
(写出计算表达式,要求化简)。
您最近半年使用:0次
名校
解题方法
3 . X、Y、Q、Z、W、M、N是原子序数依次增大的前四周期元素,X的核外电子总数与其电子层数相同;Z和M同主族,W的原子序数为Y原子价电子数的3倍;基态N原子d轨道中成对电子与单电子的数目比为4:3.由上述元素中的四种组成的两种化合物常用于合成阻燃材料,其结构简式如图所示。回答下列问题:

(1)W中电子占据最高能级的电子云轮廓图为_______ 形,基态W原子中自旋方向相反的两类电子数目相差_______ ,第三周期中第一电离能介于镁与磷元素之间的元素有_______ 种。
(2)Q原子价电子层上的电子可以进行重排以便提供一个空轨道与Y原子形成配位键,该原子重排后的价电子排布图为_______ ,电子重排后的原子能量有所升高,原因是不符合_______ (填“泡利原理”或“洪特规则”)。
(3)W、M形成的一种化合物以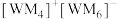 的形式存在,其中
的形式存在,其中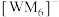 的空间结构为
的空间结构为_______ ;下列对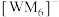 中心原子杂化方式推断合理的是
中心原子杂化方式推断合理的是_______ (填标号)。
a.sp2 b.sp3 c.sp3d d.sp3d2
(4)YX3和YZ3均为三角锥形,YZ3不易与Cu2+形成配离子,解释原因_______ 。
(5)N2+能形成配离子为八面体的配合物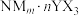 ,在该配合物中,N2+位于八面体的中心。若含0.5mol该配合物的溶液与足量AgNO3溶液反应可生成71.75g白色沉淀,则该配合物的化学式为
,在该配合物中,N2+位于八面体的中心。若含0.5mol该配合物的溶液与足量AgNO3溶液反应可生成71.75g白色沉淀,则该配合物的化学式为_______ 。
(6)磷化硼晶体的晶胞如图所示。
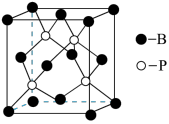
①在BP晶胞中键角为_______ 。
②磷化硼(BP)晶体中“一般共价键”与配位键的数目之比为_______ 。
③上述晶胞沿体对角线方向的投影图为_______ (填标号)。
A. B.
B.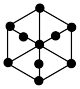 C.
C.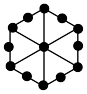 D.
D.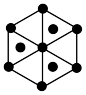

(1)W中电子占据最高能级的电子云轮廓图为
(2)Q原子价电子层上的电子可以进行重排以便提供一个空轨道与Y原子形成配位键,该原子重排后的价电子排布图为
(3)W、M形成的一种化合物以
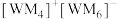 的形式存在,其中
的形式存在,其中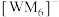 的空间结构为
的空间结构为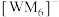 中心原子杂化方式推断合理的是
中心原子杂化方式推断合理的是a.sp2 b.sp3 c.sp3d d.sp3d2
(4)YX3和YZ3均为三角锥形,YZ3不易与Cu2+形成配离子,解释原因
(5)N2+能形成配离子为八面体的配合物
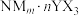 ,在该配合物中,N2+位于八面体的中心。若含0.5mol该配合物的溶液与足量AgNO3溶液反应可生成71.75g白色沉淀,则该配合物的化学式为
,在该配合物中,N2+位于八面体的中心。若含0.5mol该配合物的溶液与足量AgNO3溶液反应可生成71.75g白色沉淀,则该配合物的化学式为(6)磷化硼晶体的晶胞如图所示。

①在BP晶胞中键角为
②磷化硼(BP)晶体中“一般共价键”与配位键的数目之比为
③上述晶胞沿体对角线方向的投影图为
A.
 B.
B. C.
C. D.
D.
您最近半年使用:0次
名校
4 . Ⅰ.碳酸锰( )作为一种重要的化工原料,主要用于制备软磁铁氧体、锰硅合金等。科研人员利用含锰废水(主要含
)作为一种重要的化工原料,主要用于制备软磁铁氧体、锰硅合金等。科研人员利用含锰废水(主要含 ,以及少量
,以及少量 、
、 、
、 、
、 等)制备
等)制备 ,设计流程图如下:
,设计流程图如下: 如表:
如表:
(1)从氧化还原反应角度,分析选用 的优点
的优点___________ 、___________ 。
(2)除杂1时调节溶液 为5.2,则滤渣1的成分为
为5.2,则滤渣1的成分为 、
、___________ 。若两步即可从滤渣1中回收得到铁红,则所需试剂为___________ 。
A. 溶液 B.氨水 C.稀盐酸 D.二氧化碳
溶液 B.氨水 C.稀盐酸 D.二氧化碳
(3)已知硫化物的溶度积: 、
、 、
、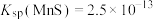 。在除杂2中,当滴加
。在除杂2中,当滴加 溶液时,最先沉淀的是
溶液时,最先沉淀的是___________ 。当 恰好沉淀完全时(
恰好沉淀完全时( 浓度以
浓度以 计),此时溶液中
计),此时溶液中 的浓度为
的浓度为___________  。
。
(4)将 受热分解,其固体产物的晶胞(立方体结构)如图所示。则该固体产物的化学式为
受热分解,其固体产物的晶胞(立方体结构)如图所示。则该固体产物的化学式为___________ 。
(5)经测定,该晶胞中最近两个 的距离为xcm。则该固体产物的密度为
的距离为xcm。则该固体产物的密度为___________  。(设
。(设 为阿伏加德罗常数,用含x和
为阿伏加德罗常数,用含x和 的代数式表示)
的代数式表示) 某碳酸锰样品,依次加入少量水、
某碳酸锰样品,依次加入少量水、 磷酸、
磷酸、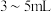 硝酸,通入
硝酸,通入 作保护气,将体系加热至
作保护气,将体系加热至 ,再加入
,再加入 硝酸铵。待冷却过程中加
硝酸铵。待冷却过程中加 水溶解。接着加入
水溶解。接着加入 滴
滴 苯代邻氨基苯甲酸指示剂,立即用
苯代邻氨基苯甲酸指示剂,立即用 标准溶液滴定,终点时消耗
标准溶液滴定,终点时消耗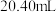 。主要反应原理如下:
。主要反应原理如下: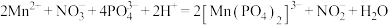 、
、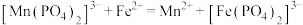
(6) 溶液显
溶液显___________ (选填“酸性”或“碱性”)。理由是___________ 。
(7)N-苯代邻氨基苯甲酸及其酸根与 形成的配合物
形成的配合物 ,如下图所示。
,如下图所示。 中
中 的配位数为
的配位数为___________ 。上述滴定终点的现象为___________ 。
(8)计算上述样品中锰元素的质量分数________ 。(请写出计算过程)。
 )作为一种重要的化工原料,主要用于制备软磁铁氧体、锰硅合金等。科研人员利用含锰废水(主要含
)作为一种重要的化工原料,主要用于制备软磁铁氧体、锰硅合金等。科研人员利用含锰废水(主要含 ,以及少量
,以及少量 、
、 、
、 、
、 等)制备
等)制备 ,设计流程图如下:
,设计流程图如下: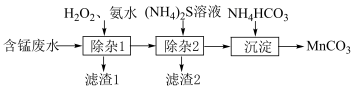
 如表:
如表:| 沉淀物 |  |  |  |  |  |
沉淀完全时的 | 3.7 | 5.2 | 6.4 | 9.2 | 9.8 |
 的优点
的优点(2)除杂1时调节溶液
 为5.2,则滤渣1的成分为
为5.2,则滤渣1的成分为 、
、A.
 溶液 B.氨水 C.稀盐酸 D.二氧化碳
溶液 B.氨水 C.稀盐酸 D.二氧化碳(3)已知硫化物的溶度积:
 、
、 、
、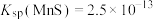 。在除杂2中,当滴加
。在除杂2中,当滴加 溶液时,最先沉淀的是
溶液时,最先沉淀的是 恰好沉淀完全时(
恰好沉淀完全时( 浓度以
浓度以 计),此时溶液中
计),此时溶液中 的浓度为
的浓度为 。
。(4)将
 受热分解,其固体产物的晶胞(立方体结构)如图所示。则该固体产物的化学式为
受热分解,其固体产物的晶胞(立方体结构)如图所示。则该固体产物的化学式为(5)经测定,该晶胞中最近两个
 的距离为xcm。则该固体产物的密度为
的距离为xcm。则该固体产物的密度为 。(设
。(设 为阿伏加德罗常数,用含x和
为阿伏加德罗常数,用含x和 的代数式表示)
的代数式表示)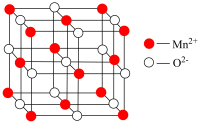
 某碳酸锰样品,依次加入少量水、
某碳酸锰样品,依次加入少量水、 磷酸、
磷酸、 硝酸,通入
硝酸,通入 作保护气,将体系加热至
作保护气,将体系加热至 ,再加入
,再加入 硝酸铵。待冷却过程中加
硝酸铵。待冷却过程中加 水溶解。接着加入
水溶解。接着加入 滴
滴 苯代邻氨基苯甲酸指示剂,立即用
苯代邻氨基苯甲酸指示剂,立即用 标准溶液滴定,终点时消耗
标准溶液滴定,终点时消耗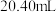 。主要反应原理如下:
。主要反应原理如下: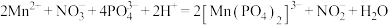 、
、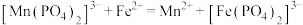
(6)
 溶液显
溶液显(7)N-苯代邻氨基苯甲酸及其酸根与
 形成的配合物
形成的配合物 ,如下图所示。
,如下图所示。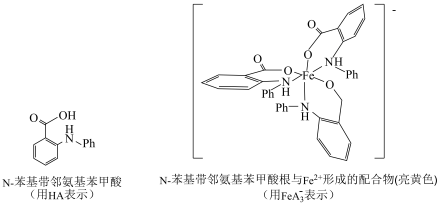
 中
中 的配位数为
的配位数为(8)计算上述样品中锰元素的质量分数
您最近半年使用:0次
名校
解题方法
5 .  及其化合物在生产和生活中用途广泛,回答下列问题。
及其化合物在生产和生活中用途广泛,回答下列问题。
(1) 的基态原子共有
的基态原子共有_____________ 种不同能级的电子。
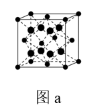
(2) 为只含有离子键的离子化合物,其晶胞结构如图a,距一个
为只含有离子键的离子化合物,其晶胞结构如图a,距一个 最近的所有
最近的所有 为顶点构成的几何形状为
为顶点构成的几何形状为_____________ 。
(3)二茂铁是最重要的金属茂基配合物,结构为一个铁原子处在两个平行的环戊二烯基环之间,结构如图b所示,已知二茂铁的一氯代物只有一种。

①二茂铁的分子式为_____________ 。
②穆斯堡尔谱学数据显示,二茂铁中学铁原子的氧化态为+2,每个茂环带有一个单位负电荷,因此每个环含有_____________ 个 电子。
电子。
(4)一种铁基超导材料( ,相对分子质量为
,相对分子质量为 )晶胞如图c所示,图d为铁原子沿轴方向的投影图。
)晶胞如图c所示,图d为铁原子沿轴方向的投影图。
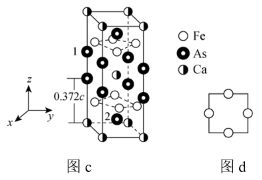
① 与
与 位于同一周期、且最外层电子数相等,但
位于同一周期、且最外层电子数相等,但 的熔点、沸点均比
的熔点、沸点均比 高,原因是
高,原因是_____________ 。
② 分子与
分子与 形成配合物后
形成配合物后 键角
键角_____________ (填“变大”“变小”或“不变”)。
③ 、
、 、
、 电负性由大到小的顺序为
电负性由大到小的顺序为_____________ 。
④ 的沸点(319℃,易升华)高于
的沸点(319℃,易升华)高于 的沸点(130.2℃),原因是
的沸点(130.2℃),原因是_____________ 。
⑤已知处于体心与顶点的 原子有着相同的化学环境,晶胞中
原子有着相同的化学环境,晶胞中 原子1的原子坐标为(0,0,0.628),则
原子1的原子坐标为(0,0,0.628),则 原子2的原子坐标为
原子2的原子坐标为_____________ 。
 及其化合物在生产和生活中用途广泛,回答下列问题。
及其化合物在生产和生活中用途广泛,回答下列问题。(1)
 的基态原子共有
的基态原子共有(2)
 为只含有离子键的离子化合物,其晶胞结构如图a,距一个
为只含有离子键的离子化合物,其晶胞结构如图a,距一个 最近的所有
最近的所有 为顶点构成的几何形状为
为顶点构成的几何形状为
(3)二茂铁是最重要的金属茂基配合物,结构为一个铁原子处在两个平行的环戊二烯基环之间,结构如图b所示,已知二茂铁的一氯代物只有一种。

①二茂铁的分子式为
②穆斯堡尔谱学数据显示,二茂铁中学铁原子的氧化态为+2,每个茂环带有一个单位负电荷,因此每个环含有
 电子。
电子。(4)一种铁基超导材料(
 ,相对分子质量为
,相对分子质量为 )晶胞如图c所示,图d为铁原子沿轴方向的投影图。
)晶胞如图c所示,图d为铁原子沿轴方向的投影图。
①
 与
与 位于同一周期、且最外层电子数相等,但
位于同一周期、且最外层电子数相等,但 的熔点、沸点均比
的熔点、沸点均比 高,原因是
高,原因是②
 分子与
分子与 形成配合物后
形成配合物后 键角
键角③
 、
、 、
、 电负性由大到小的顺序为
电负性由大到小的顺序为④
 的沸点(319℃,易升华)高于
的沸点(319℃,易升华)高于 的沸点(130.2℃),原因是
的沸点(130.2℃),原因是⑤已知处于体心与顶点的
 原子有着相同的化学环境,晶胞中
原子有着相同的化学环境,晶胞中 原子1的原子坐标为(0,0,0.628),则
原子1的原子坐标为(0,0,0.628),则 原子2的原子坐标为
原子2的原子坐标为
您最近半年使用:0次
名校
解题方法
6 . 钴(27Co)元素容易形成配合物,其常见+2、+3价。
(1)已知配合物的磁矩μB= BM(n表示中心原子或离子的未成对电子数)。某含钴配离子结构如图所示[所带电荷数目及符号未标出,NH2CH2CH2NH2为电中性配体],若测得其μB≈
BM(n表示中心原子或离子的未成对电子数)。某含钴配离子结构如图所示[所带电荷数目及符号未标出,NH2CH2CH2NH2为电中性配体],若测得其μB≈ BM,则该离子所带电荷数目及符号为
BM,则该离子所带电荷数目及符号为 ___________ 。
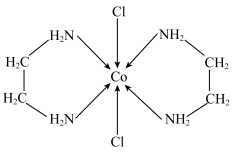
(2)中子衍射实验证实,晶体[Co(NH2CH2CH2NH2)2Cl2]Cl·HCl·2H2O中仅存在3种离子(不存在分子):Cl﹣、X+和上述含钴配离子。该晶体中存在的化学键类型有___________ ;含钴配离子中提供孤电子对的原子是 ___________ ,配位数是 ___________ ;X+是 ___________ (填离子符号)。
(3)乙二胺(NH2CH2CH2NH2)与正丁烷(CH3CH2CH2CH3)的相对分子质量相近,乙二胺沸点比正丁烷高的原因是___________ 。
(4)筑波材料科学国家实验室一个科研小组发现了在5K下呈现超导性的晶体CoO2,该晶体具有层状结构(如图所示,小球表示Co原子,大球表示O原子)。图中用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是___________ (填字母)。
a.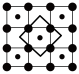 b.
b. 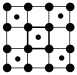 c.
c. 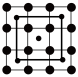 d.
d. 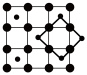
(5)用KCN处理含Co2+的盐溶液,有红色的Co(CN)2析出,将它溶于过量的KCN溶液后,可生成紫色的[Co(CN)6]4-,该配离子具有强还原性,在加热时能与水反应生成淡黄色[Co(CN)6]3-,写出[Co(CN)6]4-转变成[Co(CN)6]3-反应的离子方程式:___________ (提示:该反应在碱性条件下进行)
(1)已知配合物的磁矩μB=
 BM(n表示中心原子或离子的未成对电子数)。某含钴配离子结构如图所示[所带电荷数目及符号未标出,NH2CH2CH2NH2为电中性配体],若测得其μB≈
BM(n表示中心原子或离子的未成对电子数)。某含钴配离子结构如图所示[所带电荷数目及符号未标出,NH2CH2CH2NH2为电中性配体],若测得其μB≈ BM,则该离子所带电荷数目及符号为
BM,则该离子所带电荷数目及符号为 
(2)中子衍射实验证实,晶体[Co(NH2CH2CH2NH2)2Cl2]Cl·HCl·2H2O中仅存在3种离子(不存在分子):Cl﹣、X+和上述含钴配离子。该晶体中存在的化学键类型有
(3)乙二胺(NH2CH2CH2NH2)与正丁烷(CH3CH2CH2CH3)的相对分子质量相近,乙二胺沸点比正丁烷高的原因是
(4)筑波材料科学国家实验室一个科研小组发现了在5K下呈现超导性的晶体CoO2,该晶体具有层状结构(如图所示,小球表示Co原子,大球表示O原子)。图中用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是
a.
 b.
b.  c.
c.  d.
d. 
(5)用KCN处理含Co2+的盐溶液,有红色的Co(CN)2析出,将它溶于过量的KCN溶液后,可生成紫色的[Co(CN)6]4-,该配离子具有强还原性,在加热时能与水反应生成淡黄色[Co(CN)6]3-,写出[Co(CN)6]4-转变成[Co(CN)6]3-反应的离子方程式:
您最近半年使用:0次
名校
解题方法
7 . 铁元素单质及其化合物应用广泛,回答下列问题:
(1)纳米铁粉与高温水蒸气反应的化学方程式为__________ 。
(2)血红素是血红蛋白的组成部分,结构如图所示。__________ 官能团形成血红蛋白(填名称)
②血红素中N的杂化方式为__________ ;
③CO、 与血红蛋白形成配位键更牢固的是
与血红蛋白形成配位键更牢固的是__________ 。
(3) 射线衍射得知四氧化三铁是反式尖晶石结构,可表示为
射线衍射得知四氧化三铁是反式尖晶石结构,可表示为 ,具有铁磁性和导电性。关于四氧化三铁导电性的解释正确的是
,具有铁磁性和导电性。关于四氧化三铁导电性的解释正确的是__________ 。
a.四氧化三铁是金属晶体,Fe原子失去价电子形成遍布整块晶体、自由移动的“电子气”
b.四氧化三铁是分子晶体,两种FeO和 分子能自由移动
分子能自由移动
c. 、
、 在八面体位置上呈无序排列的,电子可在铁的两种氧化态间迅速发生转移
在八面体位置上呈无序排列的,电子可在铁的两种氧化态间迅速发生转移
(4)如图所示, 晶体中,
晶体中, 采取立方最密堆积,围成正四面体空隙(如1、3、6、7等)和正八面体空隙。
采取立方最密堆积,围成正四面体空隙(如1、3、6、7等)和正八面体空隙。 中有一半的
中有一半的 填充在正四而体空隙中,
填充在正四而体空隙中, 和另一半
和另一半 填充在正八面体空隙中。有
填充在正八面体空隙中。有__________ %的正八面体空隙没有填充阳离子。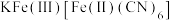 ](其摩尔质量为
](其摩尔质量为 )晶胞的1/8如下[
)晶胞的1/8如下[ 未标出,占据四个互不相邻的小立方体(晶胞的1/8部分)的体心】。若该晶体的密度为
未标出,占据四个互不相邻的小立方体(晶胞的1/8部分)的体心】。若该晶体的密度为 ,则
,则 和
和 的最短距离为
的最短距离为__________ cm( 为阿伏伽德罗常数的值,写表达式)。
为阿伏伽德罗常数的值,写表达式)。
(1)纳米铁粉与高温水蒸气反应的化学方程式为
(2)血红素是血红蛋白的组成部分,结构如图所示。
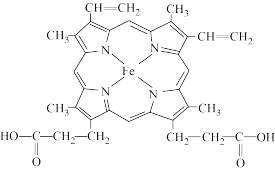
②血红素中N的杂化方式为
③CO、
 与血红蛋白形成配位键更牢固的是
与血红蛋白形成配位键更牢固的是(3)
 射线衍射得知四氧化三铁是反式尖晶石结构,可表示为
射线衍射得知四氧化三铁是反式尖晶石结构,可表示为 ,具有铁磁性和导电性。关于四氧化三铁导电性的解释正确的是
,具有铁磁性和导电性。关于四氧化三铁导电性的解释正确的是a.四氧化三铁是金属晶体,Fe原子失去价电子形成遍布整块晶体、自由移动的“电子气”
b.四氧化三铁是分子晶体,两种FeO和
 分子能自由移动
分子能自由移动c.
 、
、 在八面体位置上呈无序排列的,电子可在铁的两种氧化态间迅速发生转移
在八面体位置上呈无序排列的,电子可在铁的两种氧化态间迅速发生转移(4)如图所示,
 晶体中,
晶体中, 采取立方最密堆积,围成正四面体空隙(如1、3、6、7等)和正八面体空隙。
采取立方最密堆积,围成正四面体空隙(如1、3、6、7等)和正八面体空隙。 中有一半的
中有一半的 填充在正四而体空隙中,
填充在正四而体空隙中, 和另一半
和另一半 填充在正八面体空隙中。有
填充在正八面体空隙中。有
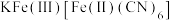 ](其摩尔质量为
](其摩尔质量为 )晶胞的1/8如下[
)晶胞的1/8如下[ 未标出,占据四个互不相邻的小立方体(晶胞的1/8部分)的体心】。若该晶体的密度为
未标出,占据四个互不相邻的小立方体(晶胞的1/8部分)的体心】。若该晶体的密度为 ,则
,则 和
和 的最短距离为
的最短距离为 为阿伏伽德罗常数的值,写表达式)。
为阿伏伽德罗常数的值,写表达式)。
您最近半年使用:0次
解题方法
8 . 配合物在许多尖端领域如超导材料、催化剂研制、自组装超分子等方面有广泛的应用。回答下列问题:
(1)某配合物的阳离子[Cu(NH3)4(H2O) 2]2+结构如图所示,铜离子的配位数为_____ ,其中与铜离子形成配位键更强的配体是_____ (填化学式)。

(2)《诗经》“缟衣茹藘(茜草)”,茜草中的茜素与矾土中的Al3+,Ca2+生成的红色配合物X是最早的媒染染料之一。
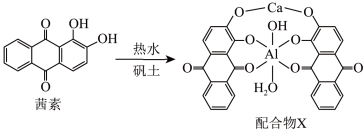
基态Al原子中自旋状态相反的两种电子的个数比为_____ ,配合物X中Al3+的配体除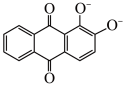 外还有
外还有_____ ,Al3+杂化轨道的空间构型为_____ ;茜素的熔点比1-羟基蒽醌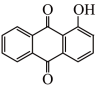
_____ (填“高”或“低”)。
(3)向FeSO4溶液中滴加K3[Fe(CN)6]溶液后,经提纯、结晶可得到KFe[Fe(CN)6]蓝色晶体,实验表明,CN-、Fe2+、Fe3+通过配位键构成了晶体骨架,其局部结构如图1,记为Ⅰ型立方结构。将Ⅰ型立方结构平移、旋转、并置,可得到晶体的复晶胞如图2,记为Ⅱ型立方结构(注:下层左后的小立方体g未标出)。

K+填充在Ⅰ型立方结构的体心,则在图1结构中K+的填充率为_____ ;图2晶胞中,Fe(不区分Fe2+,Fe3+)有_____ 种原子分数坐标;若KFe[Fe(CN)6]的摩尔质量为Mg·mol-1,阿伏加德罗常数的值用NA表示,Ⅱ型立方结构的边长为anm,该蓝色晶体密度为_____ g·cm-3。
(1)某配合物的阳离子[Cu(NH3)4(H2O) 2]2+结构如图所示,铜离子的配位数为

(2)《诗经》“缟衣茹藘(茜草)”,茜草中的茜素与矾土中的Al3+,Ca2+生成的红色配合物X是最早的媒染染料之一。

基态Al原子中自旋状态相反的两种电子的个数比为
 外还有
外还有
(3)向FeSO4溶液中滴加K3[Fe(CN)6]溶液后,经提纯、结晶可得到KFe[Fe(CN)6]蓝色晶体,实验表明,CN-、Fe2+、Fe3+通过配位键构成了晶体骨架,其局部结构如图1,记为Ⅰ型立方结构。将Ⅰ型立方结构平移、旋转、并置,可得到晶体的复晶胞如图2,记为Ⅱ型立方结构(注:下层左后的小立方体g未标出)。

K+填充在Ⅰ型立方结构的体心,则在图1结构中K+的填充率为
您最近半年使用:0次
名校
解题方法
9 . 卤素元素比较活泼,能形成种类繁多的化合物,回答下列问题:
(1)F,Cl,Br,I形成简单氢化物的沸点由高到低的顺序为:____________________________ 。
(2)卤素可形成很多酸根离子,如 、
、 、
、 、
、 等,
等, 的空间结构为
的空间结构为______________ 。
(3)卤素元素之间还能形成很多卤素互化物,如 ,
, ,
,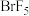 ,
,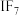 等,根据I与Cl原子的电负性大小关系写成
等,根据I与Cl原子的电负性大小关系写成 在水中水解的化学方程式:
在水中水解的化学方程式:_____________________ 。
(4)在石墨烯膜上可以制备Cl元素和Ca元素形成的新型的化合物,如图是俯视图和侧视图,俯视图中小六元环为石墨层,大六元环含3个大球(石墨六元环中心正上方)和3个小球(石墨层部分碳原子正上方),请写出该化合物的化学式______________ ,在石墨六元环中心正上方的元素为______________ 。(填元素符号)

(5)卤素还被称为成盐元素,某种卤素盐的晶体中含有Cl,Cs与Au三种元素,其最简式为 ,Au有两种化合价,其一个晶胞结构如图所示,未标出的两个小球为金(Au)离子,底面正方形边长为
,Au有两种化合价,其一个晶胞结构如图所示,未标出的两个小球为金(Au)离子,底面正方形边长为 ,高为
,高为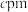 ,高分为两段,分别为
,高分为两段,分别为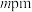 和
和 ,
, 的相对分子质量为M,回答下列问题:
的相对分子质量为M,回答下列问题:
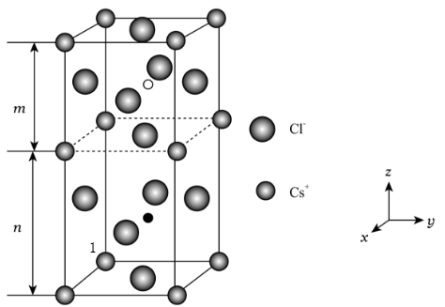
①如果 与
与 相等,
相等, 和
和 构成
构成______________ 晶胞。
②金(Au)离子和 的配位数分别为
的配位数分别为__________ 和__________ 。
③如图所示,以原子1为原点建立坐标系,写出晶胞内部小白球的分数坐标______ 。
(1)F,Cl,Br,I形成简单氢化物的沸点由高到低的顺序为:
(2)卤素可形成很多酸根离子,如
 、
、 、
、 、
、 等,
等, 的空间结构为
的空间结构为(3)卤素元素之间还能形成很多卤素互化物,如
 ,
, ,
,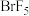 ,
,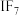 等,根据I与Cl原子的电负性大小关系写成
等,根据I与Cl原子的电负性大小关系写成 在水中水解的化学方程式:
在水中水解的化学方程式:(4)在石墨烯膜上可以制备Cl元素和Ca元素形成的新型的化合物,如图是俯视图和侧视图,俯视图中小六元环为石墨层,大六元环含3个大球(石墨六元环中心正上方)和3个小球(石墨层部分碳原子正上方),请写出该化合物的化学式

(5)卤素还被称为成盐元素,某种卤素盐的晶体中含有Cl,Cs与Au三种元素,其最简式为
 ,Au有两种化合价,其一个晶胞结构如图所示,未标出的两个小球为金(Au)离子,底面正方形边长为
,Au有两种化合价,其一个晶胞结构如图所示,未标出的两个小球为金(Au)离子,底面正方形边长为 ,高为
,高为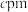 ,高分为两段,分别为
,高分为两段,分别为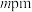 和
和 ,
, 的相对分子质量为M,回答下列问题:
的相对分子质量为M,回答下列问题:
①如果
 与
与 相等,
相等, 和
和 构成
构成②金(Au)离子和
 的配位数分别为
的配位数分别为③如图所示,以原子1为原点建立坐标系,写出晶胞内部小白球的分数坐标
您最近半年使用:0次
解题方法
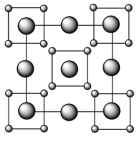
10 . 硅可以和多种金属形成组成各异、结构丰富的二元化合物。例如,在Ca-Si体系中,有Ca₅Si,Ca2Si,CaSi2,CaSi3等等。随着高压科学和技术的发展,总来越多的新物相新结构得以发现且呈现出有趣的成键特点。在20GPa条件下得到的二元Ca-Si化合物D属四方晶系,晶胞参数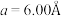 ,
,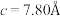 ,结构沿c方向的投影如图所示,虚线围出晶胞,浅色大球代表
,结构沿c方向的投影如图所示,虚线围出晶胞,浅色大球代表 ,深色小球代表硅原子,硅形成平面正方形的四聚硅簇,其中Si-Si键长为
,深色小球代表硅原子,硅形成平面正方形的四聚硅簇,其中Si-Si键长为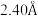 。Ca离子在用平面四方形排列形成垂直于c的层(同层离子即可给出图中投影)与四聚硅阴离子所形成的层沿c方向均衡交替排布,有一半Ca离子投影在平面正方形硅簇的中心位置。
。Ca离子在用平面四方形排列形成垂直于c的层(同层离子即可给出图中投影)与四聚硅阴离子所形成的层沿c方向均衡交替排布,有一半Ca离子投影在平面正方形硅簇的中心位置。
(1)写出化合物D晶体的点阵型式和结构基元___________ 。(提示:注意同号电荷相斥!)
(2)若将晶胞原点取在四聚硅簇平面正方形的中心,写出晶胞中所有原子的坐标参数_______ 。
(3)写出Si的氧化数并画出四聚硅阴离子的经典Lewis结构___________ 。
(4)化学物D不稳定,大气压下可发生分解。其产物之一便是CaSi2.CaSi2也有丰富的结构,其中一种结构中,硅通过三连接方式形成二维延伸,硅只有一种化学环境且所有硅原子的价层均满足八电子。画出该结构的示意图___________ 。(要求:示出结构特征,至少包含20个硅原子,并勾勒出二维晶胞)
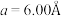 ,
,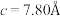 ,结构沿c方向的投影如图所示,虚线围出晶胞,浅色大球代表
,结构沿c方向的投影如图所示,虚线围出晶胞,浅色大球代表 ,深色小球代表硅原子,硅形成平面正方形的四聚硅簇,其中Si-Si键长为
,深色小球代表硅原子,硅形成平面正方形的四聚硅簇,其中Si-Si键长为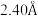 。Ca离子在用平面四方形排列形成垂直于c的层(同层离子即可给出图中投影)与四聚硅阴离子所形成的层沿c方向均衡交替排布,有一半Ca离子投影在平面正方形硅簇的中心位置。
。Ca离子在用平面四方形排列形成垂直于c的层(同层离子即可给出图中投影)与四聚硅阴离子所形成的层沿c方向均衡交替排布,有一半Ca离子投影在平面正方形硅簇的中心位置。
(1)写出化合物D晶体的点阵型式和结构基元
(2)若将晶胞原点取在四聚硅簇平面正方形的中心,写出晶胞中所有原子的坐标参数
(3)写出Si的氧化数并画出四聚硅阴离子的经典Lewis结构
(4)化学物D不稳定,大气压下可发生分解。其产物之一便是CaSi2.CaSi2也有丰富的结构,其中一种结构中,硅通过三连接方式形成二维延伸,硅只有一种化学环境且所有硅原子的价层均满足八电子。画出该结构的示意图
您最近半年使用:0次



