名校
解题方法
1 . 锗石是自然界中含有锗元素的一类矿石的统称,锗石含有人体所需的硒、锌、镍、钴、锰、镁、钙等30多种对人体有益的微量元素。回答下列问题:
(1)基态Ge原子核外简化电子排布式为_______ ,Ge原子的电子发生跃迁时会吸收或发出不同的光,可用光谱分析仪获得_______ 光谱(填“连续”或 “线状”),鉴定Ge元素的存在。
(2)锗与碳同族,性质和结构有一定的相似性,锗元素能形成无机化合物(如锗酸钠:Na2GeO3;二锗酸钠:Na2Ge2O5等),也能形成类似于烷烃的锗烷(GenH2n+2)。
①Na2GeO3中锗原子的杂化方式是_______ 。
②推测 1molGenH2n+2中含有的σ键的数目是_______ (用NA表示阿伏加德罗常数值)。
(3)利用离子液体[EMIM] [AlCl4]可电沉积还原金属Ge,其熔点只有7℃其中EMIM+ 结构如图所示。

①该物质的晶体类型是_______ 。
②EMIM+ 离子中组成元素的电负性由小到大的顺序是_______ 。
(4)独立的NH3分子中H-N-H 的键角为 107.3 º,[Zn(NH3)6]2+离子中H-N-H的键角_______ 107.3° ( 填“大于”、“小于”或“等于” )。
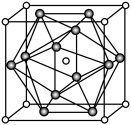
(5)硒化锌( ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,该晶胞中硒原子的配位数是_______ ;已知晶胞边长为a pm,乙图为甲图的俯视图,若原子坐标A为(0,0,0),B为( ,1,
,1, ) ,则 D原子坐标为
) ,则 D原子坐标为_______ ;若该晶胞密度为ρ g·cm-3,则阿伏加德罗常数NA为_______ 。

(1)基态Ge原子核外简化电子排布式为
(2)锗与碳同族,性质和结构有一定的相似性,锗元素能形成无机化合物(如锗酸钠:Na2GeO3;二锗酸钠:Na2Ge2O5等),也能形成类似于烷烃的锗烷(GenH2n+2)。
①Na2GeO3中锗原子的杂化方式是
②推测 1molGenH2n+2中含有的σ键的数目是
(3)利用离子液体[EMIM] [AlCl4]可电沉积还原金属Ge,其熔点只有7℃其中EMIM+ 结构如图所示。

①该物质的晶体类型是
②EMIM+ 离子中组成元素的电负性由小到大的顺序是
(4)独立的NH3分子中H-N-H 的键角为 107.3 º,[Zn(NH3)6]2+离子中H-N-H的键角
(5)硒化锌( ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,该晶胞中硒原子的配位数是
 ,1,
,1, ) ,则 D原子坐标为
) ,则 D原子坐标为
您最近半年使用:0次
名校
解题方法
2 . 铁在工业中有重要作用,也是人体必需的微量元素。
(1)Fe3+可以和Cl-、F-、CN-、SCN-等配体形成配合物。
①写出基态Fe3+的电子排布式_______ 。
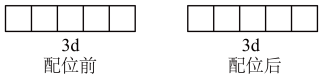
②向含Fe3+的溶液中加入NaCN将Fe3+转化成配位数为6的稳定配离子,该配离子的化学式为_______ ,配离子中Fe3+为d2sp3杂化,写出配位前后Fe3+3d轨道表示式_______ 。
(2)邻二氮菲的结构简式为 ,N原子与Fe2+通过配位键能形成稳定的橙红色的邻二氮菲亚铁离子,这种离子可表示为[Fe(phen)3]2+。该配合物的特征颜色常用于Fe2+检验和浓度的测定。
,N原子与Fe2+通过配位键能形成稳定的橙红色的邻二氮菲亚铁离子,这种离子可表示为[Fe(phen)3]2+。该配合物的特征颜色常用于Fe2+检验和浓度的测定。
①中心离子的配位数为_______ ,配位原子的杂化方式为_______ 。
②实验表明,邻二氮菲检验Fe2+的适宜pH范围是2~9,分析pH太小或太大不适合用邻二氮菲检验Fe2+的原因_______
(3)Fe3O4晶体是由图1所示的结构平移构成。图1包含I型和II型两种小立方体。图2是Fe3O4的晶胞。
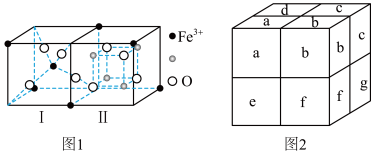
①Fe3O4晶胞中有_______ 个Fe离子, 代表
代表_______ 。
②Fe3O4晶胞的晶胞边长为a nm,Fe3O4的密度为_______ g/cm3。
(1)Fe3+可以和Cl-、F-、CN-、SCN-等配体形成配合物。
①写出基态Fe3+的电子排布式
②向含Fe3+的溶液中加入NaCN将Fe3+转化成配位数为6的稳定配离子,该配离子的化学式为

(2)邻二氮菲的结构简式为
 ,N原子与Fe2+通过配位键能形成稳定的橙红色的邻二氮菲亚铁离子,这种离子可表示为[Fe(phen)3]2+。该配合物的特征颜色常用于Fe2+检验和浓度的测定。
,N原子与Fe2+通过配位键能形成稳定的橙红色的邻二氮菲亚铁离子,这种离子可表示为[Fe(phen)3]2+。该配合物的特征颜色常用于Fe2+检验和浓度的测定。①中心离子的配位数为
②实验表明,邻二氮菲检验Fe2+的适宜pH范围是2~9,分析pH太小或太大不适合用邻二氮菲检验Fe2+的原因
(3)Fe3O4晶体是由图1所示的结构平移构成。图1包含I型和II型两种小立方体。图2是Fe3O4的晶胞。

①Fe3O4晶胞中有
 代表
代表②Fe3O4晶胞的晶胞边长为a nm,Fe3O4的密度为
您最近半年使用:0次
解题方法
3 . 现代科技的发展离不开材料的开发与应用,而物质结构理论是材料研究的基础,请回答Ⅰ-Ⅳ的问题。
Ⅰ.使用 作原科的电合成技术,为减少
作原科的电合成技术,为减少 排放提供了一条有吸引力的途径,并为实现碳中和奠定了坚实的基础。
排放提供了一条有吸引力的途径,并为实现碳中和奠定了坚实的基础。
(1) 和
和 中碳原子的杂化类型分别是
中碳原子的杂化类型分别是_______________ 和_______________ 。
(2)1个 分子中存在
分子中存在_______________ 个 键。
键。
(3) 易溶于水的原因是
易溶于水的原因是_____________________ 。
Ⅱ.硒( )与钾同周期、面与硫同主族,金()在周期表第六周期第ⅠB族。
)与钾同周期、面与硫同主族,金()在周期表第六周期第ⅠB族。
(4)在基态K原子中,能量最低的空轨道的符号是_____ , 原子的价电子排布式为
原子的价电子排布式为______ 。
(5) 的空间构型为
的空间构型为___________ ,写出一个与 互为等电子体的分子
互为等电子体的分子_____ (填分子式)。
(6)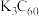 是一种超导材料,是由足球烯(
是一种超导材料,是由足球烯( )与金属钾反应生成的盐。在
)与金属钾反应生成的盐。在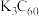 晶胞中,
晶胞中,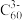 堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙,
堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙, 填充在空隙中。晶胞中被
填充在空隙中。晶胞中被 占据的空隙百分比为
占据的空隙百分比为_______________ 。

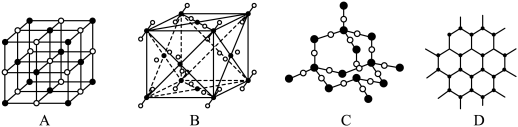
Ⅲ.咪唑、噻唑、吡啶是含N和S的有机杂环类化合物,结构如图所示:

(7)上述三种物质中,沸点最高的是_______________ (填化学名称)。
(8)已知咪唑中存在大 键,则在咪唑分子的两个氮原子中,更容易与
键,则在咪唑分子的两个氮原子中,更容易与 形成配位键的是
形成配位键的是_______________ (填“①”或“②”)号氮原子。
Ⅳ.“嫦娥五号”某核心部件主要成分为纳米钛铝合金,其结构单元如图所示( 、
、 原子各有一个原子在结构单元内部)。该结构单元底面(正六边形)边长为
原子各有一个原子在结构单元内部)。该结构单元底面(正六边形)边长为 ,该合金的密度为
,该合金的密度为 。
。
(9)列出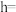
_____ cm的计算式,设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
Ⅰ.使用
 作原科的电合成技术,为减少
作原科的电合成技术,为减少 排放提供了一条有吸引力的途径,并为实现碳中和奠定了坚实的基础。
排放提供了一条有吸引力的途径,并为实现碳中和奠定了坚实的基础。(1)
 和
和 中碳原子的杂化类型分别是
中碳原子的杂化类型分别是(2)1个
 分子中存在
分子中存在 键。
键。(3)
 易溶于水的原因是
易溶于水的原因是Ⅱ.硒(
 )与钾同周期、面与硫同主族,金()在周期表第六周期第ⅠB族。
)与钾同周期、面与硫同主族,金()在周期表第六周期第ⅠB族。(4)在基态K原子中,能量最低的空轨道的符号是
 原子的价电子排布式为
原子的价电子排布式为(5)
 的空间构型为
的空间构型为 互为等电子体的分子
互为等电子体的分子(6)
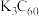 是一种超导材料,是由足球烯(
是一种超导材料,是由足球烯( )与金属钾反应生成的盐。在
)与金属钾反应生成的盐。在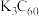 晶胞中,
晶胞中,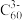 堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙,
堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙, 填充在空隙中。晶胞中被
填充在空隙中。晶胞中被 占据的空隙百分比为
占据的空隙百分比为
Ⅲ.咪唑、噻唑、吡啶是含N和S的有机杂环类化合物,结构如图所示:

(7)上述三种物质中,沸点最高的是
(8)已知咪唑中存在大
 键,则在咪唑分子的两个氮原子中,更容易与
键,则在咪唑分子的两个氮原子中,更容易与 形成配位键的是
形成配位键的是Ⅳ.“嫦娥五号”某核心部件主要成分为纳米钛铝合金,其结构单元如图所示(
 、
、 原子各有一个原子在结构单元内部)。该结构单元底面(正六边形)边长为
原子各有一个原子在结构单元内部)。该结构单元底面(正六边形)边长为 ,该合金的密度为
,该合金的密度为 。
。(9)列出
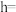
 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
您最近半年使用:0次
名校
解题方法
4 . 过渡元素用途广泛。回答下列问题:
(1)基态 的价电子排布式为
的价电子排布式为_______ 。
(2)Co与Ca位于同一周期、且最外层电子数相等,但Co的熔点、沸点均比Ca高,原因是_______ 。
(3) 1mol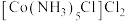 中含有的σ键数目为
中含有的σ键数目为_______ , 分子与
分子与 形成配合物后
形成配合物后 键角
键角_______ (填“变大”“变小”或“不变”)。
(4) 中配体
中配体 的空间结构为
的空间结构为_______ ,N、O原子相比,第二电离能与第一电离能差值更大的是_______ (填元素符号)。
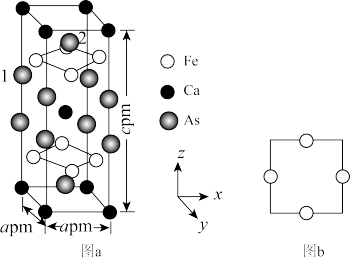
(5)一种铁基超导材料晶胞结构如图a所示,铁原子沿z轴方向的投影如图b所示。该材料的化学式为_______ ,已知体心与顶点的Ca原子有着相同的化学环境,晶胞中As原子1分数坐标为(0,0,0.628),则As原子2的分数坐标为_______ ,体心Ca原子与As原子1之间的距离为_______ pm。
(1)基态
 的价电子排布式为
的价电子排布式为(2)Co与Ca位于同一周期、且最外层电子数相等,但Co的熔点、沸点均比Ca高,原因是
(3) 1mol
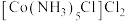 中含有的σ键数目为
中含有的σ键数目为 分子与
分子与 形成配合物后
形成配合物后 键角
键角(4)
 中配体
中配体 的空间结构为
的空间结构为(5)一种铁基超导材料晶胞结构如图a所示,铁原子沿z轴方向的投影如图b所示。该材料的化学式为

您最近半年使用:0次
2022-12-18更新
|
477次组卷
|
2卷引用:山东省淄博市2022-2023学年高三上学期12月月考化学试题
解题方法
5 . 稀有气体的性质与应用
稀有气体在大功率激光、特殊的光学玻璃等领域具有重大应用前景。Xe的氟化物中XeF2是最有前途的氟化剂,其与氟磺酸(FSO3H)反应产生游离基A(反应一),A双聚成含有非极性键的极性分子B;XeF2水溶液作为强氧化剂可以用来测定I-的含量,在弱酸性介质中氧化I-为IO (反应二);计算表明,Xe的电离能(12.13eV)比O2的电离能(12.2eV)更低,据此,研究者试图通过O2BF4与Xe反应来制备XeBF4,然而得到的白色固体C中氟含量为28.63%,低于目标产物中氟含量(反应三);XeOBF4同路易斯酸SbF5以1∶2反应生成离子化合物D(反应四)。
(反应二);计算表明,Xe的电离能(12.13eV)比O2的电离能(12.2eV)更低,据此,研究者试图通过O2BF4与Xe反应来制备XeBF4,然而得到的白色固体C中氟含量为28.63%,低于目标产物中氟含量(反应三);XeOBF4同路易斯酸SbF5以1∶2反应生成离子化合物D(反应四)。
(1)写出反应一、二、三的方程式_____ 、_____ 、_____ 。
(2)画出B的立体结构_____ 。
(3)画出C的立体结构,在结构中标出中心原子的杂化方式_____ 。
(4)画出D的立体结构_____ 。
稀有气体在大功率激光、特殊的光学玻璃等领域具有重大应用前景。Xe的氟化物中XeF2是最有前途的氟化剂,其与氟磺酸(FSO3H)反应产生游离基A(反应一),A双聚成含有非极性键的极性分子B;XeF2水溶液作为强氧化剂可以用来测定I-的含量,在弱酸性介质中氧化I-为IO
 (反应二);计算表明,Xe的电离能(12.13eV)比O2的电离能(12.2eV)更低,据此,研究者试图通过O2BF4与Xe反应来制备XeBF4,然而得到的白色固体C中氟含量为28.63%,低于目标产物中氟含量(反应三);XeOBF4同路易斯酸SbF5以1∶2反应生成离子化合物D(反应四)。
(反应二);计算表明,Xe的电离能(12.13eV)比O2的电离能(12.2eV)更低,据此,研究者试图通过O2BF4与Xe反应来制备XeBF4,然而得到的白色固体C中氟含量为28.63%,低于目标产物中氟含量(反应三);XeOBF4同路易斯酸SbF5以1∶2反应生成离子化合物D(反应四)。(1)写出反应一、二、三的方程式
(2)画出B的立体结构
(3)画出C的立体结构,在结构中标出中心原子的杂化方式
(4)画出D的立体结构
您最近半年使用:0次
2022高二上·安徽阜阳·竞赛
解题方法
6 . 在初中,我们曾经接触过这样一个模型:

我们称其为“洋葱模型”,因为这个原子模型看起来像一个洋葱,一层一层的……awa
每一层都被称作“能层”,而每个能层能够容纳的电子数都不一样:2,8,18,32……
但是,你是否有过这样的疑惑:
为什么每个能层能够容纳的电子的数目只能是那么多呢……?
这时,我们就要提到另外一个模型了:玻尔模型。
玻尔在提出的模型中规定:电子在一些特定的可能轨道上绕核做圆周运动,离核愈远能量愈高,这如同太阳系中的各大行星,围绕着太阳在不停的运动。
他以这个模型为基础,提出了构造原理,即从氢开始,随核电子数的增加,新增电子填入原子核外“壳层”的顺序,由此开启了用原子结构解释元素周期表的篇章。
我们之前学的“能层”,其前身就是玻尔所提出的“壳层”。
自此之后的5年,原本的“壳层”落实为了所谓的“能层”和“能级”。
在后人的不断努力下,到1936年,德国科学家马德隆以原子光谱事实为依据,最终提出了完整的构造原理。
构造原理是化学中的一种定理,决定了原子、分子和离子中电子在各能级的排布。随核电荷数递增,大多数元素的电中性基态原子的电子按顺序填入核外电子运动轨道,即为构造原理。
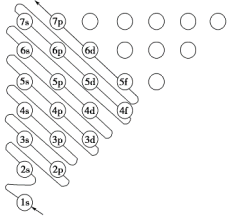
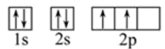
下图中,每个小圆圈表示一个能级。每一行对应一个能层,各圆圈连线的顺序表示随核电荷数递增而增加的电子填入能级的顺序;而另一张图(下)为碳原子的电子排布图:
一、已知以下有关电子排布的定义:
•电子排布式:是表示原子核外电子排布的图式之一、有七个电子层,分别用1、2、3、4、5、6、7等数字表示K、L、M、N、O、P、Q等电子层,用s、p、d、f等符号分别表示各电子亚层,并在这些符号右上角用数字表示各亚层上电子的数目。迄今为止,只发现了7个电子层。
•能量最低原理: 自然界一个普遍的规律是"能量越低越稳定"。原子中的电子也是如此。在不违反泡利原理、和洪特规则的条件下,电子优先占据能量较低的原子轨道,使整个原子体系能量处于最低,这样的状态是原子的基态。
•洪特规则:电子尽可能的占据不同轨道,自旋方向相同。
•泡利不相容原理:在一个能量最低的体系中,没有两个电子的四个量子数是完全相同的。
•能级交错:电子层数较大的某些轨道的能量反低于电子层数较小的某些轨道能量的现象。
•电子自旋:电子不仅在核外空间不停地运动,而且还作自旋运动。电子自旋有两种状态,相当于顺时针和逆时针两种方向。每个轨道最多容纳2个自旋方向相反的电子。同一轨道中的2个电子称成对电子,若一个轨道中只有1个电子,该电子被称为单电子。
•价层电子:指原子核外电子中能与其他原子相互作用形成化学键,跟元素化合价有关的电子,又称价电子。
•价层:就是显现化合价的电子层,通常指原子的最外层电子层。
•电负性:周期表中各元素的原子吸引电子能力的一种相对标度 。又称负电性。元素的电负性愈大,吸引电子的倾向愈大,非金属性也愈强。一般认为,电负性大于1.8的是非金属元素,小于1.8的是金属元素,在1.8左右的元素既有金属性又有非金属性。而一般构成元素的电负性差值在0.6~1.7左右的化合物都是共价化合物。
且已知原子中的每一个电子都具有一个不同的运动状态,Re原子共有14个能级,价层共有7个运动状态不同的电子:
(1)写出基态Re原子的价层电子排布图:_______ 。
(2)写出与Re同族的原子序数最小的+2价离子基态核外电子排布式:___ 。
(3)Re的电负性是1.9,Cl的电负性是3.0,ReCl3的熔点为723℃,沸点800~850℃,500℃真空升华。据此判断ReCl3是_______ (选填“共价”,“离子”)化合物。
(4)试推测N能层最多只能容纳32个电子的原因:_____ 。
二、解决了第一个问题之后,我们就成功的来到了第二个问题:
很多同学都知道,CO2和H2O明明都是3个原子,为什么CO2的空间结构是直线形,而H2O的空间结构却是V形呢?
对于下面的问题,这里我们要介绍3个知识点:价层电子对互斥模型、杂化轨道理论和大π键。
价层电子对互斥模型,又称VSEPR模型,是将共用电子对与孤对电子的概念,与原子轨道的概念相结合,且电子斥力达到最小。在这个模型中电子对相互排斥,成键电子与孤对电子距离越远越好。VSEPR模型以最简单的方法形象化了化学变化,也很容易判断物质的空间构型,并且去除孤电子对的VSEPR模型就是实际情况下的空间结构。
而孤电子对(英语:lone pair,或称孤对电子)是不与其他原子结合或共享的成对价电子。存在于原子的最外围电子壳层。 孤对电子在分子中的存在和分配影响分子的形状等,对轻原子组成的分子影响尤为显著。指分子中未成键的价电子对。
对于孤对电子,有以下计算公式: 值得注意的是,中心原子为多个相同原子时,该公式的计算结果为每一个原子上的孤对电子数,而不是中心原子孤对电子数的总和。
值得注意的是,中心原子为多个相同原子时,该公式的计算结果为每一个原子上的孤对电子数,而不是中心原子孤对电子数的总和。
(5)试计算H2O中孤电子对的对数:_______ 对。
杂化轨道理论:
杂化轨道理论是一种科学理论。在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫做杂化轨道。只有最外电子层中不同能级中的电子可以进行轨道杂化,且在第一层的两个电子不参与反应。不同能级中的电子在进行轨道杂化时,电子会从能量低的层跃迁到能量高的层,并且杂化以后的各电子轨道能量相等(等性杂化),同时又高于原来能量较低的能级的能量,低于原来能量较高的能级的能量。当然的,有几个原子轨道参加杂化,杂化后就生成几个杂化轨道。
那么,我们该如何计算杂化轨道的数量呢?
计算公式在这里哦(中心原子的轨道数):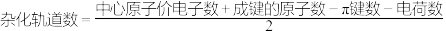
比如,PO 中P原子的杂化情况为
中P原子的杂化情况为 个轨道参与杂化,也就是sp3杂化。
个轨道参与杂化,也就是sp3杂化。
很多同学看到公式就有些懵了:π键数该如何计算呢?
这里我们要讲第三个知识点:大π键。
你可能觉得CO2分子中有两个C=O,但事实上,那真的是碳氧双键吗?
事实上,CO2中的那两个π键看成普通π键只是为了方便我们的理解,而那两个π键应该属于大π键,而他的孤对电子也因此被拿去。
我们先来看一下轨道的电子云模型(一种用来描述电子在原子核外空间某处出现机会(几率)的大小的模型,毕竟根据量子力学相关的定义,我们无法同时获得电子的位置和此时的时刻):
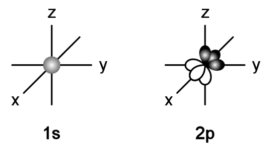
细心的同学可以发现,2p轨道其实是由3个相同结构构造成的,我们根据其朝向分别命名为2px、2py和2pz。
我们常见的π键,就是2p轨道的电子云通过侧面“肩碰肩”的方式形成的。
只是,大π键(离域π键)的形成和π键要求不同:
1. 一般情况下,所有参与形成离域π键的原子必须在同一直线或同一平面上。
2. 一般情况下,参与离域π键的原子都必须提供一个或两个互相平行的p轨道。
3. 一般情况下,形成离域π键的p电子的总数小于p轨道数的两倍。
大π键的常见表示方法: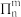 ,其中n为原子个数,m为共用电子个数,m≤2n。
,其中n为原子个数,m为共用电子个数,m≤2n。
那么,m的值应该如何计算呢?
计算公式如下: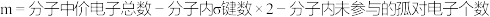
(6)试计算CO2分子中大π键的数量和对应的大π键表示:_______ 。
(7)写出CO2分子中C原子的杂化情况:_______ 。
到了这里,相信你已经能够解决题干刚开始给出的那个问题了:为什么CO2的空间结构是直线形,而H2O的空间结构却是V形呢?
已知电子对的数量和其对应的VSEPR模型如下表所示:
(8)写出N2O4一个中心原子的杂化情况和其对应的空间结构:_______ ;_______ 。

我们称其为“洋葱模型”,因为这个原子模型看起来像一个洋葱,一层一层的……awa
每一层都被称作“能层”,而每个能层能够容纳的电子数都不一样:2,8,18,32……
但是,你是否有过这样的疑惑:
为什么每个能层能够容纳的电子的数目只能是那么多呢……?
这时,我们就要提到另外一个模型了:玻尔模型。
玻尔在提出的模型中规定:电子在一些特定的可能轨道上绕核做圆周运动,离核愈远能量愈高,这如同太阳系中的各大行星,围绕着太阳在不停的运动。
他以这个模型为基础,提出了构造原理,即从氢开始,随核电子数的增加,新增电子填入原子核外“壳层”的顺序,由此开启了用原子结构解释元素周期表的篇章。
我们之前学的“能层”,其前身就是玻尔所提出的“壳层”。
自此之后的5年,原本的“壳层”落实为了所谓的“能层”和“能级”。
在后人的不断努力下,到1936年,德国科学家马德隆以原子光谱事实为依据,最终提出了完整的构造原理。
构造原理是化学中的一种定理,决定了原子、分子和离子中电子在各能级的排布。随核电荷数递增,大多数元素的电中性基态原子的电子按顺序填入核外电子运动轨道,即为构造原理。
下图中,每个小圆圈表示一个能级。每一行对应一个能层,各圆圈连线的顺序表示随核电荷数递增而增加的电子填入能级的顺序;而另一张图(下)为碳原子的电子排布图:

一、已知以下有关电子排布的定义:

•电子排布式:是表示原子核外电子排布的图式之一、有七个电子层,分别用1、2、3、4、5、6、7等数字表示K、L、M、N、O、P、Q等电子层,用s、p、d、f等符号分别表示各电子亚层,并在这些符号右上角用数字表示各亚层上电子的数目。迄今为止,只发现了7个电子层。
•能量最低原理: 自然界一个普遍的规律是"能量越低越稳定"。原子中的电子也是如此。在不违反泡利原理、和洪特规则的条件下,电子优先占据能量较低的原子轨道,使整个原子体系能量处于最低,这样的状态是原子的基态。
•洪特规则:电子尽可能的占据不同轨道,自旋方向相同。
•泡利不相容原理:在一个能量最低的体系中,没有两个电子的四个量子数是完全相同的。
•能级交错:电子层数较大的某些轨道的能量反低于电子层数较小的某些轨道能量的现象。
•电子自旋:电子不仅在核外空间不停地运动,而且还作自旋运动。电子自旋有两种状态,相当于顺时针和逆时针两种方向。每个轨道最多容纳2个自旋方向相反的电子。同一轨道中的2个电子称成对电子,若一个轨道中只有1个电子,该电子被称为单电子。
•价层电子:指原子核外电子中能与其他原子相互作用形成化学键,跟元素化合价有关的电子,又称价电子。
•价层:就是显现化合价的电子层,通常指原子的最外层电子层。
•电负性:周期表中各元素的原子吸引电子能力的一种相对标度 。又称负电性。元素的电负性愈大,吸引电子的倾向愈大,非金属性也愈强。一般认为,电负性大于1.8的是非金属元素,小于1.8的是金属元素,在1.8左右的元素既有金属性又有非金属性。而一般构成元素的电负性差值在0.6~1.7左右的化合物都是共价化合物。
且已知原子中的每一个电子都具有一个不同的运动状态,Re原子共有14个能级,价层共有7个运动状态不同的电子:
(1)写出基态Re原子的价层电子排布图:
(2)写出与Re同族的原子序数最小的+2价离子基态核外电子排布式:
(3)Re的电负性是1.9,Cl的电负性是3.0,ReCl3的熔点为723℃,沸点800~850℃,500℃真空升华。据此判断ReCl3是
(4)试推测N能层最多只能容纳32个电子的原因:
二、解决了第一个问题之后,我们就成功的来到了第二个问题:
很多同学都知道,CO2和H2O明明都是3个原子,为什么CO2的空间结构是直线形,而H2O的空间结构却是V形呢?
对于下面的问题,这里我们要介绍3个知识点:价层电子对互斥模型、杂化轨道理论和大π键。
价层电子对互斥模型,又称VSEPR模型,是将共用电子对与孤对电子的概念,与原子轨道的概念相结合,且电子斥力达到最小。在这个模型中电子对相互排斥,成键电子与孤对电子距离越远越好。VSEPR模型以最简单的方法形象化了化学变化,也很容易判断物质的空间构型,并且去除孤电子对的VSEPR模型就是实际情况下的空间结构。
而孤电子对(英语:lone pair,或称孤对电子)是不与其他原子结合或共享的成对价电子。存在于原子的最外围电子壳层。 孤对电子在分子中的存在和分配影响分子的形状等,对轻原子组成的分子影响尤为显著。指分子中未成键的价电子对。
对于孤对电子,有以下计算公式:
 值得注意的是,中心原子为多个相同原子时,该公式的计算结果为每一个原子上的孤对电子数,而不是中心原子孤对电子数的总和。
值得注意的是,中心原子为多个相同原子时,该公式的计算结果为每一个原子上的孤对电子数,而不是中心原子孤对电子数的总和。(5)试计算H2O中孤电子对的对数:
杂化轨道理论:
杂化轨道理论是一种科学理论。在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫做杂化轨道。只有最外电子层中不同能级中的电子可以进行轨道杂化,且在第一层的两个电子不参与反应。不同能级中的电子在进行轨道杂化时,电子会从能量低的层跃迁到能量高的层,并且杂化以后的各电子轨道能量相等(等性杂化),同时又高于原来能量较低的能级的能量,低于原来能量较高的能级的能量。当然的,有几个原子轨道参加杂化,杂化后就生成几个杂化轨道。
那么,我们该如何计算杂化轨道的数量呢?
计算公式在这里哦(中心原子的轨道数):
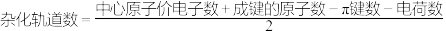
比如,PO
 中P原子的杂化情况为
中P原子的杂化情况为 个轨道参与杂化,也就是sp3杂化。
个轨道参与杂化,也就是sp3杂化。很多同学看到公式就有些懵了:π键数该如何计算呢?
这里我们要讲第三个知识点:大π键。
你可能觉得CO2分子中有两个C=O,但事实上,那真的是碳氧双键吗?
事实上,CO2中的那两个π键看成普通π键只是为了方便我们的理解,而那两个π键应该属于大π键,而他的孤对电子也因此被拿去。
我们先来看一下轨道的电子云模型(一种用来描述电子在原子核外空间某处出现机会(几率)的大小的模型,毕竟根据量子力学相关的定义,我们无法同时获得电子的位置和此时的时刻):

细心的同学可以发现,2p轨道其实是由3个相同结构构造成的,我们根据其朝向分别命名为2px、2py和2pz。
我们常见的π键,就是2p轨道的电子云通过侧面“肩碰肩”的方式形成的。
只是,大π键(离域π键)的形成和π键要求不同:
1. 一般情况下,所有参与形成离域π键的原子必须在同一直线或同一平面上。
2. 一般情况下,参与离域π键的原子都必须提供一个或两个互相平行的p轨道。
3. 一般情况下,形成离域π键的p电子的总数小于p轨道数的两倍。
大π键的常见表示方法:
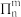 ,其中n为原子个数,m为共用电子个数,m≤2n。
,其中n为原子个数,m为共用电子个数,m≤2n。那么,m的值应该如何计算呢?
计算公式如下:
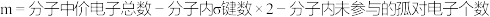
(6)试计算CO2分子中大π键的数量和对应的大π键表示:
(7)写出CO2分子中C原子的杂化情况:
到了这里,相信你已经能够解决题干刚开始给出的那个问题了:为什么CO2的空间结构是直线形,而H2O的空间结构却是V形呢?
已知电子对的数量和其对应的VSEPR模型如下表所示:
| 电子对数 | VSEPR模型 |
| 2 | 直线型 |
| 3 | 平面三角形(sp2杂化) 三角锥形(sp3杂化) |
| 4 | 四面体(正四面体) |
| 5 | 三角双锥型 |
| 6 | 正八面体 |
您最近半年使用:0次
名校
解题方法
7 . 铜及其化合物在科学研究和工业生产中具有许多用途,请回答下列问题:
(1)写出基态Cu原子的价电子排布式_______ 。
(2)已知高温下 比CuO稳定,从核外电子排布角度解释高温下
比CuO稳定,从核外电子排布角度解释高温下 更稳定的原因
更稳定的原因_______ 。
(3)配合物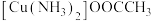 中碳原子的杂化类型是
中碳原子的杂化类型是_______ ,配体的空间构型为_______ 。配合物所含元素的电负性由大到小的顺序是_______ (用元素符号表示)。
(4)M原子的价电子排布式为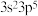 ,铜与M形成化合物的晶胞如图所示。
,铜与M形成化合物的晶胞如图所示。
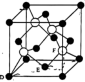
①原子坐标参数,表示晶胞内部各原子的相对位置。上图晶胞中,其中原子坐标参数D为(0,0,0),E为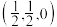 ,则F原子的坐标参数为
,则F原子的坐标参数为_______ 。
②已知该晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体中Cu原子和M原子之间的最短距离为
,则该晶体中Cu原子和M原子之间的最短距离为_______ pm(写出计算式)。
(1)写出基态Cu原子的价电子排布式
(2)已知高温下
 比CuO稳定,从核外电子排布角度解释高温下
比CuO稳定,从核外电子排布角度解释高温下 更稳定的原因
更稳定的原因(3)配合物
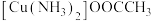 中碳原子的杂化类型是
中碳原子的杂化类型是(4)M原子的价电子排布式为
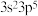 ,铜与M形成化合物的晶胞如图所示。
,铜与M形成化合物的晶胞如图所示。
①原子坐标参数,表示晶胞内部各原子的相对位置。上图晶胞中,其中原子坐标参数D为(0,0,0),E为
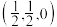 ,则F原子的坐标参数为
,则F原子的坐标参数为②已知该晶体的密度为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体中Cu原子和M原子之间的最短距离为
,则该晶体中Cu原子和M原子之间的最短距离为
您最近半年使用:0次
2022-10-12更新
|
458次组卷
|
4卷引用:辽宁省实验中学2023届高三上学期第一次阶段测试化学试题
解题方法
8 . 铀是原子反应堆的原料,常见铀的化合物有UF4、UO2、及(NH4)4[UO2(CO3)3]等,回答下列问题:
(1)基态氧原子的价电子排布图为_______ ;
(2)已知:2UO2+5NH4HF2 2UF4·2NH4F+3NH3↑+4H2O↑
2UF4·2NH4F+3NH3↑+4H2O↑
①NH4HF2中存在的化学键类型是_______ (填选项字母)。
A.离子键 B.配位键 C.共价键 D.范德华力
②该反应中非金属元素的第一电离能由大到小的顺序是_______ (填元素符号)。
(3)已知:3(NH4)4[UO2(CO3)3] 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
①分解产物中属于极性分子的有_______ 。
②反应物中的 的空间构型为
的空间构型为_______ 。分子中的大π键可用符号表示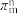 ,其中m代表参与形成大键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
,其中m代表参与形成大键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则
),则 中的大π键应表示为
中的大π键应表示为___ 。
(4)用Mg或Ca还原UF4可得金属铀,其Mg的熔点高于Ca,原因_______ ;
(5)UO2的晶胞结构如图所示:
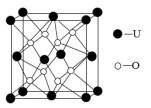
①晶胞中铀原子位于面心和顶点,氧原子填充在铀原子堆积形成的空隙中。则氧原子填充在铀原子形成的_______ 空隙中。
②若晶胞参数为apm,UO2摩尔质量为M,晶体的密度为_______ g·cm-3(列出计算式即可,设NA表示阿伏加德罗常数的值)。
(1)基态氧原子的价电子排布图为
(2)已知:2UO2+5NH4HF2
 2UF4·2NH4F+3NH3↑+4H2O↑
2UF4·2NH4F+3NH3↑+4H2O↑①NH4HF2中存在的化学键类型是
A.离子键 B.配位键 C.共价键 D.范德华力
②该反应中非金属元素的第一电离能由大到小的顺序是
(3)已知:3(NH4)4[UO2(CO3)3]
 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑①分解产物中属于极性分子的有
②反应物中的
 的空间构型为
的空间构型为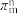 ,其中m代表参与形成大键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
,其中m代表参与形成大键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则
),则 中的大π键应表示为
中的大π键应表示为(4)用Mg或Ca还原UF4可得金属铀,其Mg的熔点高于Ca,原因
(5)UO2的晶胞结构如图所示:

①晶胞中铀原子位于面心和顶点,氧原子填充在铀原子堆积形成的空隙中。则氧原子填充在铀原子形成的
②若晶胞参数为apm,UO2摩尔质量为M,晶体的密度为
您最近半年使用:0次
解题方法
9 . Ⅰ.现有几组物质的熔点(℃)数据:
据此回答下列问题:
(1)由表格可知,A组物质熔点普遍偏高,据此回答:A组属于_______ 晶体,硅晶体的熔点低于二氧化硅,是由于_______ 。
(2)B组晶体共同的物理性质是具有良好的延展性和导电性,可用_______ (填序号)理论解释。
①价层电子对互斥理论 ②电子气理论 ③电子云理论
(3)C组中 相对分子质量小于
相对分子质量小于 但熔点却高于
但熔点却高于 ,是由于
,是由于_______ 。
(4)D组晶体中 、
、 、
、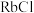 、
、 的熔点由高到低的顺序为
的熔点由高到低的顺序为_______ 。
Ⅱ.下图表示一些常见晶体的微观结构:
(5)其中代表 的是
的是_______ (填字母),在干冰晶体中,每个CO2分子周围紧邻的 分子有
分子有_______ 个。
(6) 晶体在
晶体在 的高压下和
的高压下和 反应生成如图所示的晶胞结构,则该晶体的化学式为
反应生成如图所示的晶胞结构,则该晶体的化学式为_______ 。
(7) 的晶胞如图所示,密度为
的晶胞如图所示,密度为 ,相邻的两个
,相邻的两个 的最近核间距为
的最近核间距为 ,则
,则 的摩尔质量为
的摩尔质量为_______  (列出代数式,设
(列出代数式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。

| A组 | B组 | C组 | D组 |
| 金刚石:3550 | 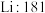 |  |  |
| 硅晶体:1410 | 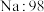 | 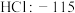 |  |
| 硼晶体:2300 |  | 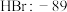 | 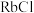 |
| 二氧化硅:1732 | 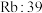 | 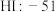 |  |
据此回答下列问题:
(1)由表格可知,A组物质熔点普遍偏高,据此回答:A组属于
(2)B组晶体共同的物理性质是具有良好的延展性和导电性,可用
①价层电子对互斥理论 ②电子气理论 ③电子云理论
(3)C组中
 相对分子质量小于
相对分子质量小于 但熔点却高于
但熔点却高于 ,是由于
,是由于(4)D组晶体中
 、
、 、
、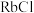 、
、 的熔点由高到低的顺序为
的熔点由高到低的顺序为Ⅱ.下图表示一些常见晶体的微观结构:

(5)其中代表
 的是
的是 分子有
分子有(6)
 晶体在
晶体在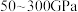 的高压下和
的高压下和 反应生成如图所示的晶胞结构,则该晶体的化学式为
反应生成如图所示的晶胞结构,则该晶体的化学式为
(7)
 的晶胞如图所示,密度为
的晶胞如图所示,密度为 ,相邻的两个
,相邻的两个 的最近核间距为
的最近核间距为 ,则
,则 的摩尔质量为
的摩尔质量为 (列出代数式,设
(列出代数式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近半年使用:0次
解题方法
10 . VIA族的氧、硫、硒(Se)、碲(Te)等元素的化合物在科学研究和工业生产中有许多重要用途。回答下列问题:
(1)基态O原子中,未成对电子数与成对电子数之比为_______ 。
(2)亚硫酰氯 在有机合成中有重要应用,分子中S原子的杂化轨道类型为
在有机合成中有重要应用,分子中S原子的杂化轨道类型为_______ ,分子的空间结构为_______ 。
(3)气态电中性基态原子得到一个电子转化为气态基态负离子所放出的能量叫做第一电子亲和能。S、Se、Te三种元素的第一电子亲和能由大到小的顺序是_______ , 、
、 和
和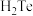 键角最小的是
键角最小的是_______ ,稳定性最强的是_______ 。
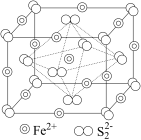
(4)黄铁矿是工业生产硫酸的原料,其晶胞结构如图所示,晶胞参数为anm,该晶体的电子式为_______ , 的配位数为
的配位数为_______ ,晶体的密度为_______  ,在1个晶胞中,由
,在1个晶胞中,由 围成的正八面体的个数为
围成的正八面体的个数为_______ 。
(1)基态O原子中,未成对电子数与成对电子数之比为
(2)亚硫酰氯
 在有机合成中有重要应用,分子中S原子的杂化轨道类型为
在有机合成中有重要应用,分子中S原子的杂化轨道类型为(3)气态电中性基态原子得到一个电子转化为气态基态负离子所放出的能量叫做第一电子亲和能。S、Se、Te三种元素的第一电子亲和能由大到小的顺序是
 、
、 和
和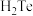 键角最小的是
键角最小的是(4)黄铁矿是工业生产硫酸的原料,其晶胞结构如图所示,晶胞参数为anm,该晶体的电子式为
 的配位数为
的配位数为 ,在1个晶胞中,由
,在1个晶胞中,由 围成的正八面体的个数为
围成的正八面体的个数为
您最近半年使用:0次



