1 . 现有如下反应: (提示:BrF3中F为
(提示:BrF3中F为 价),下列判断错误的是
价),下列判断错误的是
 (提示:BrF3中F为
(提示:BrF3中F为 价),下列判断错误的是
价),下列判断错误的是| A.BrF3既是氧化剂,又是还原剂 |
| B.被氧化的原子数与被还原的原子数之比为3∶2 |
| C.每当消耗3molBrF3,就有5molH2O被还原 |
| D.若反应转移3mol电子,则生成标准状况下11.2LO2 |
您最近一年使用:0次
名校
解题方法
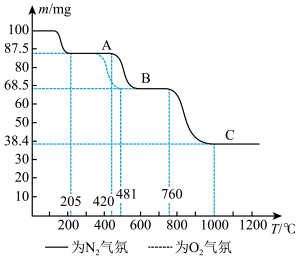
2 . 如图为 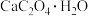 在
在 和
和 气氛中的热重曲线(样品质量随温度变化的曲线)。下列有关说法错误的是
气氛中的热重曲线(样品质量随温度变化的曲线)。下列有关说法错误的是
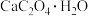 在
在 和
和 气氛中的热重曲线(样品质量随温度变化的曲线)。下列有关说法错误的是
气氛中的热重曲线(样品质量随温度变化的曲线)。下列有关说法错误的是
A.无论是 气氛还是 气氛还是 气氛,当 气氛,当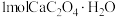 最终转变为 最终转变为 时,转移电子的物质的量相同 时,转移电子的物质的量相同 |
B.无论是 气氛还是 气氛还是 气氛, 气氛, 阶段均发生了氧化还原反应,但两者的气态产物不同 阶段均发生了氧化还原反应,但两者的气态产物不同 |
C.物质 为 为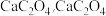 在隔绝空气条件下, 在隔绝空气条件下, 以下热稳定,不会分解 以下热稳定,不会分解 |
D.在酸性 溶液中加入少量 溶液中加入少量 固体样品时,溶液褪色且有少量气泡产生 固体样品时,溶液褪色且有少量气泡产生 |
您最近一年使用:0次
2021-11-24更新
|
738次组卷
|
3卷引用:重庆市缙云教育联盟2021-2022学年高二11月质量检测化学试题
重庆市缙云教育联盟2021-2022学年高二11月质量检测化学试题(已下线)解密02 物质的量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)湖南省长沙市第一中学2022-2023学年高三下学期月考(八)化学试题
名校
3 . 将一定体积的氯气通入含有0.3mol NaOH的浓溶液中,加热溶液少许时间后恰好完全反应,形成NaCl、NaClO、NaClO3共存体系。下列判断正确 的是
| A.与NaOH反应的氯气在标况下体积为6.72L |
| B.共存体系中n(Na+):n(Cl-)可能为7∶3 |
| C.若反应中转移的电子为n mol,则0.15≤n≤0.25 |
| D.n(NaCl):n(NaClO):n(NaClO3)可能为11∶1∶2 |
您最近一年使用:0次
2021-11-20更新
|
968次组卷
|
2卷引用:重庆市名校联盟2021-2022学年高一上学期第一次联合考试化学试题
名校
解题方法
4 . X、Y、Z、W是四种原子序数依次增大的短周期元素,W的最外层电子数比X的最外层电子数少1个,X、Y、Z为同一周期元素,X、Y、Z组成一种化合物(ZXY)2的结构式如图所示。下列说法错误的是
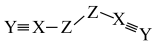
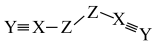
| A.化合物W2Z3是良好的耐热材料 |
| B.化合物(ZXY)2中Z元素的化合价为﹣2 |
| C.Y的氧化物对应的水化物可能是弱酸 |
| D.X元素能形成多种同素异形体 |
您最近一年使用:0次
名校
5 . 硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如图:
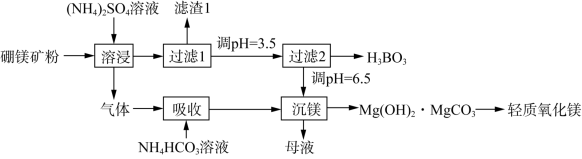
已知:H3BO3的解离反应:H3BO3+H2O H++[B(OH)4]-,Ka=5.81×10-10。下列说法不正确的是
H++[B(OH)4]-,Ka=5.81×10-10。下列说法不正确的是

已知:H3BO3的解离反应:H3BO3+H2O
 H++[B(OH)4]-,Ka=5.81×10-10。下列说法不正确的是
H++[B(OH)4]-,Ka=5.81×10-10。下列说法不正确的是| A.在95℃“溶浸”硼镁矿粉,产生的气体为NH3 |
| B.可选用KCSN溶液检验“过滤1”后的滤液中是否含有Fe3+离子 |
| C.在“过滤2”前,将溶液pH调节至3.5,主要目的是除去Fe3+和Al3+ |
| D.H3BO3与足量NaOH溶液反应的化学方程式:NaOH+H3BO3=Na[B(OH)4] |
您最近一年使用:0次
2021-05-23更新
|
1104次组卷
|
6卷引用:重庆市江津中学、铜梁中学、长寿中学等七校联盟2021届高三下学期第三次模拟考试化学试题
重庆市江津中学、铜梁中学、长寿中学等七校联盟2021届高三下学期第三次模拟考试化学试题重庆市长寿中学2021届高三5月考前模拟化学试题(已下线)2021年秋季高三开学摸底考化学试卷01(江苏专用)湖南省湘潭市湘潭县第一中学2021-2022学年高三下学期5月月考化学试题(已下线)易错点08 金属材料-备战2023年高考化学考试易错题辽宁省沈阳市第二中学2022-2023学年高三10月月考化学试题
名校
6 . 钠在液氨中溶剂化速度极快,生成蓝色的溶剂合电子,如图为钠投入液氨中的溶剂化图。钠沉入液氨中,快速得到深蓝色溶液,并慢慢产生气泡。下列说法错误的是
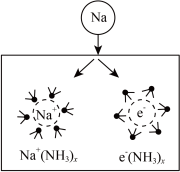

| A.钠的密度比液氨大 |
| B.溶液的导电性增强 |
| C.钠和液氨可发生以下反应:2NH3+2Na=2NaNH2+H2↑ |
| D.0.1mol钠投入液氨生成0.01molH2时,Na共失去0.02mol电子 |
您最近一年使用:0次
2021-05-07更新
|
1591次组卷
|
15卷引用:重庆市第一中学校 2021-2022学年高二上学期入学摸底考试化学试题
重庆市第一中学校 2021-2022学年高二上学期入学摸底考试化学试题山东省临沂市部分县区2020-2021学年高一下学期期中考试化学试题广东省广州市广州大学附属中学2020-2021学年高一下学期4月月考试题(已下线)课时14 钠及其化合物-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)黑龙江省实验中学2021-2022高三上学期第三次月考(开学考)化学试题天津市耀华中学2021-2022学年高三上学期第一次月考化学试题浙江省湖州市三贤联盟2021-2022学年高一上学期期中考试化学试题吉林省吉林市普通中学2022-2023学年高三第一次调研测试化学试题吉林省吉林市普通中学2022-2023学年高三上学期10月调研化学试题天津市耀华中学2022-2023学年高一上学期期中考试化学试题吉林省延边第二中学2022-2023学年高三上学期10月月考化学试题河南省许昌市禹州市高级中学2023-2024学年高三上学期9月月考化学试题福建省莆田第一中学2023-2024学年高一上学期期末考试化学试题
名校
7 . 探究是培养创新精神和实践能力的手段。用如下装置探究氯气的性质,图中三支试管口均放置浸有NaOH溶液的棉花。下列对实验现象的分析错误的是
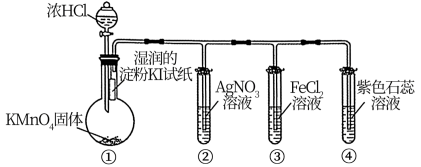

| A.①中淀粉KI试纸变蓝,说明氯气的氧化性强于碘 |
| B.②中产生白色沉淀,说明氯气与水反应生成Cl— |
| C.③中的溶液变为棕黄色,说明氯气有氧化性 |
| D.④溶液先变红后褪色,说明氯水有酸性和漂白性 |
您最近一年使用:0次
2021-03-18更新
|
5170次组卷
|
27卷引用:重庆市西南大学附中2020-2021学年高三下学期第四次月考化学试题
重庆市西南大学附中2020-2021学年高三下学期第四次月考化学试题广东省广州市2021届高三3月第一次模拟考试化学试题广东省广州市2021届高三下学期毕业班综合测试(一)化学试题(已下线)第四章能力提升检测卷(精练)-2022年高考化学一轮复习讲练测(已下线)第9周 周测卷-备战2022年高考化学周测与晚练(新高考专用)(已下线)专题07 非金属及其化合物-2022年高考化学二轮复习重点专题常考点突破练重庆市育才中学校2022-2023学年高一上学期期中考试化学试题广东省广州市三校2021-202学年高一上学期期末联考化学试题福建省厦门市同安第一中学2021-2022学年高一下学期第一次月考(3月)化学试题(已下线)第12讲 富集在海水中的元素——卤素(练)-2023年高考化学一轮复习讲练测(全国通用)第二节 氯及其化合物 第2课时 氯气的实验室制法及氯离子的检验江西省赣州市赣县第三中学2023届高三上学期月考强化训练(B8)化学试题辽宁省北镇市满族高级中学2022-2023学年高三上学期第一次质量检测化学试题广东省广州市海珠外国语实验中学2022-2023学年高一上学期第二次月考化学试题河南省安阳市第一中学2022-2023学年高一上学期12月月考化学试题山东省临沂第一中学文峰校区2022-2023学年高一上学期期末考试化学试题四川省成都市树德中学2022-2023学年高一上学期期末复习化学试题福建省尤溪县第七中学2022-2023学年高一下学期第一次阶段检测化学试题湖南省永州市第一中学2022-2023学年高一上学期期末考试化学试题 河南大学附属中学2022-2023学年高一下学期第一次月考化学试题湖南师范大学附属中学2023-2024学年高一上学期期中考试化学试题天津市双菱中学2023-2024学年高一上学期期中考试化学试卷陕西省西安市长安区第一中学2023-2024学年高一上学期期中考试化学试题河北省邯郸市涉县第一中学2023-2024学年高一上学期12月月考 化学试卷四川省成都市成华区某校2023-2024学年高一上学期12月月考化学试题湖南省长沙市雅礼中学2023-2024学年高三上学期一模化学试题黑龙江省哈尔滨市宾县第二中学2023-2024学年高一上学期第三次月考化学试题
名校
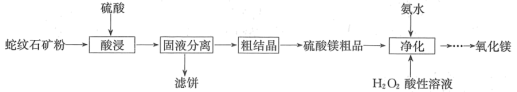
8 . 用蛇纹石(主要含3MgO·2SiO2·2H2O、FeO、Fe2O3、Al2O3及少量Cr2O3)制取MgO的工艺流程如图:
已知该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)“酸浸”时,当蛇纹石矿粉粒度一定、硫酸的浓度、活化剂用量及液固比一定时,提高浸取率还可采取的措施是___ (列举1条);3MgO·2SiO2·2H2O与硫酸反应的化学方程式为___ (生成产物之一为SiO2·nH2O)。
(2)“净化”过程包括“氧化”和“沉出杂质”两步骤。
①写出“氧化”时反应的离子方程式:___ 。
②“沉出杂质”加氨水时,应控制溶液pH的范围是___ 。
③氨水“净化”反应的温度对MgO纯度和产率的影响如图所示,在35~40℃,随温度升高,产率降低的主要原因是___ ;在25~50℃,温度越高,MgO纯度随温度升高而提高的主要原因是___ 。

(3)用2.76 t该蛇纹石(3MgO·2SiO2·2H2O含量为80%)原料按以上流程制取MgO,制取过程中Mg的损失率为6%,可以制得MgO的质量为___ kg。

已知该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Mg2+ |
| 开始沉淀pH | 1.6 | 3.3 | 3.8 | 6.5 | 9.4 |
| 沉淀完全pH | 3.2 | 5.2 | 6.8 | 9.7 | 12.4 |
(1)“酸浸”时,当蛇纹石矿粉粒度一定、硫酸的浓度、活化剂用量及液固比一定时,提高浸取率还可采取的措施是
(2)“净化”过程包括“氧化”和“沉出杂质”两步骤。
①写出“氧化”时反应的离子方程式:
②“沉出杂质”加氨水时,应控制溶液pH的范围是
③氨水“净化”反应的温度对MgO纯度和产率的影响如图所示,在35~40℃,随温度升高,产率降低的主要原因是

(3)用2.76 t该蛇纹石(3MgO·2SiO2·2H2O含量为80%)原料按以上流程制取MgO,制取过程中Mg的损失率为6%,可以制得MgO的质量为
您最近一年使用:0次
2021-01-22更新
|
693次组卷
|
5卷引用:重庆市黔江新华中学校2021届高三毕业班第二次联合考试化学试题
重庆市黔江新华中学校2021届高三毕业班第二次联合考试化学试题(已下线)大题02 化学工艺流程题(二)-【考前抓大题】备战2021年高考化学(全国通用)河南省郑州、商丘市名师联盟2021届高三12月教学质量检测化学试题(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-测试山东省菏泽市鄄城县第一中学2023-2024学年高三上学期1月月考化学试题
9 . 如图表示Fe与不同的浓度硝酸反应时,各种还原产物的相对含量与硝酸溶液浓度的关系。

下列说法正确的是

下列说法正确的是
| A.硝酸浓度越大,还原产物总类越多 |
| B.根据还原产物的化合价可推知硝酸浓度越低氧化性越强 |
C.若c(HNO3)=9.75mol/L,生成还原产物总量为1mol时,转移电子的物质的量为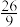 mol mol |
D.当HNO3浓度为12.2mol/L时,Fe与足量的HNO3反应的离子方程式为:2Fe+6H++2NO =2Fe2+++NO2↑+NO↑+3H2O =2Fe2+++NO2↑+NO↑+3H2O |
您最近一年使用:0次
2020-12-23更新
|
482次组卷
|
5卷引用:重庆市西南大学附属中学校高2021届高三第二次月考化学试题
重庆市西南大学附属中学校高2021届高三第二次月考化学试题山东省滨州市2021届高三上学期期末考试化学试题山东省威海乳山市银滩高级中学2022-2023学年高三9月月考化学试题(已下线)T12-化学反应及限度(已下线)选择题6-10
名校
10 . 化合物甲是一种常见无机物,其结构如下图所示(图中的“—”为单键或双键),其中W、X、Y、Z为元素周期表中的短周期主族元素,且原子序数依次增大,W和Y、X和Z分别为同主族元素,其四种元素原子的最外层电子数之和为14.下列叙述正确的是( )
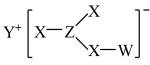
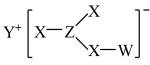
| A.W分别与X、Z形成的简单分子均为10电子微粒 |
| B.X、Y形成的离子化合物只含离子键 |
| C.X、Y、Z三种元素的简单离子半径大小顺序为Z>X>Y |
| D.等物质的量Y和Z的最高价氧化物对应的水化物反应生成甲 |
您最近一年使用:0次
2020-09-14更新
|
2895次组卷
|
12卷引用:重庆市第七中学2021届高三上学期期中化学试题
重庆市第七中学2021届高三上学期期中化学试题天一大联考“顶尖计划”2021届高三第一次考试化学试题黑龙江省大庆实验中学2021届高三上学期第一次月考化学试题黑龙江省哈尔滨师范大学附属中学2021届高三10月月考化学试题(已下线)【南昌新东方】6 2020年10月江西南昌-江科附中-高三-上学期-月考化学卷四川省绵阳市涪城区绵阳南山中学2021届高三上学期11月月考理综化学试题(已下线)小题必刷22 元素周期表(律)及其应用——2021年高考化学一轮复习小题必刷(通用版)(已下线)练习13 共价键-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)湖南省长沙市长郡中学2021-2022学年高三下学期月考考试(第六次)化学试题河南省商丘市第一高级中学2021-2022学年高一下学期开学测试化学试题山东省临沂第一中学文峰校区2022-2023学年高一上学期期末考试化学试题江苏省沛县中学2022-2023学年高三上学期12月月考化学试题



