名校
1 . 高铁酸钾 是一种高效多功能的新型绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知:
是一种高效多功能的新型绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知: 为紫色固体;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生
为紫色固体;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生 :
:
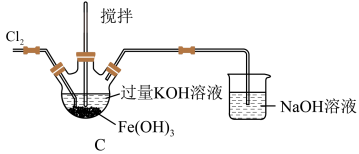
(1)C中得到紫色固体和溶液,写出得到紫色固体的化学方程式为___________ (并用双线桥表示电子转移),C中 发生的反应还有
发生的反应还有___________ 。(用离子方程式表示)
(2)探究 的性质
的性质
取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计如下方案:
,设计如下方案:
方案一:取少量a,经测定含有
方案二:用KOH溶液充分洗涤C中所得固体,再用KOH溶液将 溶出,得到紫色溶液b。取少量b,滴加盐酸,有
溶出,得到紫色溶液b。取少量b,滴加盐酸,有 产生。
产生。
①由方案一中可知a中含有 ,但该离子的产生不能判断一定是
,但该离子的产生不能判断一定是 将
将 氧化所得,还可能由
氧化所得,还可能由___________ 产生(文字描述)。
②方案二中要用KOH溶液充分洗涤所得固体的原因是___________ 。
③根据 的制备实验得出:氧化性
的制备实验得出:氧化性 大于
大于 ,而方案二实验中
,而方案二实验中 和
和 的氧化性强弱关系与之相反,原因是
的氧化性强弱关系与之相反,原因是___________ 。
(3)高铁酸钾水处理原理如图所示。
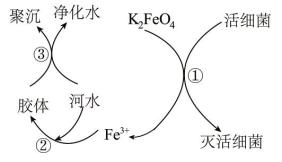
【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
①过程①中活细菌表现了___________ (填“氧化”或“还原”)性,该过程的还原产物是___________ (填离子符号);过程③属于___________ (填“物理”或“化学”)变化。
②根据上述原理分析,作水处理剂时, 的作用有
的作用有___________ 。(填两个)
 是一种高效多功能的新型绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知:
是一种高效多功能的新型绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知: 为紫色固体;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生
为紫色固体;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生 :
:
(1)C中得到紫色固体和溶液,写出得到紫色固体的化学方程式为
 发生的反应还有
发生的反应还有(2)探究
 的性质
的性质取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计如下方案:
,设计如下方案:方案一:取少量a,经测定含有

方案二:用KOH溶液充分洗涤C中所得固体,再用KOH溶液将
 溶出,得到紫色溶液b。取少量b,滴加盐酸,有
溶出,得到紫色溶液b。取少量b,滴加盐酸,有 产生。
产生。①由方案一中可知a中含有
 ,但该离子的产生不能判断一定是
,但该离子的产生不能判断一定是 将
将 氧化所得,还可能由
氧化所得,还可能由②方案二中要用KOH溶液充分洗涤所得固体的原因是
③根据
 的制备实验得出:氧化性
的制备实验得出:氧化性 大于
大于 ,而方案二实验中
,而方案二实验中 和
和 的氧化性强弱关系与之相反,原因是
的氧化性强弱关系与之相反,原因是(3)高铁酸钾水处理原理如图所示。

【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
①过程①中活细菌表现了
②根据上述原理分析,作水处理剂时,
 的作用有
的作用有
您最近一年使用:0次
名校
解题方法
2 . 2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。
(1)In在周期表中的位置是______ 。
(2)In的最高价氧化物对应的水化物的碱性______ Ba(OH)2的碱性(填“>”或“<”)。
(3)硒(34Se)是动物和人体所必需的微量元素之一,也是重要的工业原料,与氧同族。Se原子电子式可表示为______ 。
(4)下列说法合理的是______ 。
a.SeO2既有氧化性又有还原性 b.热稳定性:H2Se<HCl<H2S
c.酸性:H2SeO4<HBrO4<HClO4 d.Se比S更易与氢气反应
(1)In在周期表中的位置是
(2)In的最高价氧化物对应的水化物的碱性
(3)硒(34Se)是动物和人体所必需的微量元素之一,也是重要的工业原料,与氧同族。Se原子电子式可表示为
(4)下列说法合理的是
a.SeO2既有氧化性又有还原性 b.热稳定性:H2Se<HCl<H2S
c.酸性:H2SeO4<HBrO4<HClO4 d.Se比S更易与氢气反应
您最近一年使用:0次
22-23高一下·上海浦东新·期中
名校
解题方法
3 . 钠元素在自然界中都以化合物的形式存在,钠的单质和化合物用途广泛,回答下列问题:
(1)采用空气和Na为原料可制备 。空气与熔融的金属Na反应前需依次通过的试剂为
。空气与熔融的金属Na反应前需依次通过的试剂为___________ 、___________ (选填编号)。
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d. 溶液
溶液
(2)向酸性 溶液中加入
溶液中加入 粉末,观察到溶液褪色,发生如下反应:___________
粉末,观察到溶液褪色,发生如下反应:___________ ___________
___________ ___________
___________ ___________
___________ ___________
___________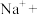 ___________
___________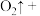 ___________。配平上述离子方程式,并用单线桥法表示电子转移的方向和数目
___________。配平上述离子方程式,并用单线桥法表示电子转移的方向和数目___________ 。该反应说明 具有
具有___________ (选填“氧化性”“还原性”或“漂白性”)。
某研究性学习小组的同学,为测定某种含有少量氧化钠的过氧化钠试样中过氧化钠的含量,称取w g样品与足量的水反应,测定生成气体在通常状况(约20℃,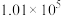 Pa)的体积,设计了如图所示的实验装置进行探究
Pa)的体积,设计了如图所示的实验装置进行探究
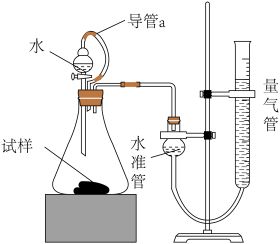
回答下列问题:
(3)装置中导管a的作用是___________ 。
(4)反应前后量气管中液面读数分别为 mL、
mL、 mL(实验条件下的气体摩尔体积为
mL(实验条件下的气体摩尔体积为 L/mol),试计算试样中过氧化钠的质量分数:
L/mol),试计算试样中过氧化钠的质量分数:___________ 。
(5)通过实验,测得该试样中过氧化钠质量分数偏高,产生这种现象的原因可能是___________ (选填编号)。
a.反应后测定气体体积时水准管的水面低于量气管的水面
b.锥形瓶中留有反应生成的气体
c.测定气体体积时未冷却至室温
(1)采用空气和Na为原料可制备
 。空气与熔融的金属Na反应前需依次通过的试剂为
。空气与熔融的金属Na反应前需依次通过的试剂为a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.
 溶液
溶液(2)向酸性
 溶液中加入
溶液中加入 粉末,观察到溶液褪色,发生如下反应:___________
粉末,观察到溶液褪色,发生如下反应:___________ ___________
___________ ___________
___________ ___________
___________ ___________
___________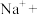 ___________
___________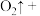 ___________。配平上述离子方程式,并用单线桥法表示电子转移的方向和数目
___________。配平上述离子方程式,并用单线桥法表示电子转移的方向和数目 具有
具有某研究性学习小组的同学,为测定某种含有少量氧化钠的过氧化钠试样中过氧化钠的含量,称取w g样品与足量的水反应,测定生成气体在通常状况(约20℃,
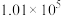 Pa)的体积,设计了如图所示的实验装置进行探究
Pa)的体积,设计了如图所示的实验装置进行探究
回答下列问题:
(3)装置中导管a的作用是
(4)反应前后量气管中液面读数分别为
 mL、
mL、 mL(实验条件下的气体摩尔体积为
mL(实验条件下的气体摩尔体积为 L/mol),试计算试样中过氧化钠的质量分数:
L/mol),试计算试样中过氧化钠的质量分数:(5)通过实验,测得该试样中过氧化钠质量分数偏高,产生这种现象的原因可能是
a.反应后测定气体体积时水准管的水面低于量气管的水面
b.锥形瓶中留有反应生成的气体
c.测定气体体积时未冷却至室温
您最近一年使用:0次
名校
4 . 某校化学小组学生利用如图所示装置进行“铁与水反应”的实验,并利用产物进一步制取 晶体(图中夹持及尾气处理装置均已略去)。
晶体(图中夹持及尾气处理装置均已略去)。
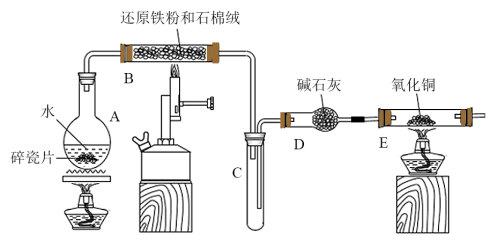
(1)装置A中碎瓷片的作用是___________ ;装置B中发生反应的化学方程式是___________ 。
(2)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中 的方法。
的方法。___________
(3)该小组学生利用上述滤液制取 晶体,设计流程如下:
晶体,设计流程如下:

①步骤I中加入的试剂可以是___________ 。
a.酸性 溶液 b.铁粉 c.稀
溶液 b.铁粉 c.稀 d.
d. 溶液
溶液
②步骤Ⅰ中也可以通入 ,写出发生反应的离子方程式
,写出发生反应的离子方程式___________ 。
③已知 的溶解度随温度升高而变大,则步骤Ⅱ从
的溶解度随温度升高而变大,则步骤Ⅱ从 稀溶液中得到
稀溶液中得到 晶体的主要操作包括:
晶体的主要操作包括:__________________________ 。
(4)高铁酸盐(如高铁酸钾 )有强氧化性,是一种绿色的水处理剂。高铁酸盐可通过在碱性条件下氧化
)有强氧化性,是一种绿色的水处理剂。高铁酸盐可通过在碱性条件下氧化 制备。完成以下离子方程式:
制备。完成以下离子方程式:
_____ +_____
+_____ +______=______
+______=______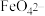 +_____
+_____ +_____,
+_____,______________
该反应中被氧化的元素是___________ ,每生成1mol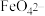 转移
转移___________ 个电子。
 晶体(图中夹持及尾气处理装置均已略去)。
晶体(图中夹持及尾气处理装置均已略去)。
(1)装置A中碎瓷片的作用是
(2)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中
 的方法。
的方法。(3)该小组学生利用上述滤液制取
 晶体,设计流程如下:
晶体,设计流程如下:
①步骤I中加入的试剂可以是
a.酸性
 溶液 b.铁粉 c.稀
溶液 b.铁粉 c.稀 d.
d. 溶液
溶液②步骤Ⅰ中也可以通入
 ,写出发生反应的离子方程式
,写出发生反应的离子方程式③已知
 的溶解度随温度升高而变大,则步骤Ⅱ从
的溶解度随温度升高而变大,则步骤Ⅱ从 稀溶液中得到
稀溶液中得到 晶体的主要操作包括:
晶体的主要操作包括:(4)高铁酸盐(如高铁酸钾
 )有强氧化性,是一种绿色的水处理剂。高铁酸盐可通过在碱性条件下氧化
)有强氧化性,是一种绿色的水处理剂。高铁酸盐可通过在碱性条件下氧化 制备。完成以下离子方程式:
制备。完成以下离子方程式:_____
 +_____
+_____ +______=______
+______=______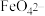 +_____
+_____ +_____,
+_____,该反应中被氧化的元素是
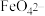 转移
转移
您最近一年使用:0次
名校
5 . 高铁酸钾(K2FeO4)是一种高效多功能的新型非氯绿色消毒剂。查阅资料可知:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
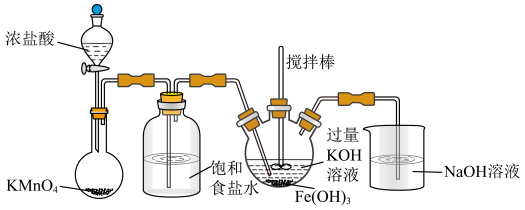
(1)A为氯气发生装置。A中反应的离子方程式是_______ (锰被还原为Mn2+)。
(2)装置B的作用为_______ 。
(3)C中得到紫色固体和溶液。C中Cl2发生的反应有:①2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O和②_______ (写离子方程式)。
(4)C中搅拌的作用是_______ 。
(5)反应结束后,过滤C中生成固体,并用KOH溶液充分洗涤,即可得到K2FeO4。使用KOH溶液而非蒸馏水洗涤的目的是_______ 。
(6)通过计算得知K2FeO4的消毒效率(以单位质量得到的电子数表示,消毒后Fe元素变为+3价)约是氯气的_______ 倍(保留两位小数)。与氯气相比较,该消毒剂的优越性_______ 。

(1)A为氯气发生装置。A中反应的离子方程式是
(2)装置B的作用为
(3)C中得到紫色固体和溶液。C中Cl2发生的反应有:①2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O和②
(4)C中搅拌的作用是
(5)反应结束后,过滤C中生成固体,并用KOH溶液充分洗涤,即可得到K2FeO4。使用KOH溶液而非蒸馏水洗涤的目的是
(6)通过计算得知K2FeO4的消毒效率(以单位质量得到的电子数表示,消毒后Fe元素变为+3价)约是氯气的
您最近一年使用:0次
名校
6 . 为探究铁及其化合物的性质,某班几个兴趣小组做了以下实验。
(1)甲组同学利用下列试剂:铜粉、0.1mol/LFeCl3溶液、0.1mol/LFeCl2溶液、KSCN溶液、新制氯水等,探究Fe2+、Fe3+的性质,设计实验方案进行实验,完成下列表格。
上述反应①可用于刻蚀印刷电路板,若将反应设计为原电池(如图),可加快刻蚀的速率,请在图中补充相关信息。___________

(2)乙组同学为了制备Fe(OH)2沉淀且保持一段时间不变色,尝试用如图所示的装置进行实验。
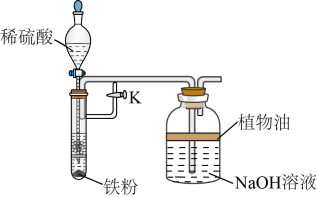
①Fe(OH)2暴露在空气中的颜色变化为___________ ,原因是___________ (用化学方程式表示)。
②实验时,先___________ (填“打开”或“关闭”)止水夹K,然后打开分液漏斗的活塞,一段时间后,___________ (填“打开”或“关闭”)K。
(3)向300mL0.2mol/L的FeSO4溶液中加入足量的NaOH溶液,沉淀经过滤、加热灼烧至质量不再变化后,得到的固体质量为___________ g。
(1)甲组同学利用下列试剂:铜粉、0.1mol/LFeCl3溶液、0.1mol/LFeCl2溶液、KSCN溶液、新制氯水等,探究Fe2+、Fe3+的性质,设计实验方案进行实验,完成下列表格。
| 探究内容 | 实验方案 | 实验现象 | 写出离子方程式 |
| 探究Fe2+具有还原性 | 取少量FeCl2溶液,加入少量KSCN溶液后,再往溶液中加入少量 | 溶液先不变红,后变为血红色。 | Fe2+发生的反应: |
| 探究Fe3+具有氧化性 | ①取少量FeCl3溶液,加入足量 | 溶液不变为血红色。 | Fe3+发生的反应: |
| ②取少量FeCl3溶液,通入足量SO2,振荡、静置后滴入BaCl2溶液 | 溶液逐渐由黄色变为浅绿色,滴入BaCl2溶液,有白色沉淀生成 | Fe3+与SO2发生的反应: |

(2)乙组同学为了制备Fe(OH)2沉淀且保持一段时间不变色,尝试用如图所示的装置进行实验。

①Fe(OH)2暴露在空气中的颜色变化为
②实验时,先
(3)向300mL0.2mol/L的FeSO4溶液中加入足量的NaOH溶液,沉淀经过滤、加热灼烧至质量不再变化后,得到的固体质量为
您最近一年使用:0次
名校
7 . 钠是一种活泼金属,其化合物在生产生活中具有广泛应用。
(1)下列有关钠及其化合物的说法正确的是___________。
(2)下列试剂可以鉴别NaHCO3溶液和Na2CO3溶液的是___________。
(3)Na2O2因能与CO2反应可作潜水艇的供氧剂,涉及的反应方程式为___________ 。
(4)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应:___________
___________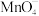 +___________Na2O2+___________=___________Mn2++___________Na++___________+___________
+___________Na2O2+___________=___________Mn2++___________Na++___________+___________
补全方程式并配平,该反应说明Na2O2粉末具有___________ (填“氧化性”“还原性”或“漂白性”)。
(5)将过氧化钠粉末投入到氯化亚铁溶液中,有关现象说法正确的是___________。
(6)向100mLNaOH溶液中通入一定量CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液。向上述所得溶液中,逐滴滴加2mol·L-1的盐酸,所得气体的体积与所加盐酸体积的关系如图所示。

①OA段发生反应的离子方程式为___________ 。
②混合溶液中Na2CO3和NaHCO3的物质的量之比为___________ 。
③原NaOH溶液的物质的量浓度为___________ mol/L。
(1)下列有关钠及其化合物的说法正确的是___________。
| A.少量钠保存在酒精中 | B.Na2O2是白色固体,性质不稳定 |
C.热稳定性: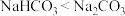 | D. 常用来治疗胃酸过多 常用来治疗胃酸过多 |
| A.Ba(OH)2 | B.NaOH溶液 | C.CaCl2溶液 | D.稀盐酸 |
(4)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应:
___________
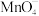 +___________Na2O2+___________=___________Mn2++___________Na++___________+___________
+___________Na2O2+___________=___________Mn2++___________Na++___________+___________补全方程式并配平,该反应说明Na2O2粉末具有
(5)将过氧化钠粉末投入到氯化亚铁溶液中,有关现象说法正确的是___________。
| A.生成红褐色沉淀 | B.没有气体产生 | C.生成白色沉淀 | D.有无色气体产生 |

①OA段发生反应的离子方程式为
②混合溶液中Na2CO3和NaHCO3的物质的量之比为
③原NaOH溶液的物质的量浓度为
您最近一年使用:0次
名校
8 . 含氯化合物能发生如下反应:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O。关于该反应,下列说法正确的是
| A.氧化剂和还原剂的物质的量之比为1:4 |
| B.该反应中,氧化性:HCl>ClO2 |
| C.反应每生成22.4L气体,则转移了5NA个电子 |
| D.HCl在该反应中体现了酸性和还原性 |
您最近一年使用:0次
2023-03-19更新
|
94次组卷
|
2卷引用:上海市宜川中学2022-2023学年高二下学期3月阶段测试化学试题
名校
解题方法
9 . 自来水厂往往利用Cl2杀菌消毒,主要是由于Cl2和H2O反应生成的次氯酸具有
| A.酸性 | B.氧化性 | C.还原性 | D.漂白性 |
您最近一年使用:0次
名校
解题方法
10 . 下表所示为某5种元素的相关信息,已知W、X都位于第三周期。
请根据要求回答问题:
(1)Q原子的结构示意图为___________ ,W在元素周期表中的位置为___________ ,Y的最高价氧化物对应水化物的化学式为___________ 。
(2)用电子式表示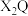 的形成过程
的形成过程___________ 。
(3)原子序数为Q的2倍的元素是___________ (填元素符号),该元素单质在过量Q元素的单质中燃烧,产物是___________ (写选项编号)
A. B.
B.
(4)X的单质与水反应的化学方程式是___________ 。
(5)下列对于Z及其化合物的推断中正确的是___________ (双选,填选项编号)。
A.Z的化合价中有-1和+7
B.Z元素单质的氧化性强于W元素单质的氧化性
C.Z的最高价氧化物对应水化物的酸性弱于W的最高价氧化物对应水化物的酸性
(6)金属性:Y___________ X(填“>”或“<”),从原子结构角度解释其原因___________ 。
(7)将X元素的单质在Q元素的单质中点燃生成M___________ (填产物名称),将M投入水中,反应现象是___________ 。
| 元素 | 信息 |
| Q | 最外层电子数是次外层电子数的3倍 |
| W | 最高化合价为+7 |
| X | 最高价氧化物对应的水化物在本周期中碱性最强 |
| Y | 焰色试验(透过蓝色钴玻璃)的火焰呈紫色 |
| Z | 与W同主族且其单质在 溶液中呈橙红色 溶液中呈橙红色 |
(1)Q原子的结构示意图为
(2)用电子式表示
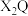 的形成过程
的形成过程(3)原子序数为Q的2倍的元素是
A.
 B.
B.
(4)X的单质与水反应的化学方程式是
(5)下列对于Z及其化合物的推断中正确的是
A.Z的化合价中有-1和+7
B.Z元素单质的氧化性强于W元素单质的氧化性
C.Z的最高价氧化物对应水化物的酸性弱于W的最高价氧化物对应水化物的酸性
(6)金属性:Y
(7)将X元素的单质在Q元素的单质中点燃生成M
您最近一年使用:0次



