1 . 下表是几种弱酸常温下的电离平衡常数:
(1)CH3COOH、H2CO3、H2S、H3PO4四种酸的酸性由强到弱的顺序为___________ ;
(2)同浓度的CH3COO-、HCO 、
、 、S2-结合H+的能力由强到弱的顺序为
、S2-结合H+的能力由强到弱的顺序为___________ ;
(3)写出下列反应的离子方程式:向Na2S溶液中通入少量的CO2气体___________ 。
| CH3COOH | H2CO3 | H2S | H3PO4 |
 | 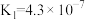 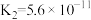 | 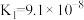  | 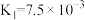 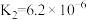  |
(1)CH3COOH、H2CO3、H2S、H3PO4四种酸的酸性由强到弱的顺序为
(2)同浓度的CH3COO-、HCO
 、
、 、S2-结合H+的能力由强到弱的顺序为
、S2-结合H+的能力由强到弱的顺序为(3)写出下列反应的离子方程式:向Na2S溶液中通入少量的CO2气体
您最近一年使用:0次
2 . 回答下列问题。
(1)发射卫星用N2H4为燃料,NO2为氧化剂,两者反应生成N2和水蒸气,已知:
N2(g)+2O2(g)=2NO2(g) ΔH1=+67.7kJ/mol;
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534kJ/mol;
试写出N2H4与 NO2反应的热化学方程式___________ 。
(2)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3(g)的热化学方程式为___________ 。
(1)发射卫星用N2H4为燃料,NO2为氧化剂,两者反应生成N2和水蒸气,已知:
N2(g)+2O2(g)=2NO2(g) ΔH1=+67.7kJ/mol;
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534kJ/mol;
试写出N2H4与 NO2反应的热化学方程式
(2)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3(g)的热化学方程式为
您最近一年使用:0次
名校
解题方法
3 . Cu2O是一种半导体材料,实验室用铅酸蓄电池电解一定浓度的NaOH溶液制备Cu2O,方程式为2Cu+H2O Cu2O+H2↑装置如图所示,回答下列问题。
Cu2O+H2↑装置如图所示,回答下列问题。
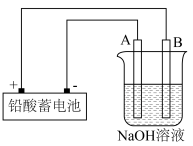
已知铅酸蓄电池的电池反应为PbO2+Pb+2H2SO4 2PbSO4+2H2O
2PbSO4+2H2O
(1)制备过程中铅酸蓄电池正极电极反应式___________ 。
(2)A、B电极反应式为A:___________ 、B:___________ 。
(3)制备过程中,每生成1molCu2O,电路中转移___________ mol电子,消耗___________ molH2SO4。
 Cu2O+H2↑装置如图所示,回答下列问题。
Cu2O+H2↑装置如图所示,回答下列问题。
已知铅酸蓄电池的电池反应为PbO2+Pb+2H2SO4
 2PbSO4+2H2O
2PbSO4+2H2O(1)制备过程中铅酸蓄电池正极电极反应式
(2)A、B电极反应式为A:
(3)制备过程中,每生成1molCu2O,电路中转移
您最近一年使用:0次
4 . 从NO 、SO
、SO 、H+、Cu2+、Ba2+、Ag+、Cl-等离子中选出适当的离子组成电解质,采用惰性电极对其溶液进行电解。
、H+、Cu2+、Ba2+、Ag+、Cl-等离子中选出适当的离子组成电解质,采用惰性电极对其溶液进行电解。
(1)两极分别放出H2和O2时,电解质的化学式可能是___________ (至少答一种,下同)。
(2)若阴极析出金属、阳极放出O2时,电解质的化学式可能是___________ 。
(3)两极分别放出气体,且体积比为1∶1,电解质的化学式可能是___________ 。
 、SO
、SO 、H+、Cu2+、Ba2+、Ag+、Cl-等离子中选出适当的离子组成电解质,采用惰性电极对其溶液进行电解。
、H+、Cu2+、Ba2+、Ag+、Cl-等离子中选出适当的离子组成电解质,采用惰性电极对其溶液进行电解。(1)两极分别放出H2和O2时,电解质的化学式可能是
(2)若阴极析出金属、阳极放出O2时,电解质的化学式可能是
(3)两极分别放出气体,且体积比为1∶1,电解质的化学式可能是
您最近一年使用:0次
2023-08-26更新
|
137次组卷
|
6卷引用:高二人教版选修4 第四章 第三节 电解池
高二人教版选修4 第四章 第三节 电解池湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题15 电解池(已下线)1.2.3 电解池的工作原理及应用(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)(已下线)4.2.1 电解池原理-同步学习必备知识第1课时 电解原理第1课时 电解的原理
名校
5 . 1797年,法国化学家Vauquelin发现了一种新元素。由于包含这种元素的矿物呈现出多种颜色,因此称之为Chromium,元素符号为Cr。一些含Cr元素的物质或微粒的性质如表。
(1)取少量Cr(OH)3于试管中,逐滴加入稀硫酸,直至过量,可观察到的现象为___________ 。
(2)请结合平衡移动原理,解释(1)中现象___________ 。
(3)将Cr(OH)3加热可得到Cr2O3固体,将稍过量的Cr2O3固体与Na2CO3固体混合均匀,在空气中高温煅烧,可得到黄色的Na2CrO4固体,请写出该反应的化学方程式___________ 。
(4)Na2CrO4部分水合物溶解度如图1。
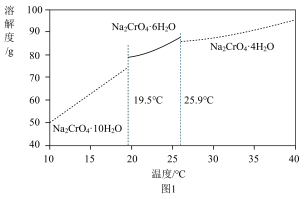
将(3)中所得固体溶解于水中,过滤,得到Na2CrO4溶液。从该溶液中获得Na2CrO4•6H2O的方法为___________ 。
(5)向0.1mol/LNa2CrO4溶液滴加浓硫酸(忽略溶液体积变化),不同pH下,溶液中含+6价Cr元素的微粒浓度变化如图2所示。
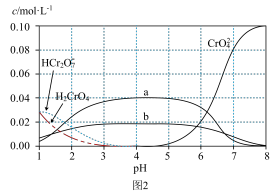
①a代表的微粒是___________ 。
②溶液由pH4.5向pH3.5转化过程中,溶液颜色几乎不变,请结合化学用语解释其原因_______ 。
| 物质 | Cr(OH)3 | H2CrO4 | H2Cr2O7 | |||||
| 性质 | 灰蓝色固体,难溶于水两性氢氧化物 | 红色固体,水溶液为黄色中强酸 | 无纯净物,只存在于水溶液中,强酸 | |||||
| 微粒 | Cr3+ | Cr(OH) |  、HCrO 、HCrO |  、HCr2O 、HCr2O | ||||
| 颜色 | 蓝紫色 | 绿色 | 黄色 | 橙红色 | ||||
(1)取少量Cr(OH)3于试管中,逐滴加入稀硫酸,直至过量,可观察到的现象为
(2)请结合平衡移动原理,解释(1)中现象
(3)将Cr(OH)3加热可得到Cr2O3固体,将稍过量的Cr2O3固体与Na2CO3固体混合均匀,在空气中高温煅烧,可得到黄色的Na2CrO4固体,请写出该反应的化学方程式
(4)Na2CrO4部分水合物溶解度如图1。

将(3)中所得固体溶解于水中,过滤,得到Na2CrO4溶液。从该溶液中获得Na2CrO4•6H2O的方法为
(5)向0.1mol/LNa2CrO4溶液滴加浓硫酸(忽略溶液体积变化),不同pH下,溶液中含+6价Cr元素的微粒浓度变化如图2所示。

①a代表的微粒是
②溶液由pH4.5向pH3.5转化过程中,溶液颜色几乎不变,请结合化学用语解释其原因
您最近一年使用:0次
6 . 已知下列热化学方程式:
①H2(g)+ O2(g)=H2O(l) ΔH=−285.8 kJ∙mol−1
O2(g)=H2O(l) ΔH=−285.8 kJ∙mol−1
②H2(g)+ O2(g)=H2O(g) ΔH=−241.8 kJ∙mol−1
O2(g)=H2O(g) ΔH=−241.8 kJ∙mol−1
③C(s)+ O2(g)=CO(g) ΔH=−110.5 kJ∙mol−1
O2(g)=CO(g) ΔH=−110.5 kJ∙mol−1
④C(s)+O2(g) =CO2(g) ΔH=−393.5 kJ∙mol−1
回答下列问题:
(1)上述反应中属于放热反应的是_______ 。(填序号)
(2)CO的燃烧热为_______ ,其热化学方程式为_______ 。
(3)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为______
(4)已知拆开1mol H−H键,1molN−H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_______ 。
①H2(g)+
 O2(g)=H2O(l) ΔH=−285.8 kJ∙mol−1
O2(g)=H2O(l) ΔH=−285.8 kJ∙mol−1②H2(g)+
 O2(g)=H2O(g) ΔH=−241.8 kJ∙mol−1
O2(g)=H2O(g) ΔH=−241.8 kJ∙mol−1③C(s)+
 O2(g)=CO(g) ΔH=−110.5 kJ∙mol−1
O2(g)=CO(g) ΔH=−110.5 kJ∙mol−1④C(s)+O2(g) =CO2(g) ΔH=−393.5 kJ∙mol−1
回答下列问题:
(1)上述反应中属于放热反应的是
(2)CO的燃烧热为
(3)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为
(4)已知拆开1mol H−H键,1molN−H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
您最近一年使用:0次
7 . 利用电化学原理,将 和熔融
和熔融 制成燃料电池,模拟工业电解法来处理含
制成燃料电池,模拟工业电解法来处理含 的废水,如图所示;电解过程中溶液发生反应:
的废水,如图所示;电解过程中溶液发生反应: 。
。
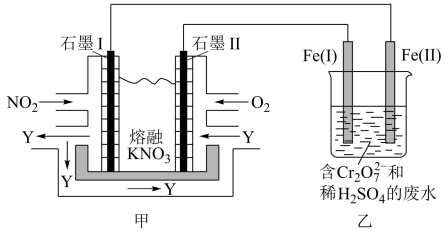
(1)甲池工作时, 转变成绿色硝化剂Y,Y是
转变成绿色硝化剂Y,Y是 ,可循环使用。则石墨II是电池的
,可循环使用。则石墨II是电池的_______ (填“正”或“负”)极;石墨I附近发生的电极反应式为_______ 。
(2)工作时,甲池内的 向
向_______ (填“石墨I”或“石墨II”)极移动;在相同条件下,消耗的 和
和 的体积比为
的体积比为_______ 。
(3)乙池中 (I)棒上发生的电极反应为
(I)棒上发生的电极反应为_______ 。
(4)若溶液中减少了 ,则电路中至少转移了
,则电路中至少转移了_______  电子。
电子。
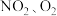 和熔融
和熔融 制成燃料电池,模拟工业电解法来处理含
制成燃料电池,模拟工业电解法来处理含 的废水,如图所示;电解过程中溶液发生反应:
的废水,如图所示;电解过程中溶液发生反应: 。
。
(1)甲池工作时,
 转变成绿色硝化剂Y,Y是
转变成绿色硝化剂Y,Y是 ,可循环使用。则石墨II是电池的
,可循环使用。则石墨II是电池的(2)工作时,甲池内的
 向
向 和
和 的体积比为
的体积比为(3)乙池中
 (I)棒上发生的电极反应为
(I)棒上发生的电极反应为(4)若溶液中减少了
 ,则电路中至少转移了
,则电路中至少转移了 电子。
电子。
您最近一年使用:0次
2023-02-14更新
|
199次组卷
|
7卷引用:福建省南安第一中学2017-2018学年高二上学期期中考试化学试题
福建省南安第一中学2017-2018学年高二上学期期中考试化学试题山东师范大学附属中学2021届高三上学期期中考试(11月)化学试题(已下线)第19讲 电解池 金属的电化学腐蚀与防护(精练)-2022年高考化学一轮复习讲练测天津市静海区第一中学2021-2022学年高三上学期12月调研考试化学试题(已下线)第六章 化学反应与能量 第38练 电解原理的综合应用(已下线)热点题型训练 电化学串联装置的两大模型(已下线)电化学原理及应用
2020高三·全国·专题练习
解题方法
8 . 硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g)+ O2 (g)
O2 (g) SO3(g),ΔH=-98kJ·mol-1,钒催化剂参与反应的能量变化如图(a)所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为:
SO3(g),ΔH=-98kJ·mol-1,钒催化剂参与反应的能量变化如图(a)所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为:___________ 。

 O2 (g)
O2 (g) SO3(g),ΔH=-98kJ·mol-1,钒催化剂参与反应的能量变化如图(a)所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为:
SO3(g),ΔH=-98kJ·mol-1,钒催化剂参与反应的能量变化如图(a)所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为:
您最近一年使用:0次
2023-02-01更新
|
898次组卷
|
14卷引用:专题07 化学反应中的能量变化-2020年高考真题和模拟题化学分项汇编
(已下线)专题07 化学反应中的能量变化-2020年高考真题和模拟题化学分项汇编(已下线)押山东卷第07题 化学反应与能量-备战2021年高考化学临考题号押题(山东卷)(已下线)小题27 盖斯定律及应用——备战2021年高考化学经典小题考前必刷(全国通用)(已下线)考向18 化学反应与能量变化-备战2022年高考化学一轮复习考点微专题(已下线)回归教材重难点05 化学反应中的能量变化-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)专题强化练1 突破热化学方程式的书写(已下线)第15讲 化学反应的热效应 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题15 反应热计算的几种类型-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 专题10 热化学方程式的书写与盖斯定律(已下线)第六章 化学反应与能量 第34讲 反应热的计算(已下线)题型98 结合反应能量图示或物质循环图示书写热化学方程式(已下线)专题14 化学反应与热量计算-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)01 常考题空1 热化学方程式及反应热的计算 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)第2讲 盖斯定律 反应热的计算
9 . 硒是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的阳极泥中提取硒。
(1)粗铜精炼时,通常用精铜作___________ 极(填“阴”或“阳”)。
(2)Se与 处于同一主族,比
处于同一主族,比 原子多1个电子层,Se的原子序数为
原子多1个电子层,Se的原子序数为___________ ,最高价氧化物的化学式为___________ 。
(3)阳极泥中的硒主要以Se和CuSe的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
i、将含硒阳极泥与浓硫酸混合焙烧,产生 的混合气体;
的混合气体;
ii、用水吸收i中混合气体,可得Se固体。
①请写出 与浓
与浓 反应的化学方程式
反应的化学方程式___________ 。
②焙烧过程产生的烟气中含有少量 ,可用
,可用 溶液吸收,二者反应生成一种盐,该盐的化学式为
溶液吸收,二者反应生成一种盐,该盐的化学式为___________ 。
③写出步骤ii中的化学方程式___________ 。
(1)粗铜精炼时,通常用精铜作
(2)Se与
 处于同一主族,比
处于同一主族,比 原子多1个电子层,Se的原子序数为
原子多1个电子层,Se的原子序数为(3)阳极泥中的硒主要以Se和CuSe的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
i、将含硒阳极泥与浓硫酸混合焙烧,产生
 的混合气体;
的混合气体;ii、用水吸收i中混合气体,可得Se固体。
①请写出
 与浓
与浓 反应的化学方程式
反应的化学方程式②焙烧过程产生的烟气中含有少量
 ,可用
,可用 溶液吸收,二者反应生成一种盐,该盐的化学式为
溶液吸收,二者反应生成一种盐,该盐的化学式为③写出步骤ii中的化学方程式
您最近一年使用:0次
名校
解题方法
10 . 常温下,有四种溶液:
①0.1 mol·L-1 CH3COOH溶液 ②0.1 mol·L-1 CH3COONa溶液 ③0.1 mol·L-1 NaHSO3溶液④0.1 mol·L-1 NaHCO3溶液
(1)溶液①的pH____ (填“>”“<”或“=”)7,溶液中离子的电荷守恒关系式是___ 。
(2)溶液②呈______ (填“酸”“碱”或“中”)性。其原因是___ (用离子方程式说明)。
(3)下列有关①和②两种溶液的说法正确的是____ (填字母)。
a. 两种溶液中c(CH3COO-) 都小于0.1 mol·L-1
b. 两种溶液中c(CH3COO-) 都等于0.1 mol·L-1
c. CH3COOH溶液中c(CH3COO-) 小于CH3COONa溶液中c(CH3COO-)
(4)NaHCO3溶液的pH>7,NaHSO3溶液的pH<7,则,NaHCO3溶液中c(H2CO3)______ (填“>”“<”或“=”,下同)c( ),NaHSO3溶液中c(H2SO3)
),NaHSO3溶液中c(H2SO3)____ c( )
)
①0.1 mol·L-1 CH3COOH溶液 ②0.1 mol·L-1 CH3COONa溶液 ③0.1 mol·L-1 NaHSO3溶液④0.1 mol·L-1 NaHCO3溶液
(1)溶液①的pH
(2)溶液②呈
(3)下列有关①和②两种溶液的说法正确的是
a. 两种溶液中c(CH3COO-) 都小于0.1 mol·L-1
b. 两种溶液中c(CH3COO-) 都等于0.1 mol·L-1
c. CH3COOH溶液中c(CH3COO-) 小于CH3COONa溶液中c(CH3COO-)
(4)NaHCO3溶液的pH>7,NaHSO3溶液的pH<7,则,NaHCO3溶液中c(H2CO3)
 ),NaHSO3溶液中c(H2SO3)
),NaHSO3溶液中c(H2SO3) )
)
您最近一年使用:0次
2022-12-05更新
|
581次组卷
|
9卷引用:江苏省海安市2020-2021学年高二上学期期中考试化学试题
江苏省海安市2020-2021学年高二上学期期中考试化学试题(已下线)第03章 水溶液中的离子反应与平衡(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)云南省通海县一中2020-2021学年高二下学期期中考试化学试题(已下线)第3章 水溶液中的离子反应与平衡(基础过关卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)【石家庄新东方】2021-2022石家庄23中高二10月月考化学试题辽宁省朝阳市建平县高级中学2021-2022学年高二上学期第二次月考化学试题广东省广州市第八十六中学2022-2023学年高二上学期期中考试化学试题(已下线)专题突破卷09 水溶液中的离子反应与平衡 ?-2024年高考化学一轮复习考点通关卷(新教材新高考)黑龙江省哈尔滨市宾县第二中学2022-2023学年高二上学期期中考试化学试题



