1 . 丙烯(分子式为C3H6)是重要的有机化工原料,丙烷(分子式为C3H8)脱氢制丙烯具有显著的经济价值和社会意义。
(1)已知:Ⅰ.2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g) △H=-238kJ·mol-1
Ⅱ.2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
则丙烷脱氢制丙烯反应C3H8(g) C3H6(g)+H2(g)的正反应的活化能为akJ·mol-1,则该反应的逆反应的活化能为
C3H6(g)+H2(g)的正反应的活化能为akJ·mol-1,则该反应的逆反应的活化能为_______ kJ·mol-1(用带有a的代数式表示)。
(2)一定温度下,向恒容密闭容器中充入2molC3H8,发生丙烷脱氢制丙烯反应,容器内起始压强为2×10-5Pa。
①欲提高丙烷转化率,采取的措施是_______ (填标号)。
A.升高温度 B.再充入1molC3H8 C.加催化剂 D.及时分离出H2
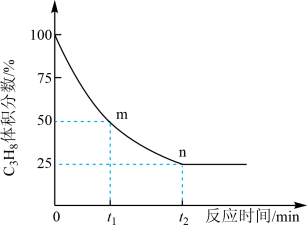
②丙烷脱氢制丙烯反应过程中,C3H8的气体体积分数与反应时间的关系如图所示_______ Pa(Kp是用反应体系中气体物质的分压表示的平衡常数,平衡分压=总压×物质的量分数)。
(3)若在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氢反应,起始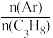 越大,丙烷的平衡转化率越大,其原因是
越大,丙烷的平衡转化率越大,其原因是_______ 。
(4)以丙烷(C3H8)为燃料制作新型燃料电池,电解质是熔融碳酸盐。则电池负极的电极反应式为_______ 。
(1)已知:Ⅰ.2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g) △H=-238kJ·mol-1
Ⅱ.2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
则丙烷脱氢制丙烯反应C3H8(g)
 C3H6(g)+H2(g)的正反应的活化能为akJ·mol-1,则该反应的逆反应的活化能为
C3H6(g)+H2(g)的正反应的活化能为akJ·mol-1,则该反应的逆反应的活化能为(2)一定温度下,向恒容密闭容器中充入2molC3H8,发生丙烷脱氢制丙烯反应,容器内起始压强为2×10-5Pa。
①欲提高丙烷转化率,采取的措施是
A.升高温度 B.再充入1molC3H8 C.加催化剂 D.及时分离出H2
②丙烷脱氢制丙烯反应过程中,C3H8的气体体积分数与反应时间的关系如图所示
(3)若在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氢反应,起始
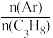 越大,丙烷的平衡转化率越大,其原因是
越大,丙烷的平衡转化率越大,其原因是(4)以丙烷(C3H8)为燃料制作新型燃料电池,电解质是熔融碳酸盐。则电池负极的电极反应式为
您最近一年使用:0次
解题方法
2 . 回答下列问题
(1)对于在一个密闭容器中进行的反应 C(s)+H2O(g) = CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是___________ 。
①增加C的量;②增加CO的量;③将容器的体积缩小一半; ④保持体积不变,充入 He以增大压强;⑤升高反应体系的温度; ⑥保持压强不变,充入 He 以增大体积。
(2)新型纳米材料氧缺位高铁酸盐( )能将烟气中
)能将烟气中 除去,原理如图所示。该过程中转化的
除去,原理如图所示。该过程中转化的 和消耗的
和消耗的 体积比为
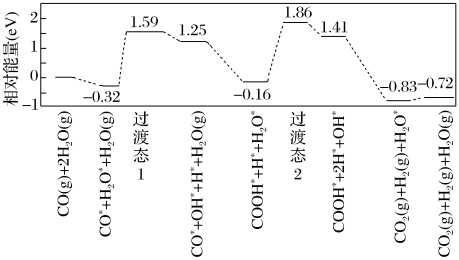
体积比为___________ 。___________ 0(填“大于”“等于”或“小于”)。该历程中最大能垒(活化能)E正=___________ eV,写出该步骤的化学方程式___________ 。
(1)对于在一个密闭容器中进行的反应 C(s)+H2O(g) = CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是
①增加C的量;②增加CO的量;③将容器的体积缩小一半; ④保持体积不变,充入 He以增大压强;⑤升高反应体系的温度; ⑥保持压强不变,充入 He 以增大体积。
(2)新型纳米材料氧缺位高铁酸盐(
 )能将烟气中
)能将烟气中 除去,原理如图所示。该过程中转化的
除去,原理如图所示。该过程中转化的 和消耗的
和消耗的 体积比为
体积比为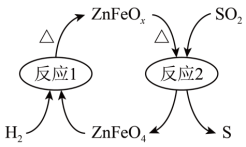
您最近一年使用:0次
解题方法
3 . 回答下列问题
(1)下列反应是氧化还原反应且是吸热反应的是___________ 。
A.稀醋酸与烧碱溶液的反应
B.灼热的炭与CO2的反应
C.铁片与稀盐酸反应
D.Ba(OH)2•8H2O与NH4Cl反应
E.干冰汽化
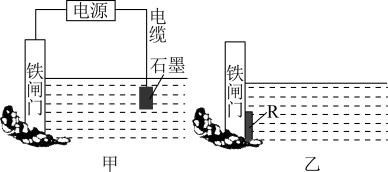
(2)实际生产生活中,钢铁等金属因电化学腐蚀损失巨大,而电化学在金属制备和加工中也发挥着重要的作用。生活中钢铁腐蚀以吸氧腐蚀为主,该腐蚀过程中正极的电极反应式为___________ 。金属的两种常见电化学防护方法如下图所示,图甲中铁闸门连接电源的___________ (填“正极”或“负极”),图乙所示金属的防护方法称为___________ 。
(1)下列反应是氧化还原反应且是吸热反应的是
A.稀醋酸与烧碱溶液的反应
B.灼热的炭与CO2的反应
C.铁片与稀盐酸反应
D.Ba(OH)2•8H2O与NH4Cl反应
E.干冰汽化
(2)实际生产生活中,钢铁等金属因电化学腐蚀损失巨大,而电化学在金属制备和加工中也发挥着重要的作用。生活中钢铁腐蚀以吸氧腐蚀为主,该腐蚀过程中正极的电极反应式为
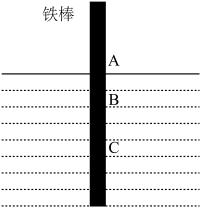
| A.铁棒AB段发生的反应为O2+2H2O+4e-=4OH- |
| B.腐蚀过程中在铁棒上会产生微电流,且方向是从BC段到AB段 |
| C.向水中加入一定量硫酸钾固体后,对铁棒的生锈速率几乎无影响 |
| D.产生这种现象的本质是铁棒所处的化学环境不同 |
您最近一年使用:0次
解题方法
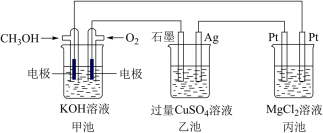
4 . 如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,完成下列问题:___________ 。
(2)写出乙池石墨电极的名称为___________ (填“正极”“负极”或“阴极”“阳极”)。写出乙池中电解总反应的化学方程式:___________ 。
(3)甲池中消耗224 mL(标准状况下)O2,此时丙池中理论上最多产生___________ g沉淀,此时乙池中溶液的体积为400 mL,该溶液的pH=___________ 。
(4)若丙中电极不变,将其溶液换成NaOH溶液,开关闭合一段时间后,甲中溶液的pH将___________ (填“增大”“减小”或“不变”,下同),丙中溶液的pH将___________ 。
(5)某同学利用甲醇燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图)。若用于制漂白液,a为电池的___________ 极,电解质溶液最好用___________ 。若用于制Fe(OH)2,使用硫酸钠溶液作电解质溶液,阳极选用___________ 作电极。阳极反应的电极方程式为___________ 。
(2)写出乙池石墨电极的名称为
(3)甲池中消耗224 mL(标准状况下)O2,此时丙池中理论上最多产生
(4)若丙中电极不变,将其溶液换成NaOH溶液,开关闭合一段时间后,甲中溶液的pH将
(5)某同学利用甲醇燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图)。若用于制漂白液,a为电池的

您最近一年使用:0次
名校
5 . 室温下6种稀溶液:①HCl、② 、③
、③ 、④
、④ 、⑤氨水、⑥NaOH;回答下列问题:
、⑤氨水、⑥NaOH;回答下列问题:
(1)中和等体积、pH相同的①②③溶液消耗NaOH最多的是______ (用序号填写)
(2)将等体积、等物质的量浓度的③、⑥混合,则溶液的pH______ 7(填“>”、“<”或“=”)。
(3)常温下,aL pH=13的⑥溶液与bLpH=2的②溶液混合所得混合溶液pH=12(混合过程中溶液体积变化忽略不计),则a∶b=______ 。
(4)已知:HClO的 ;
; 的
的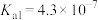 ,
, 。写出向NaClO溶液中通入少量
。写出向NaClO溶液中通入少量 时发生反应的离子方程式:
时发生反应的离子方程式:______ 。
(5)盐碱地(含较多 、NaCl)不利于植物生长,已知
、NaCl)不利于植物生长,已知 的
的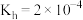 ,当
,当 溶液中
溶液中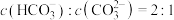 时,溶液的
时,溶液的
______ 。
 、③
、③ 、④
、④ 、⑤氨水、⑥NaOH;回答下列问题:
、⑤氨水、⑥NaOH;回答下列问题:(1)中和等体积、pH相同的①②③溶液消耗NaOH最多的是
(2)将等体积、等物质的量浓度的③、⑥混合,则溶液的pH
(3)常温下,aL pH=13的⑥溶液与bLpH=2的②溶液混合所得混合溶液pH=12(混合过程中溶液体积变化忽略不计),则a∶b=
(4)已知:HClO的
 ;
; 的
的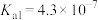 ,
, 。写出向NaClO溶液中通入少量
。写出向NaClO溶液中通入少量 时发生反应的离子方程式:
时发生反应的离子方程式:(5)盐碱地(含较多
 、NaCl)不利于植物生长,已知
、NaCl)不利于植物生长,已知 的
的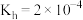 ,当
,当 溶液中
溶液中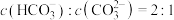 时,溶液的
时,溶液的
您最近一年使用:0次
6 . 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。请填写下列空白:
(1)某学生的操作步骤如下:
A.移取20.00mL待测溶液注入洁净的锥形瓶中,并加入2~3滴酚酞试液。
B.用标准溶液润洗滴定管2~3次。
C.调节滴定管旋塞使尖嘴充满溶液,把盛有标准溶液的酸式滴定管固定好。
D.取标准盐酸溶液注入酸式滴定管至零刻度以上2~3cm。
E.调节液面至零刻度(或以下),记下读数V1。
F.用标准溶液滴定至终点,记下滴定管液面的刻度V2。
请写出操作步骤的正确顺序___________ 。
→___________→___________→___________→A→F。
(2)滴定终点的判断方法:___________ 。
(3)滴定结束时,酸式滴定管中的液面如图所示,则读数为___________ mL。
(5)某学生根据三次实验分别记录有关数据如表:
请选用其中合理数据求出该氢氧化钠溶液物质的量浓度:c(NaOH)=___________ mol/L。(计算结果保留4位有效数字)
(6)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是___________(填字母)。
(1)某学生的操作步骤如下:
A.移取20.00mL待测溶液注入洁净的锥形瓶中,并加入2~3滴酚酞试液。
B.用标准溶液润洗滴定管2~3次。
C.调节滴定管旋塞使尖嘴充满溶液,把盛有标准溶液的酸式滴定管固定好。
D.取标准盐酸溶液注入酸式滴定管至零刻度以上2~3cm。
E.调节液面至零刻度(或以下),记下读数V1。
F.用标准溶液滴定至终点,记下滴定管液面的刻度V2。
请写出操作步骤的正确顺序
→___________→___________→___________→A→F。
(2)滴定终点的判断方法:
(3)滴定结束时,酸式滴定管中的液面如图所示,则读数为

A. | B.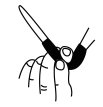 | C. | D. |
(5)某学生根据三次实验分别记录有关数据如表:
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积 | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(6)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是___________(填字母)。
| A.中和滴定到达终点时俯视滴定管内液面读数 |
| B.碱式滴定管用蒸馏水洗净后立即取用25.00mL待测碱溶液注入锥形瓶进行滴定 |
| C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定 |
| D.锥形瓶用待测液润洗 |
您最近一年使用:0次
名校
7 . I、按要求写出下列方程式:
(1)FeCl3水解的离子方程式:___________ 。
(2)NaHCO3水解的离子方程式:___________ 。
(3)NH3•H2O的电离方程式:___________ 。
(4)Mg(OH)2在水中的沉淀溶解平衡用离子方程式表示:___________ 。
Ⅱ、回答下列问题。
(5)25℃时,0.01mol/L的NaOH溶液的pH=___________ ;由水电离出c(H+)=___________ mol/L。
(6)25℃时,将10mLpH=2醋酸溶液稀释到1000mL后溶液的pH___________ 4(填“大于”“小于”或“等于”)。
(7)某温度时,Ksp[AgI]=9.0×10-16,求AgI饱和溶液中c(Ag+)=___________ mol/L
(1)FeCl3水解的离子方程式:
(2)NaHCO3水解的离子方程式:
(3)NH3•H2O的电离方程式:
(4)Mg(OH)2在水中的沉淀溶解平衡用离子方程式表示:
Ⅱ、回答下列问题。
(5)25℃时,0.01mol/L的NaOH溶液的pH=
(6)25℃时,将10mLpH=2醋酸溶液稀释到1000mL后溶液的pH
(7)某温度时,Ksp[AgI]=9.0×10-16,求AgI饱和溶液中c(Ag+)=
您最近一年使用:0次
8 . 在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是___________ (用字母表示,下同)。
(2)同体积、同物质的量浓度的三种酸,中和NaOH 的能力由大到小的顺序是___________ 。
(3)若三者pH相同时,物质的量浓度由大到小的顺序是___________ 。
(4)将pH相同且体积也相同的三种酸,分别与等浓度的NaOH稀溶液反应至pH=7,则消耗NaOH溶液的体积大小关系为___________ 。
(5)将pH相同的三种酸均加水稀释至原来的100倍后,pH由大到小的顺序是___________ 。
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是
(2)同体积、同物质的量浓度的三种酸,中和NaOH 的能力由大到小的顺序是
(3)若三者pH相同时,物质的量浓度由大到小的顺序是
(4)将pH相同且体积也相同的三种酸,分别与等浓度的NaOH稀溶液反应至pH=7,则消耗NaOH溶液的体积大小关系为
(5)将pH相同的三种酸均加水稀释至原来的100倍后,pH由大到小的顺序是
您最近一年使用:0次
解题方法
9 . 室温下,向V mL c mol/L的NaOH溶液中通入 气体,pH与通入气体的关系如图所示(设反应过程中溶液体积不变)
气体,pH与通入气体的关系如图所示(设反应过程中溶液体积不变)_______ 。
(2)通入 的过程中,下列哪个关于a、b、c三点水的电离程度排列顺序是正确的_______。
的过程中,下列哪个关于a、b、c三点水的电离程度排列顺序是正确的_______。
 气体,pH与通入气体的关系如图所示(设反应过程中溶液体积不变)
气体,pH与通入气体的关系如图所示(设反应过程中溶液体积不变)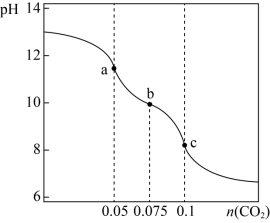
(2)通入
 的过程中,下列哪个关于a、b、c三点水的电离程度排列顺序是正确的_______。
的过程中,下列哪个关于a、b、c三点水的电离程度排列顺序是正确的_______。| A.a>b>c | B.c>b>a | C.a>c>b | D.b>c>a |
您最近一年使用:0次
解题方法
10 . NO2、O2和熔融KNO3可作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物Y。
(2)写出此燃料电池的负极电极反应式_______ ,从绿色化学角度评价此燃料电池的应用前景_______ 。
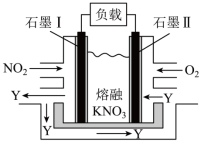
| A.石墨Ⅱ为阳极 |
| B.NO2在原电池中为氧化剂 |
| C.Y物质可循环使用 |
| D.电池总反应式为4NO2+O2=2N2O5 |
您最近一年使用:0次



