1797年,法国化学家Vauquelin发现了一种新元素。由于包含这种元素的矿物呈现出多种颜色,因此称之为Chromium,元素符号为Cr。一些含Cr元素的物质或微粒的性质如表。
(1)取少量Cr(OH)3于试管中,逐滴加入稀硫酸,直至过量,可观察到的现象为___________ 。
(2)请结合平衡移动原理,解释(1)中现象___________ 。
(3)将Cr(OH)3加热可得到Cr2O3固体,将稍过量的Cr2O3固体与Na2CO3固体混合均匀,在空气中高温煅烧,可得到黄色的Na2CrO4固体,请写出该反应的化学方程式___________ 。
(4)Na2CrO4部分水合物溶解度如图1。
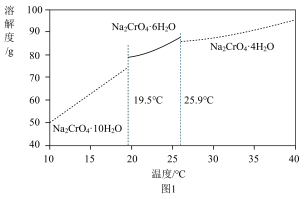
将(3)中所得固体溶解于水中,过滤,得到Na2CrO4溶液。从该溶液中获得Na2CrO4•6H2O的方法为___________ 。
(5)向0.1mol/LNa2CrO4溶液滴加浓硫酸(忽略溶液体积变化),不同pH下,溶液中含+6价Cr元素的微粒浓度变化如图2所示。
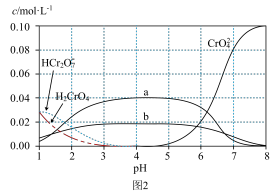
①a代表的微粒是___________ 。
②溶液由pH4.5向pH3.5转化过程中,溶液颜色几乎不变,请结合化学用语解释其原因_______ 。
| 物质 | Cr(OH)3 | H2CrO4 | H2Cr2O7 | |||||
| 性质 | 灰蓝色固体,难溶于水两性氢氧化物 | 红色固体,水溶液为黄色中强酸 | 无纯净物,只存在于水溶液中,强酸 | |||||
| 微粒 | Cr3+ | Cr(OH) |  、HCrO 、HCrO |  、HCr2O 、HCr2O | ||||
| 颜色 | 蓝紫色 | 绿色 | 黄色 | 橙红色 | ||||
(1)取少量Cr(OH)3于试管中,逐滴加入稀硫酸,直至过量,可观察到的现象为
(2)请结合平衡移动原理,解释(1)中现象
(3)将Cr(OH)3加热可得到Cr2O3固体,将稍过量的Cr2O3固体与Na2CO3固体混合均匀,在空气中高温煅烧,可得到黄色的Na2CrO4固体,请写出该反应的化学方程式
(4)Na2CrO4部分水合物溶解度如图1。

将(3)中所得固体溶解于水中,过滤,得到Na2CrO4溶液。从该溶液中获得Na2CrO4•6H2O的方法为
(5)向0.1mol/LNa2CrO4溶液滴加浓硫酸(忽略溶液体积变化),不同pH下,溶液中含+6价Cr元素的微粒浓度变化如图2所示。

①a代表的微粒是
②溶液由pH4.5向pH3.5转化过程中,溶液颜色几乎不变,请结合化学用语解释其原因
更新时间:2023-05-15 16:22:54
|
相似题推荐
【推荐1】研究烟气脱硝脱硫是环境保护、促进社会可持续发展的重要课题。
(1)活性炭催化脱除SO2的机理如图所示(*代表吸附态),写出“热再生”生成SO2的化学方程式_______ 。

(2)V2O5/炭基材料是在活性炭上载有V2O5活性成分,构成更高活性的活性炭催化剂,更有利于SO2转化为SO3,最终实现脱硫。
①通过红外光谱发现,脱硫开始后催化剂表面出现了VOSO4的吸收峰,再通入O2后VOSO4吸收峰消失,后一步用化学方程式表示为_______ 。
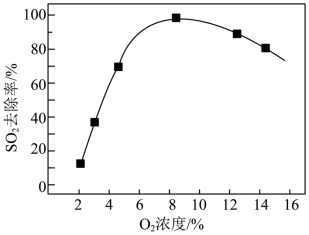
②控制一定气体流速和温度,考察烟气中O2的存在对V2O5/炭基材料催化剂脱硫活性的影响,结果如图所示,当O2浓度过高时,去除率下降,其原因可能是_______ 。
(1)活性炭催化脱除SO2的机理如图所示(*代表吸附态),写出“热再生”生成SO2的化学方程式

(2)V2O5/炭基材料是在活性炭上载有V2O5活性成分,构成更高活性的活性炭催化剂,更有利于SO2转化为SO3,最终实现脱硫。
①通过红外光谱发现,脱硫开始后催化剂表面出现了VOSO4的吸收峰,再通入O2后VOSO4吸收峰消失,后一步用化学方程式表示为
②控制一定气体流速和温度,考察烟气中O2的存在对V2O5/炭基材料催化剂脱硫活性的影响,结果如图所示,当O2浓度过高时,去除率下降,其原因可能是

您最近半年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】铁是人类较早使用的金属之一、运用铁及其化合物的知识,完成下列问题。
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式_______ 。
(2)公元8世纪左右,我国炼丹士开始将硫酸亚铁加热到500℃左右,生成氧化铁和硫的氧化物,反应的化学方程式是_______ 。此法是最早生产硫酸的关键反应,当时若有m kg硫酸亚铁可生成_______ kg50%的硫酸(填写计算表达式)。
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。高铁酸钠生产方法之一是电解法,其原理为aFe+bNaOH+cH2O dNa2FeO4+eH2;该反应中若a=1,则e=
dNa2FeO4+eH2;该反应中若a=1,则e=_______ 。
(4)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。
、Cl-、H2O。
①在碱性条件下,湿法生产高铁酸钾的离子反应方程式是_______ 。
②若反应过程中转移了0.3 mol电子,则还原产物的物质的量为_______ mol。
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式
(2)公元8世纪左右,我国炼丹士开始将硫酸亚铁加热到500℃左右,生成氧化铁和硫的氧化物,反应的化学方程式是
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。高铁酸钠生产方法之一是电解法,其原理为aFe+bNaOH+cH2O
 dNa2FeO4+eH2;该反应中若a=1,则e=
dNa2FeO4+eH2;该反应中若a=1,则e=(4)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。
、Cl-、H2O。①在碱性条件下,湿法生产高铁酸钾的离子反应方程式是
②若反应过程中转移了0.3 mol电子,则还原产物的物质的量为
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】(1)实验室中常用加热分解氯酸钾制取氧气,写出反应的化学方程式,并用双线桥法仅标出电子转移情况___________________________________________________________ 。
(2))实验室制取Cl2的反应方程式之一为:
___ KMnO4 + ____ HCl —— ____ KCl +____ MnCl2 + ___ C12↑ + ___ H2O
请①配平方程式;②用单线桥法仅标出电子转移情况_________ ;
③浓盐酸表现出来的性质是:_______________ ;
④当有5摩HCl被氧化时,求产生的氯气在标准状况下的体积:___________ 。
(3)KClO3+6HCl===KCl+3Cl2↑+3H2O写出氧化产物还原产物物质的量的比为_________ ,当氧化产物比还原产物多71克时,参加反应的还原剂为________ 摩。
(2))实验室制取Cl2的反应方程式之一为:
请①配平方程式;②用单线桥法仅标出电子转移情况
③浓盐酸表现出来的性质是:
④当有5摩HCl被氧化时,求产生的氯气在标准状况下的体积:
(3)KClO3+6HCl===KCl+3Cl2↑+3H2O写出氧化产物还原产物物质的量的比为
您最近半年使用:0次
【推荐1】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+NOCl(g) K1 ΔH1<0 (Ⅰ)
NaNO3(s)+NOCl(g) K1 ΔH1<0 (Ⅰ)
2NO(g)+Cl2(g) 2NOCl(g) K2 ΔH2<0 (Ⅱ)
2NOCl(g) K2 ΔH2<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________ (用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应(Ⅱ)达到平衡。测得10 min内v(NOCl)=7.5×10-3 mol·L-1·min-1,则平衡后n(Cl2)=________ mol,NO的转化率α1=________ 。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2________ α1(填“>”“<”或“=”),平衡常数K2________ (填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是____________ 。
2NO2(g)+NaCl(s)
 NaNO3(s)+NOCl(g) K1 ΔH1<0 (Ⅰ)
NaNO3(s)+NOCl(g) K1 ΔH1<0 (Ⅰ)2NO(g)+Cl2(g)
 2NOCl(g) K2 ΔH2<0 (Ⅱ)
2NOCl(g) K2 ΔH2<0 (Ⅱ)(1)4NO2(g)+2NaCl(s)
 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应(Ⅱ)达到平衡。测得10 min内v(NOCl)=7.5×10-3 mol·L-1·min-1,则平衡后n(Cl2)=
您最近半年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】已知反应mA(g)+nB(g)⇌pC(g)+qD(g),当反应达到平衡后,改变压强,其反应速率的变化曲线分别如图所示。
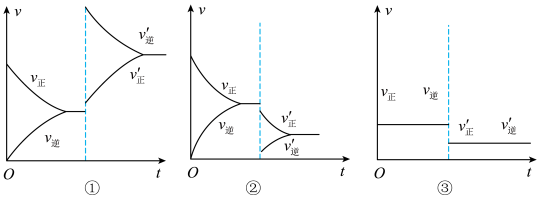
回答下列问题:
(1)①表示改变压强的方式是________ (填“增大”或“减小”,下同)压强,化学平衡________ (填“正向”“逆向”或“不”,下同)移动,m+n__________ (填“>”“<”或“=”,下同)p+q。
(2)②表示改变压强的方式是___________ 压强,化学平衡___________ 移动,m+n___________ p+q。
(3)③表示改变压强的方式是___________ 压强,化学平衡___________ 移动,m+n___________ p+q。

回答下列问题:
(1)①表示改变压强的方式是
(2)②表示改变压强的方式是
(3)③表示改变压强的方式是
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示,回答下列问题:

(1)CrO42-和Cr2O72-在溶液中相互转化的离子方程式___ 。
(2)由图可知,随着溶液酸性增强,CrO42-的平衡转化率__ (填“增大“减小”或“不变”)。根据A(1.0,0.25)点数据,计算出该转化反应的平衡常数为__ 。
(3)升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH__ 0(填“大于”“小于”或“等于”)。

(1)CrO42-和Cr2O72-在溶液中相互转化的离子方程式
(2)由图可知,随着溶液酸性增强,CrO42-的平衡转化率
(3)升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH
您最近半年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】物质在水中可能存在电离平衡、盐的水解平衡等,它们都可看作化学平衡。请根据所学的知识回答:
(1)A为0.1mol•L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为___________ 。
(2)B为0.1 mol•L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(分别用离子方程式表示):___________ ;实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:___________ 。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入______ ,目的是___________ ;将B和C溶液混合后,反应的离子方程式为___________ 。
(1)A为0.1mol•L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为
(2)B为0.1 mol•L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(分别用离子方程式表示):
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】回答下列问题
(1)向0.1mol·L-1的氨水中加入少量的明矾,溶液中的 的浓度
的浓度___________ 。
(2)25℃,在0.10 H2S溶液中,通入HCI气体或加入
H2S溶液中,通入HCI气体或加入 固体以调节溶液pH,溶液pH与c(S2)关系如图(忽略溶液体积的变化、H2S的挥发)。
固体以调节溶液pH,溶液pH与c(S2)关系如图(忽略溶液体积的变化、H2S的挥发)。
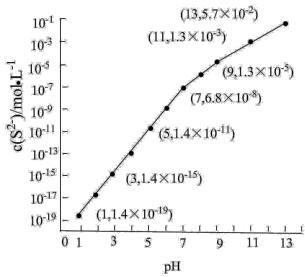
①pH=13时,溶液中的c(H2S)+c(HS-)=___________  。
。
②某溶液含0.020 Mn2+、0.10
Mn2+、0.10 H2S,当溶液pH=
H2S,当溶液pH=___________ 时,Mn2+开始沉淀。[已知: =2.8×10-13]
=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如下表。
①0.10 NaHSO3溶液中粒子浓度由大到小的顺序为
NaHSO3溶液中粒子浓度由大到小的顺序为___________ 。
②向NaHCO3溶液中通入少量二氧化硫时反应的离子方程式___________ 。
(1)向0.1mol·L-1的氨水中加入少量的明矾,溶液中的
 的浓度
的浓度(2)25℃,在0.10
 H2S溶液中,通入HCI气体或加入
H2S溶液中,通入HCI气体或加入 固体以调节溶液pH,溶液pH与c(S2)关系如图(忽略溶液体积的变化、H2S的挥发)。
固体以调节溶液pH,溶液pH与c(S2)关系如图(忽略溶液体积的变化、H2S的挥发)。
①pH=13时,溶液中的c(H2S)+c(HS-)=
 。
。②某溶液含0.020
 Mn2+、0.10
Mn2+、0.10 H2S,当溶液pH=
H2S,当溶液pH= =2.8×10-13]
=2.8×10-13](3)25℃,两种酸的电离平衡常数如下表。
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
 NaHSO3溶液中粒子浓度由大到小的顺序为
NaHSO3溶液中粒子浓度由大到小的顺序为②向NaHCO3溶液中通入少量二氧化硫时反应的离子方程式
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】水的电离平衡曲线如图所示。

(1)若以A点表示25 ℃时水在电离平衡时的离子浓度,当温度升到100 ℃时,水的电离平衡状态到B点,则100 ℃时,水的离子积为______________ 。
(2)常温下,将pH=10的Ba(OH)2溶液与pH=5的稀盐酸混合,然后保持100 ℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为_______________________ 。
(3)25 ℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为_________________________ ,由水电离出的c(OH-)=_______________ mol·L-1。
(4)等体积的下列溶液中,阴离子的总物质的量最大的是_____________ (填序号)。
①0.1 mol·L-1的CuSO4溶液 ②0.1 mol·L-1的Na2CO3
③0.1 mol·L-1的KCl ④0.1 mol·L-1的NaHCO3
(5)某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A===H++HA-,HA-⇌H++A2-。
①则Na2A溶液显__________ (填“酸性”“中性”或“碱性”);NaHA溶液显__________ (填“酸性”“中性”或“碱性”)。
②现有0.1 mol·L-1 Na2A的溶液,其中各种微粒浓度关系正确的是__________ (填字母)。
A.c(Na+)>c(A2-)>c(OH-)>c(HA-)
B.c(Na+)=2c(HA-)+2c((A2-)+2c(H2A)
C.c(Na+)+c(H+)=c(HA-)+c(A2-)+c(OH-)
D.c(OH-)=c(HA-)+c(H+)

(1)若以A点表示25 ℃时水在电离平衡时的离子浓度,当温度升到100 ℃时,水的电离平衡状态到B点,则100 ℃时,水的离子积为
(2)常温下,将pH=10的Ba(OH)2溶液与pH=5的稀盐酸混合,然后保持100 ℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为
(3)25 ℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为
(4)等体积的下列溶液中,阴离子的总物质的量最大的是
①0.1 mol·L-1的CuSO4溶液 ②0.1 mol·L-1的Na2CO3
③0.1 mol·L-1的KCl ④0.1 mol·L-1的NaHCO3
(5)某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A===H++HA-,HA-⇌H++A2-。
①则Na2A溶液显
②现有0.1 mol·L-1 Na2A的溶液,其中各种微粒浓度关系正确的是
A.c(Na+)>c(A2-)>c(OH-)>c(HA-)
B.c(Na+)=2c(HA-)+2c((A2-)+2c(H2A)
C.c(Na+)+c(H+)=c(HA-)+c(A2-)+c(OH-)
D.c(OH-)=c(HA-)+c(H+)
您最近半年使用:0次



