名校
解题方法
1 . 叠氮化钠( )不溶于乙醚,微溶于乙醇,易溶于水,常用于汽车安全防护袋的气源,汽车发生剧烈碰撞时,立即自动充气。实验室模拟尿素法制备水合肼(
)不溶于乙醚,微溶于乙醇,易溶于水,常用于汽车安全防护袋的气源,汽车发生剧烈碰撞时,立即自动充气。实验室模拟尿素法制备水合肼( )并利用其进一步反应制取
)并利用其进一步反应制取 的流程如下:
的流程如下:
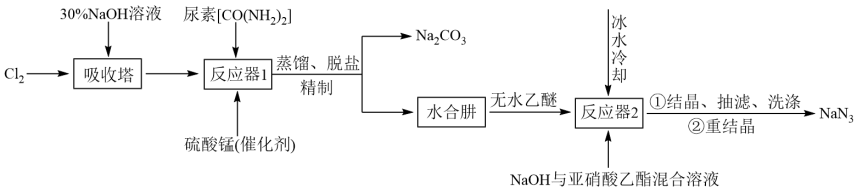
已知:① 易溶于水,具有强还原性,易被氧化成
易溶于水,具有强还原性,易被氧化成 ;
;
②一定条件下,碱性NaClO溶液与尿素溶液反应生成 。
。
回答下列问题:
(1)吸收塔内发生反应的离子方程式为_______ 。
(2)写出反应器1中生成水合肼反应的化学方程式:_______ 。
(3)反应器2中加入无水乙醚的作用是_______ 。
(4)已知亚硝酸乙酯的结构简式为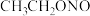 ,写出反应器2中生成
,写出反应器2中生成 和
和 的化学方程式:
的化学方程式:_______ 。若生成39g  ,则该反应中转移电子的物质的量为
,则该反应中转移电子的物质的量为_______ 。
(5)反应器1要控制NaClO溶液的用量,其主要目的是_______ 。
(6)某实验室设计了如图所示装置制备 。双极膜是阴、阳复合膜,层间的
。双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。
并可分别通过阴、阳膜定向移动。
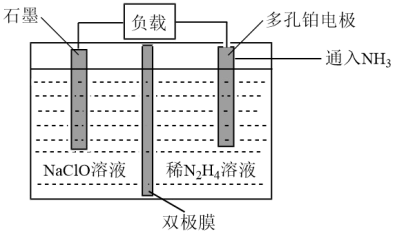
①双极膜中产生的_______ (填“ ”或“
”或“ ”)移向多孔铂电极。
”)移向多孔铂电极。
②石墨电极反应式为_______ 。
 )不溶于乙醚,微溶于乙醇,易溶于水,常用于汽车安全防护袋的气源,汽车发生剧烈碰撞时,立即自动充气。实验室模拟尿素法制备水合肼(
)不溶于乙醚,微溶于乙醇,易溶于水,常用于汽车安全防护袋的气源,汽车发生剧烈碰撞时,立即自动充气。实验室模拟尿素法制备水合肼( )并利用其进一步反应制取
)并利用其进一步反应制取 的流程如下:
的流程如下:
已知:①
 易溶于水,具有强还原性,易被氧化成
易溶于水,具有强还原性,易被氧化成 ;
;②一定条件下,碱性NaClO溶液与尿素溶液反应生成
 。
。回答下列问题:
(1)吸收塔内发生反应的离子方程式为
(2)写出反应器1中生成水合肼反应的化学方程式:
(3)反应器2中加入无水乙醚的作用是
(4)已知亚硝酸乙酯的结构简式为
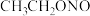 ,写出反应器2中生成
,写出反应器2中生成 和
和 的化学方程式:
的化学方程式: ,则该反应中转移电子的物质的量为
,则该反应中转移电子的物质的量为(5)反应器1要控制NaClO溶液的用量,其主要目的是
(6)某实验室设计了如图所示装置制备
 。双极膜是阴、阳复合膜,层间的
。双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。
并可分别通过阴、阳膜定向移动。
①双极膜中产生的
 ”或“
”或“ ”)移向多孔铂电极。
”)移向多孔铂电极。②石墨电极反应式为
您最近一年使用:0次
2022-04-16更新
|
580次组卷
|
5卷引用:湖北省九师联盟2022届高三 三模考试化学试题
湖北省九师联盟2022届高三 三模考试化学试题河北省名校联盟2021-2022学年高三下学期4月质量检测化学试题湖南省隆回县第一中学2022届高三下学期第二次模拟考试化学试题(已下线)考点13 钠及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点13 钠及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
2 . 氮在自然界中的转化是一个复杂的过程,氮循环是生态系统物质循环的重要组成部分。
(1)在一定条件下,NH3可用于脱除氮氧化物的烟气,其反应原理为4xNH3+6NOx (2x+3)N2+6xH2O。该反应中的还原剂为
(2x+3)N2+6xH2O。该反应中的还原剂为____ (填化学式)。
(2)氨的催化氧化是制备硝酸的重要过程,实验室按如图所示装置进行氨的催化氧化实验。

实验操作:将浓氨水倒入锥形瓶中,从导气管通入热空气,将红热的铂丝伸入锥形瓶中。
实验现象:a.红热的铂丝始终保持红热状态;b.瓶中有红棕色气体生成,瓶内还有白烟生成。回答下列问题:
①铂丝始终保持红热状态的可能原因是____ 。
②通入热空气的作用是____ 。
③请写出氨气的催化氧化反应的化学方程式:____ 。
④红棕色气体的化学式为____ ,此气体可用NaOH溶液吸收,有NaNO2和NaNO3生成,写出该反应的离子方程式:____ 。
(3)氨是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用。高浓度的氨氮废水是造成河流及湖泊富营养化的主要因素,研究表明在微生物作用下,可实现NH →NO
→NO 的转化。写出在碱性条件下,NH
的转化。写出在碱性条件下,NH 被氧气氧化为NO
被氧气氧化为NO 的反应的离子方程式:
的反应的离子方程式:____ 。每生成1molNO ,转移的电子的物质的量为
,转移的电子的物质的量为____ mol。再往含NO 的废水中加入甲醇,可将NO
的废水中加入甲醇,可将NO 转化为N2,实现废水的无害化处理。
转化为N2,实现废水的无害化处理。
(1)在一定条件下,NH3可用于脱除氮氧化物的烟气,其反应原理为4xNH3+6NOx
 (2x+3)N2+6xH2O。该反应中的还原剂为
(2x+3)N2+6xH2O。该反应中的还原剂为(2)氨的催化氧化是制备硝酸的重要过程,实验室按如图所示装置进行氨的催化氧化实验。

实验操作:将浓氨水倒入锥形瓶中,从导气管通入热空气,将红热的铂丝伸入锥形瓶中。
实验现象:a.红热的铂丝始终保持红热状态;b.瓶中有红棕色气体生成,瓶内还有白烟生成。回答下列问题:
①铂丝始终保持红热状态的可能原因是
②通入热空气的作用是
③请写出氨气的催化氧化反应的化学方程式:
④红棕色气体的化学式为
(3)氨是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用。高浓度的氨氮废水是造成河流及湖泊富营养化的主要因素,研究表明在微生物作用下,可实现NH
 →NO
→NO 的转化。写出在碱性条件下,NH
的转化。写出在碱性条件下,NH 被氧气氧化为NO
被氧气氧化为NO 的反应的离子方程式:
的反应的离子方程式: ,转移的电子的物质的量为
,转移的电子的物质的量为 的废水中加入甲醇,可将NO
的废水中加入甲醇,可将NO 转化为N2,实现废水的无害化处理。
转化为N2,实现废水的无害化处理。
您最近一年使用:0次
2022-03-23更新
|
222次组卷
|
3卷引用:湖北省部分学校2021-2022学年高一下学期3月联考化学试题
名校
3 . 认识氧化物的性质,能帮助我们更好地认识自然和保护环境。
(1)摩擦剂是牙膏的主体成分,SiO2是一种常见的摩擦剂。
①Si在元素周期表中的位置是____ 。
②根据用途推测SiO2在水中的溶解性:____ (填“易溶”或“难溶”)。
③比较酸性强弱:H2SO4____ (填“>”或“<”)H2SiO3。
(2)SO2和NO2的任意排放均会污染环境。
①从物质分类角度看,SO2属于酸性氧化物,能与NaOH溶液反应生成亚硫酸盐。写出SO2与过量的NaOH溶液反应的离子方程式:____ 。
②从元素价态看,SO2中S元素为+4价,既具有氧化性,又具有还原性。则反应SO2+Br2+2H2O=H2SO4+2HBr中体现了SO2的____ (填“氧化性”或“还原性”)。
③NO2是一种____ 色的有毒气体,易溶于水,与水反应有无色气体生成,写出NO2与水反应的化学方程式:____ ,反应中每生成标准状况下的气体2.24L,则转移电子的物质的量为____ mol。
(1)摩擦剂是牙膏的主体成分,SiO2是一种常见的摩擦剂。
①Si在元素周期表中的位置是
②根据用途推测SiO2在水中的溶解性:
③比较酸性强弱:H2SO4
(2)SO2和NO2的任意排放均会污染环境。
①从物质分类角度看,SO2属于酸性氧化物,能与NaOH溶液反应生成亚硫酸盐。写出SO2与过量的NaOH溶液反应的离子方程式:
②从元素价态看,SO2中S元素为+4价,既具有氧化性,又具有还原性。则反应SO2+Br2+2H2O=H2SO4+2HBr中体现了SO2的
③NO2是一种
您最近一年使用:0次
2022-03-23更新
|
413次组卷
|
4卷引用:湖北省部分学校2021-2022学年高一下学期3月联考化学试题
4 . 我国古代四大发明指的是造纸术、火药、活字印刷术、指南针,这是我国古代劳动人民智慧的结晶,在世界范围内产生了很大的影响,推动了人类文明向前进步。
(1)我国古代造纸工艺在蒸煮原料时需往浆水中加入草木灰(主要成分为K2CO3)或石灰水等碱性溶液,K2CO3既属于钾盐,也属于碳酸盐,该分类方法属于___ ;K2CO3溶液与Ca(OH)2溶液发生反应的离子方程式为____ 。
(2)黑火药爆炸反应为:S+2KNO3+3C=K2S+3CO2↑+N2↑,该反应中氧化剂是___ ,当反应释放出33.6L(标准状况)的N2时,转移电子数目为___ 。
(3)中国北宋毕昇发明的泥活字印刷术比德国人约翰内斯·古腾堡的铅活字印刷术早约400年。活字印刷工艺中用“胶泥刻字”, “火烧令坚”(胶泥即为广义上的黏土)所描写的印刷术陶瓷活字属于____ 材料;铅活字印刷术中用到的铅原子序数是82,其在元素周期表中的位置是___ 。
(4)指南针由天然磁石制成,磁石的主要成分是___ (填化学式),其溶于稀硝酸的化学方程式为___ 。

(1)我国古代造纸工艺在蒸煮原料时需往浆水中加入草木灰(主要成分为K2CO3)或石灰水等碱性溶液,K2CO3既属于钾盐,也属于碳酸盐,该分类方法属于
(2)黑火药爆炸反应为:S+2KNO3+3C=K2S+3CO2↑+N2↑,该反应中氧化剂是
(3)中国北宋毕昇发明的泥活字印刷术比德国人约翰内斯·古腾堡的铅活字印刷术早约400年。活字印刷工艺中用“胶泥刻字”, “火烧令坚”(胶泥即为广义上的黏土)所描写的印刷术陶瓷活字属于
(4)指南针由天然磁石制成,磁石的主要成分是
您最近一年使用:0次
5 . 2021年10月27日14时19分,“新洲”号火箭成功发射,将航天星云常熟一号卫星送入预定轨道!“新洲”号火箭是位于新洲区的武汉国家航天产业基地下线的首批火箭。火箭使用的主要燃料是偏二甲肼( 中氮元素显-2价),火箭发射时,与
中氮元素显-2价),火箭发射时,与 剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为
剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为 ,下列关于此反应的叙述错误的是
,下列关于此反应的叙述错误的是
 中氮元素显-2价),火箭发射时,与
中氮元素显-2价),火箭发射时,与 剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为
剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为 ,下列关于此反应的叙述错误的是
,下列关于此反应的叙述错误的是| A.该反应可在瞬间产生大量高温气体,推动火箭飞行且反应产物对环境无污染 |
B.该反应中 是氧化剂 是氧化剂 |
C. 既是氧化产物也是还原产物 既是氧化产物也是还原产物 |
D.每生成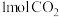 ,该反应转移电子 ,该反应转移电子 |
您最近一年使用:0次
名校
6 . 乙二醇生产工艺中,需使用热的K2CO3溶液(脱碳液)脱除CO2,脱碳液中含有的V2O5能减少溶液对管道的腐蚀。可使用“碘量法”测定脱碳液中V2O5的含量,操作中涉及两个反应如下:①V2O5+6HCl+2KI=2VOCl2+2KCl+I2+3H2O;②I2+2Na2S2O3=2NaI+Na2S4O6。下列说法错误的是
| A.反应①中氧化剂与还原剂物质的量之比为1:2 |
| B.反应①生成1molVOCl2时,反应转移1mol电子 |
| C.V的最高价为+5价,推测V2O5只有氧化性 |
| D.溶液酸性过强时,反应②易发生其他反应 |
您最近一年使用:0次
2022-03-10更新
|
691次组卷
|
5卷引用:湖北省七市(州)2021-2022学年高三下学期3月联合统一调研测试化学试题
湖北省七市(州)2021-2022学年高三下学期3月联合统一调研测试化学试题湖南省永州市第四中学2022届高三下学期期中考试化学试题(已下线)押新高考卷10题 氧化还原反应-备战2022年高考化学临考题号押题(新高考通版)(已下线)专题07 氧化还原反应分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)考点04 氧化还原反应的基本概念和规律(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
7 . 设NA为阿伏加德罗常数的值,下列叙述不正确的是
| A.0.5 mol NH4HSO4晶体中,含有阴、阳离子总数约为NA |
| B.标准状况下,1 mol水煤气的体积约为22.4 L |
| C.0.1 mol Cl2溶于10 L水中,转移的电子数为0.1NA |
| D.某密闭容器中0.1 mol Na2O2和0.1 mol CO2充分反应,转移电子的数目为0.1NA |
您最近一年使用:0次
8 . 饮用水中的 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为N2,其化学方程式为:
还原为N2,其化学方程式为: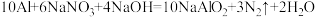 。请回答下列问题:
。请回答下列问题:
(1)上述反应中,被氧化的元素___________ ,还原产物是___________ 。
(2)用“双线桥法”表示反应中电子转移的方向和数目:___________ 。
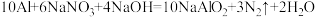
(3)反应中每生成1个N2,转移___________ 个电子。
(4)请配平下列离子方程式___________ 。

(5)已知I-、Fe2+、SO2、Cl-、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为: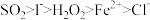 ,则下列反应不能发生的是___________。
,则下列反应不能发生的是___________。
 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为N2,其化学方程式为:
还原为N2,其化学方程式为: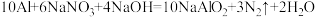 。请回答下列问题:
。请回答下列问题:(1)上述反应中,被氧化的元素
(2)用“双线桥法”表示反应中电子转移的方向和数目:
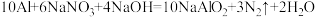
(3)反应中每生成1个N2,转移
(4)请配平下列离子方程式

(5)已知I-、Fe2+、SO2、Cl-、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:
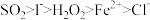 ,则下列反应不能发生的是___________。
,则下列反应不能发生的是___________。A.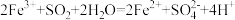 | B.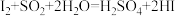 |
C.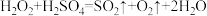 | D.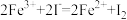 |
您最近一年使用:0次
2022-03-08更新
|
240次组卷
|
4卷引用:湖北省十堰市第二中学2021-2022学年高一上学期期中考试化学试题
名校
9 .  是阿伏加德罗常数的值。下列说法错误的是
是阿伏加德罗常数的值。下列说法错误的是
 是阿伏加德罗常数的值。下列说法错误的是
是阿伏加德罗常数的值。下列说法错误的是A.18g重水 中含有的质子数为 中含有的质子数为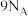 |
B.1mol雄黄(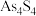 ,结构为 ,结构为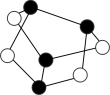 )含有 )含有 个S—S键 个S—S键 |
C.3mol的 与 与 完全反应时转移的电子数为 完全反应时转移的电子数为 |
D.lmol碘蒸气和1mol氢气在密闭容器中充分反应,生成的碘化氢分子数小于 |
您最近一年使用:0次
2022-03-03更新
|
174次组卷
|
2卷引用:湖北省天门中学、仙桃中学2021-2022学年高一下学期2月联考化学试题
解题方法
10 . 下列关于Na2O2的说法中正确的是
| A.用小刀切开一块金属Na,其银白色有光泽的切面很快变暗,这是因为Na被空气中的氧气氧化生成了Na2O2 |
| B.0.1molNa2O2与足量CO2充分反应,转移电子的物质的量为0.2mol |
| C.将Na2O2投入到CuCl2溶液中有蓝色沉淀及气泡产生 |
| D.Na2O2遇到湿润的红色石蕊试纸后,石蕊试纸最终变成蓝色 |
您最近一年使用:0次
2022-03-03更新
|
226次组卷
|
2卷引用:湖北省部分高中联考协作体2021-2022学年高一下学期期中考试化学试题



