名校
解题方法
1 . 请按照要求用对应的化学术语回答下列问题。
(1) 是一种酸式盐,请写出
是一种酸式盐,请写出 在水中的电离方程式
在水中的电离方程式___________ 。
(2)将饱和 溶液滴入到沸水中,继续煮沸至液体变为红褐色,反应的离子方程式为
溶液滴入到沸水中,继续煮沸至液体变为红褐色,反应的离子方程式为___________ 。
(3) 可以作为供氧剂,其与
可以作为供氧剂,其与 反应时若生成标准状况下11.2L
反应时若生成标准状况下11.2L  ,则电子转移数目为
,则电子转移数目为___________ 。
(4) 溶于水可以产生具有漂白性的物质,
溶于水可以产生具有漂白性的物质, 与水反应的离子方程式为:
与水反应的离子方程式为:___________ 。
(5)某温度下将 通入KOH溶液里,反应后得到KCl、KClO、
通入KOH溶液里,反应后得到KCl、KClO、 的混合溶液,其中
的混合溶液,其中 与
与 的个数之比为11∶1,则
的个数之比为11∶1,则 与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为
与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为___________ 。
(6)在标准状况下,将V L氨气溶于0.1L水中,所得溶液的密度为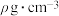 ,则此氨水的物质的量浓度为
,则此氨水的物质的量浓度为___________  。
。
(1)
 是一种酸式盐,请写出
是一种酸式盐,请写出 在水中的电离方程式
在水中的电离方程式(2)将饱和
 溶液滴入到沸水中,继续煮沸至液体变为红褐色,反应的离子方程式为
溶液滴入到沸水中,继续煮沸至液体变为红褐色,反应的离子方程式为(3)
 可以作为供氧剂,其与
可以作为供氧剂,其与 反应时若生成标准状况下11.2L
反应时若生成标准状况下11.2L  ,则电子转移数目为
,则电子转移数目为(4)
 溶于水可以产生具有漂白性的物质,
溶于水可以产生具有漂白性的物质, 与水反应的离子方程式为:
与水反应的离子方程式为:(5)某温度下将
 通入KOH溶液里,反应后得到KCl、KClO、
通入KOH溶液里,反应后得到KCl、KClO、 的混合溶液,其中
的混合溶液,其中 与
与 的个数之比为11∶1,则
的个数之比为11∶1,则 与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为
与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为(6)在标准状况下,将V L氨气溶于0.1L水中,所得溶液的密度为
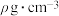 ,则此氨水的物质的量浓度为
,则此氨水的物质的量浓度为 。
。
您最近一年使用:0次
2 . 新冠肺炎期间,化学消毒剂大显身手。高铁酸钾(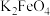 )是一种高效多功能的绿色消毒剂,广泛应用于生活用水和废水的杀菌、消毒。工业制备高铁酸钾的方法主要有湿法和干法两种。实验室模拟湿法制备高铁酸钾的流程如下:
)是一种高效多功能的绿色消毒剂,广泛应用于生活用水和废水的杀菌、消毒。工业制备高铁酸钾的方法主要有湿法和干法两种。实验室模拟湿法制备高铁酸钾的流程如下:
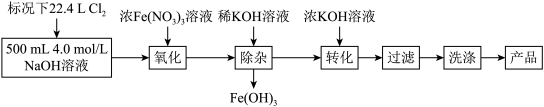
已知:转化过程发生复分解反应。回答下列问题:
(1)NaOH溶液应置于冰水浴中,否则温度升高将发生如下副反应: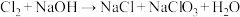 (未配平),请配平该反应
(未配平),请配平该反应_______ 。若有0.15mol 发生该副反应,转移电子的数目为
发生该副反应,转移电子的数目为_______ 。
(2)工业干法制备高铁酸钾的第一步反应为 ,在该反应中还原剂和氧化剂的物质的量之比为
,在该反应中还原剂和氧化剂的物质的量之比为_______ 。
(3)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂。它能消毒杀菌是因为_______ ,它能净水的原因是_______ 。
(4)由以上信息可知:高铁酸钾的溶解度比高铁酸钠_______ (填“大”或“小”)。
(5)某同学查阅资料得知,最初,人们直接用氯气作漂白剂,但使用起来不方便,效果也不理想。经过多年的实验、改进,才有了今天常用的漂白粉。
①你认为“使用起来不方便,效果也不理想”的原因是_______ 。
②科研人员以氯气、石灰石、水为原料制取漂白粉,有关反应的化学方程式是:_______ 。
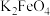 )是一种高效多功能的绿色消毒剂,广泛应用于生活用水和废水的杀菌、消毒。工业制备高铁酸钾的方法主要有湿法和干法两种。实验室模拟湿法制备高铁酸钾的流程如下:
)是一种高效多功能的绿色消毒剂,广泛应用于生活用水和废水的杀菌、消毒。工业制备高铁酸钾的方法主要有湿法和干法两种。实验室模拟湿法制备高铁酸钾的流程如下:
已知:转化过程发生复分解反应。回答下列问题:
(1)NaOH溶液应置于冰水浴中,否则温度升高将发生如下副反应:
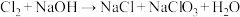 (未配平),请配平该反应
(未配平),请配平该反应 发生该副反应,转移电子的数目为
发生该副反应,转移电子的数目为(2)工业干法制备高铁酸钾的第一步反应为
 ,在该反应中还原剂和氧化剂的物质的量之比为
,在该反应中还原剂和氧化剂的物质的量之比为(3)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂。它能消毒杀菌是因为
(4)由以上信息可知:高铁酸钾的溶解度比高铁酸钠
(5)某同学查阅资料得知,最初,人们直接用氯气作漂白剂,但使用起来不方便,效果也不理想。经过多年的实验、改进,才有了今天常用的漂白粉。
①你认为“使用起来不方便,效果也不理想”的原因是
②科研人员以氯气、石灰石、水为原料制取漂白粉,有关反应的化学方程式是:
您最近一年使用:0次
3 . 饮用水中的 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为N2,其化学方程式为:
还原为N2,其化学方程式为: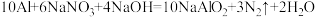 。请回答下列问题:
。请回答下列问题:
(1)上述反应中,被氧化的元素___________ ,还原产物是___________ 。
(2)用“双线桥法”表示反应中电子转移的方向和数目:___________ 。
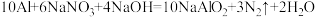
(3)反应中每生成1个N2,转移___________ 个电子。
(4)请配平下列离子方程式___________ 。

(5)已知I-、Fe2+、SO2、Cl-、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为: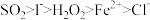 ,则下列反应不能发生的是___________。
,则下列反应不能发生的是___________。
 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为N2,其化学方程式为:
还原为N2,其化学方程式为: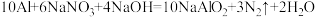 。请回答下列问题:
。请回答下列问题:(1)上述反应中,被氧化的元素
(2)用“双线桥法”表示反应中电子转移的方向和数目:
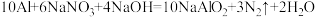
(3)反应中每生成1个N2,转移
(4)请配平下列离子方程式

(5)已知I-、Fe2+、SO2、Cl-、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:
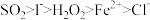 ,则下列反应不能发生的是___________。
,则下列反应不能发生的是___________。A.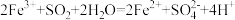 | B.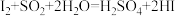 |
C.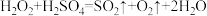 | D.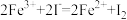 |
您最近一年使用:0次
2022-03-08更新
|
238次组卷
|
4卷引用:湖北省十堰市第二中学2021-2022学年高一上学期期中考试化学试题
名校
解题方法
4 . “绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”,减少废气的排放是环境保护的重要内容之一、
(1)氮氧化物是形成光化学烟雾的主要元凶,利用碱液吸收法可以有效地吸收氮氧化物,发生的反应有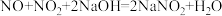 、
、 。若某混合气体中含amolNO和bmolNO2,用NaOH溶液吸收时,要使气体完全被吸收,则a与b需满足的关系为
。若某混合气体中含amolNO和bmolNO2,用NaOH溶液吸收时,要使气体完全被吸收,则a与b需满足的关系为___________ ,气体完全被吸收后测得溶液中NaNO2和NaNO3的物质的量之比为4∶1,则混合气体中NO的体积分数为___________ 。
(2)煤燃烧时排放的烟气中含有SO2和NOx,用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有SO2和NOx的烟气通入盛有NaClO2和NaOH溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如下表所示(其他极微量离子忽略不计):
①SO2和NaClO2溶液反应的离子方程式为___________ 。
②表中y=___________ 。
(3)工业生产硫酸也会产生SO2。硫铁矿(FeS2)煅烧的化学方程式为___________ ;当有11.2L(标准状况) SO2气体生成时,反应中转移的电子数为___________ NA。
(1)氮氧化物是形成光化学烟雾的主要元凶,利用碱液吸收法可以有效地吸收氮氧化物,发生的反应有
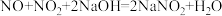 、
、 。若某混合气体中含amolNO和bmolNO2,用NaOH溶液吸收时,要使气体完全被吸收,则a与b需满足的关系为
。若某混合气体中含amolNO和bmolNO2,用NaOH溶液吸收时,要使气体完全被吸收,则a与b需满足的关系为(2)煤燃烧时排放的烟气中含有SO2和NOx,用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有SO2和NOx的烟气通入盛有NaClO2和NaOH溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如下表所示(其他极微量离子忽略不计):
| 离子 | Na+ | SO | NO | H+ | Cl- |
| 浓度/(mol/L) | 3.0×10-3 | y | 8.8×10-4 | 3.8×10-4 | 1.0×10-3 |
①SO2和NaClO2溶液反应的离子方程式为
②表中y=
(3)工业生产硫酸也会产生SO2。硫铁矿(FeS2)煅烧的化学方程式为
您最近一年使用:0次
2021-10-19更新
|
567次组卷
|
4卷引用:湖北省襄阳市老河口市高级中学2022-2023学年高一下学期期中考试化学试题
名校
5 . (1)下列微粒:①S、②SO 、③Fe2+、④Al3+、⑤Na、⑥HCl、⑦Na2O2在化学反应中只能被氧化的是
、③Fe2+、④Al3+、⑤Na、⑥HCl、⑦Na2O2在化学反应中只能被氧化的是________ (填序号),只能表现出氧化性的是______ (填序号)。
(2)在一定条件下,实验室分别以过氧化氢、高锰酸钾、氯酸钾、过氧化钠为原料制取氧气,当制得相同质量的氧气时,四个反应中转移的电子数之比为___________
(3)自来水中的NO 对人类健康产生危害。为了降低自来水中NO
对人类健康产生危害。为了降低自来水中NO 的浓度,某研究人员提出在碱性条件下用Al粉还原NO
的浓度,某研究人员提出在碱性条件下用Al粉还原NO ,产物是N2。发生的反应可表示如下,请完成方程式的
,产物是N2。发生的反应可表示如下,请完成方程式的配平 。
____ Al+____ NO +
+____ 
____ AlO
______ N2↑+____ H2O
(4)某化学反应的反应物和产物:KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
①该反应的氧化产物是__________ 。
②若该反应方程式中I2和KIO3的计量数分别是6和3,请在下边的化学式上用单线桥标出电子转移的方向和数目:KMnO4+KI+H2SO4→______
 、③Fe2+、④Al3+、⑤Na、⑥HCl、⑦Na2O2在化学反应中只能被氧化的是
、③Fe2+、④Al3+、⑤Na、⑥HCl、⑦Na2O2在化学反应中只能被氧化的是(2)在一定条件下,实验室分别以过氧化氢、高锰酸钾、氯酸钾、过氧化钠为原料制取氧气,当制得相同质量的氧气时,四个反应中转移的电子数之比为
(3)自来水中的NO
 对人类健康产生危害。为了降低自来水中NO
对人类健康产生危害。为了降低自来水中NO 的浓度,某研究人员提出在碱性条件下用Al粉还原NO
的浓度,某研究人员提出在碱性条件下用Al粉还原NO ,产物是N2。发生的反应可表示如下,请完成方程式的
,产物是N2。发生的反应可表示如下,请完成方程式的 +
+

(4)某化学反应的反应物和产物:KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
①该反应的氧化产物是
②若该反应方程式中I2和KIO3的计量数分别是6和3,请在下边的化学式上用单线桥标出电子转移的方向和数目:KMnO4+KI+H2SO4→
您最近一年使用:0次
名校
解题方法
6 . 双氧水和84消毒液是生活中常用的两种消毒剂,了解物质的性质是科学合理使用化学品的基础和前提。请回答下列问题:
(1)某同学设计如下实验研究H2O2的性质:
① 从理论上看H2O2既有氧化性又有还原性,具有还原性的原因是______ 。
② 能证明H2O2具有还原性的实验是______ (填序号)。可作为证据的实验现象是______ (填字母序号)。
(2)84消毒液的有效成分为NaClO
① 将Cl2通入NaOH溶液中可制得84消毒液,化学反应方程式为:______
② 84消毒液不能用于钢制器具的消毒,原因是NaClO具有______ 性。
③ 84消毒液的溶液在浸泡餐具过程中,因吸收空气中CO2消毒杀菌能力增强,该反应说明酸性强弱为______
(3)2016年巴西奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与H2O2反应产生O2促进藻类快速生长。
① 该反应说明氧化性:NaClO______ H2O2的(填“>”或“<”)。
② 当有0.1mol O2生成时,转移电子______ mol
(1)某同学设计如下实验研究H2O2的性质:
| 序号 | 实验 | 实验现象 |
| ⅰ | 向5%H2O2溶液中滴加酸性KMnO4溶液 | a. 溶液紫色褪去 b. 有大量气泡产生 |
| ⅱ | 向5%H2O2溶液中滴加淀粉碘化钾溶液 | c. 溶液变蓝 |
① 从理论上看H2O2既有氧化性又有还原性,具有还原性的原因是
② 能证明H2O2具有还原性的实验是
(2)84消毒液的有效成分为NaClO
① 将Cl2通入NaOH溶液中可制得84消毒液,化学反应方程式为:
② 84消毒液不能用于钢制器具的消毒,原因是NaClO具有
③ 84消毒液的溶液在浸泡餐具过程中,因吸收空气中CO2消毒杀菌能力增强,该反应说明酸性强弱为
(3)2016年巴西奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与H2O2反应产生O2促进藻类快速生长。
① 该反应说明氧化性:NaClO
② 当有0.1mol O2生成时,转移电子
您最近一年使用:0次
11-12高一上·湖北襄阳·期中
名校
解题方法
7 . 在反应 2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,氧化剂是 ______ ,氧化产物是 ______ ,氧化产物与还原产物的物质的量之比为 ______ ,被氧化与未被氧化的HCl的质量之比为 ______ ,若有73gHCl被氧化,电子转移的总数为 ______ ,产生Cl2的质量为 ______ g.
您最近一年使用:0次
2017-11-09更新
|
260次组卷
|
3卷引用:2011-2012学年湖北省襄阳市四校高一上学期期中考试化学试卷
(已下线)2011-2012学年湖北省襄阳市四校高一上学期期中考试化学试卷云南省大理市下关一中2017-2018学年高一上学期期中考试化学试题【市级联考】云南省大理市2017-2018学年高一上学期期中考试化学试题
11-12高一上·湖北黄冈·期中
8 . 氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3+4H++3e-===NO+2H2O。
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)配平上述总反应方程式并标出电子转移的方向和总数__________________
(2)反应中硝酸体现了________ 、________ 性质。
(3)反应中若产生了0.2 mol气体,则转移电子的物质的量是________ mol。
(4)被1mol Cu2S中+1价亚铜离子还原的HNO3的物质的量是____ mol
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)配平上述总反应方程式并标出电子转移的方向和总数
(2)反应中硝酸体现了
(3)反应中若产生了0.2 mol气体,则转移电子的物质的量是
(4)被1mol Cu2S中+1价亚铜离子还原的HNO3的物质的量是
您最近一年使用:0次



