名校
1 . 焦亚硫酸钠(Na2S2O5)常用作葡萄酒、果脯等食品的抗氧化剂。
I.焦亚硫酸钠的制备
已知:①Na2S2O5在空气中、受热时均易分解。
②生成Na2S2O5的化学方程式为2NaHSO3=Na2S2O5+H2O。
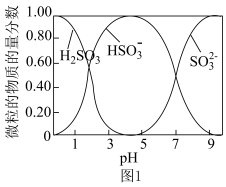
③水溶液中H2SO3、HSO 、SO
、SO 的物质的量分数随pH的分布如图1所示。
的物质的量分数随pH的分布如图1所示。
(1)SO2与Na2CO3过饱和溶液反应生成NaHSO3和CO2,其离子方程式为___________ 。
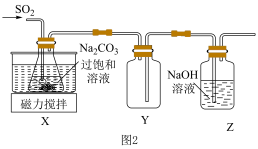
(2)实验室制备少量Na2S2O5的装置如图2所示,请补充完整相应实验方案:在不断搅拌下,控制反应温度在40℃左右,___________ ,20℃静置结晶,经减压抽滤、洗涤、25~30 ℃干燥,可获得Na2S2O5固体。
(3)实验制得的Na2S2O5固体中含有一定量的Na2SO4,其原因是___________ 。
Ⅱ.焦亚硫酸钠含量的测定
工业焦亚硫酸钠优质品要求质量分数≥96.5%。通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为:
Na2S2O5+CH3COOH+I2+H2O—H2SO4+HI+CH3COONa(未配平);
I2+2Na2S2O3=Na2S4O6+2NaI。
准确称取0.1950g样品,快速置于预先加入30.00 mL 0.100 0 mol·L-1碘标准液及20 mL水的250 mL碘量瓶中,加入5 mL乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处放置5 min;用0.1000 mol·L-1 Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗Na2S2O3溶液20.00 mL。
(4)滴定终点现象是___________ 。
(5)通过计算判断该样品是否为优质品是___________ (写出计算过程)。
I.焦亚硫酸钠的制备
已知:①Na2S2O5在空气中、受热时均易分解。
②生成Na2S2O5的化学方程式为2NaHSO3=Na2S2O5+H2O。
③水溶液中H2SO3、HSO
 、SO
、SO 的物质的量分数随pH的分布如图1所示。
的物质的量分数随pH的分布如图1所示。
(1)SO2与Na2CO3过饱和溶液反应生成NaHSO3和CO2,其离子方程式为
(2)实验室制备少量Na2S2O5的装置如图2所示,请补充完整相应实验方案:在不断搅拌下,控制反应温度在40℃左右,

(3)实验制得的Na2S2O5固体中含有一定量的Na2SO4,其原因是
Ⅱ.焦亚硫酸钠含量的测定
工业焦亚硫酸钠优质品要求质量分数≥96.5%。通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为:
Na2S2O5+CH3COOH+I2+H2O—H2SO4+HI+CH3COONa(未配平);
I2+2Na2S2O3=Na2S4O6+2NaI。
准确称取0.1950g样品,快速置于预先加入30.00 mL 0.100 0 mol·L-1碘标准液及20 mL水的250 mL碘量瓶中,加入5 mL乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处放置5 min;用0.1000 mol·L-1 Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗Na2S2O3溶液20.00 mL。
(4)滴定终点现象是
(5)通过计算判断该样品是否为优质品是
您最近一年使用:0次
名校
2 . 书写下列反应的离子 方程式:
(1)以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2.上述制备I2的总反应___________ 。
(2)在酸性条件下,黄铁矿(FeS2,其中S为-1价)催化氧化的反应转化如图所示。
总反应:2FeS2+7O2+2H2O=2Fe2++4 +4H+
+4H+
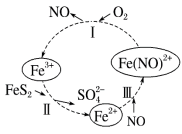
①反应I:___________ 。
②反应II:___________ 。
(3)红磷充分燃烧的产物与足量热的NaOH溶液反应,该反应的离子方程式是___________ 。
(4)取FeSO4溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈褐色并有红褐色沉淀生成。当消耗2molI-时,共转移3mol电子,该反应的离子方程式是___________ 。
(5)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如图所示:
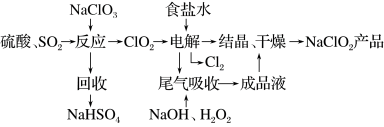
①写出“反应”步骤中生成ClO2的化学方程式:___________ 。
② “电解”过程阴极主反应的方程式:___________ 。
③“尾气吸收”是吸收“电解”过程排出的少量ClO2,写出此吸收反应的离子方程式:___________ 。
(1)以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2.上述制备I2的总反应
(2)在酸性条件下,黄铁矿(FeS2,其中S为-1价)催化氧化的反应转化如图所示。
总反应:2FeS2+7O2+2H2O=2Fe2++4
 +4H+
+4H+
①反应I:
②反应II:
(3)红磷充分燃烧的产物与足量热的NaOH溶液反应,该反应的离子方程式是
(4)取FeSO4溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈褐色并有红褐色沉淀生成。当消耗2molI-时,共转移3mol电子,该反应的离子方程式是
(5)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如图所示:

①写出“反应”步骤中生成ClO2的化学方程式:
② “电解”过程阴极主反应的方程式:
③“尾气吸收”是吸收“电解”过程排出的少量ClO2,写出此吸收反应的离子方程式:
您最近一年使用:0次
3 . 某小组探究不同阴离子与 的结合倾向并分析相关转化。
的结合倾向并分析相关转化。
资料:ⅰ. 和
和 均为白色,难溶于水。
均为白色,难溶于水。
ⅱ. 与
与 、
、 能生成
能生成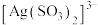 、
、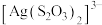 。
。
ⅲ.与 结合倾向
结合倾向 。
。
(1)探究 、
、 与
与 的结合倾向
的结合倾向
①由实验Ⅰ推测:与 结合倾向
结合倾向
______  (填“>”或“<”)。
(填“>”或“<”)。
②取两等份 浊液,分别滴加等浓度、等体积的
浊液,分别滴加等浓度、等体积的 和
和 溶液,前者无明显现象,后者浊液变澄清,澄清溶液中
溶液,前者无明显现象,后者浊液变澄清,澄清溶液中 价银的主要存在形式
价银的主要存在形式_______ (填化学式)。推测:与 结合倾向
结合倾向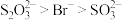 。查阅资料证实了上述推测。
。查阅资料证实了上述推测。
(2) 的转化
的转化
①写出实验Ⅲ中白色沉淀消失的离子方程式___________ 。
②查阅资料:实验Ⅳ中黑色沉淀是 ,
, 中S元素的化合价分别为
中S元素的化合价分别为 和
和 。写出实验Ⅳ中白色沉淀变为黑色的化学方程式:
。写出实验Ⅳ中白色沉淀变为黑色的化学方程式:___________ 。
③ 溶液可用作定影液。向
溶液可用作定影液。向 溶液溶解
溶液溶解 之后的废定影液中,加入
之后的废定影液中,加入___________ (填试剂和操作),可重新得到 。
。
(3) 的转化
的转化

分析试管1出现银镜的原因___________ 。
(4)资料显示: 与
与 结构相似,
结构相似, 可看作
可看作 外围的一个O被S替换的结果。但与
外围的一个O被S替换的结果。但与 的配位倾向:
的配位倾向: ,试从结构角度解释原因
,试从结构角度解释原因___________ 。
 的结合倾向并分析相关转化。
的结合倾向并分析相关转化。资料:ⅰ.
 和
和 均为白色,难溶于水。
均为白色,难溶于水。ⅱ.
 与
与 、
、 能生成
能生成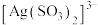 、
、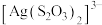 。
。ⅲ.与
 结合倾向
结合倾向 。
。(1)探究
 、
、 与
与 的结合倾向
的结合倾向 | 实验 | 滴管 | 试管 | 现象 |
| Ⅰ | 10滴 溶液 溶液 | 等浓度的 和 和 溶液 溶液 | 黄色沉淀 | |
| Ⅱ | 等浓度的 和 和 溶液 溶液 | 黄色沉淀 |
 结合倾向
结合倾向
 (填“>”或“<”)。
(填“>”或“<”)。②取两等份
 浊液,分别滴加等浓度、等体积的
浊液,分别滴加等浓度、等体积的 和
和 溶液,前者无明显现象,后者浊液变澄清,澄清溶液中
溶液,前者无明显现象,后者浊液变澄清,澄清溶液中 价银的主要存在形式
价银的主要存在形式 结合倾向
结合倾向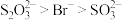 。查阅资料证实了上述推测。
。查阅资料证实了上述推测。(2)
 的转化
的转化 | 实验 | 滴管 | 试管 | 现象 |
| Ⅲ | 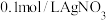 溶液 溶液 | 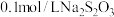 溶液 溶液 | 白色沉淀,振荡后消失 | |
| Ⅳ | 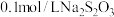 溶液 溶液 | 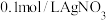 溶液 溶液 | 白色沉淀,逐渐变为灰色,最终为黑色沉淀 |
②查阅资料:实验Ⅳ中黑色沉淀是
 ,
, 中S元素的化合价分别为
中S元素的化合价分别为 和
和 。写出实验Ⅳ中白色沉淀变为黑色的化学方程式:
。写出实验Ⅳ中白色沉淀变为黑色的化学方程式:③
 溶液可用作定影液。向
溶液可用作定影液。向 溶液溶解
溶液溶解 之后的废定影液中,加入
之后的废定影液中,加入 。
。(3)
 的转化
的转化
分析试管1出现银镜的原因
(4)资料显示:
 与
与 结构相似,
结构相似, 可看作
可看作 外围的一个O被S替换的结果。但与
外围的一个O被S替换的结果。但与 的配位倾向:
的配位倾向: ,试从结构角度解释原因
,试从结构角度解释原因
您最近一年使用:0次
名校
解题方法
4 . 设计实验探究NO的氧化性。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性 溶液的水槽中,振荡,观察到集气瓶中液面上升。
溶液的水槽中,振荡,观察到集气瓶中液面上升。
资料:ⅰ.NO与碱性 溶液会发生氧化还原反应,
溶液会发生氧化还原反应, 被还原为
被还原为 。
。
ⅱ. 与
与 反应生成黄色沉淀。
反应生成黄色沉淀。
某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和 溶液,加入少量冰醋酸,再滴加5滴
溶液,加入少量冰醋酸,再滴加5滴 的
的 溶液,无明显变化。
溶液,无明显变化。
实验Ⅲ:
(1)取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴 的
的 溶液,
溶液,___________ (填实验现象)。
上述实验证明NO有氧化性。
(2)实验Ⅱ的目的是___________
(3)写出NO与碱性 溶液反应的离子方程式
溶液反应的离子方程式___________
(4)一个氧化还原反应可以看成“氧化”和“还原”两个半反应,试用此角度分析NO与碱性 溶液的反应。若还原反应为:
溶液的反应。若还原反应为: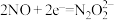 ,则氧化反应为:
,则氧化反应为:___________ 。
(5)某同学结合所学知识设计处理工业废气中 和NO的实验方案,达到消除污染,保护环境的目的。
和NO的实验方案,达到消除污染,保护环境的目的。
①先用饱和纯碱溶液吸收废气中的 ,生成
,生成 ,写出该反应的离子方程式
,写出该反应的离子方程式___________
②再向生成的溶液中加入一定量___________ ,以此溶液来吸收NO气体。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性
 溶液的水槽中,振荡,观察到集气瓶中液面上升。
溶液的水槽中,振荡,观察到集气瓶中液面上升。资料:ⅰ.NO与碱性
 溶液会发生氧化还原反应,
溶液会发生氧化还原反应, 被还原为
被还原为 。
。ⅱ.
 与
与 反应生成黄色沉淀。
反应生成黄色沉淀。某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和
 溶液,加入少量冰醋酸,再滴加5滴
溶液,加入少量冰醋酸,再滴加5滴 的
的 溶液,无明显变化。
溶液,无明显变化。实验Ⅲ:
(1)取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴
 的
的 溶液,
溶液,上述实验证明NO有氧化性。
(2)实验Ⅱ的目的是
(3)写出NO与碱性
 溶液反应的离子方程式
溶液反应的离子方程式(4)一个氧化还原反应可以看成“氧化”和“还原”两个半反应,试用此角度分析NO与碱性
 溶液的反应。若还原反应为:
溶液的反应。若还原反应为: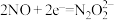 ,则氧化反应为:
,则氧化反应为:(5)某同学结合所学知识设计处理工业废气中
 和NO的实验方案,达到消除污染,保护环境的目的。
和NO的实验方案,达到消除污染,保护环境的目的。①先用饱和纯碱溶液吸收废气中的
 ,生成
,生成 ,写出该反应的离子方程式
,写出该反应的离子方程式②再向生成的溶液中加入一定量
您最近一年使用:0次
解题方法
5 . 能正确表示下列反应的离子方程式的是
A.将少量氯气通入NaHSO3溶液中:HSO +H2O+Cl2=2Cl-+3H++SO +H2O+Cl2=2Cl-+3H++SO |
B.将少量NaAlO2溶液滴入Ca(HCO3)2溶液中:AlO +HCO +HCO +H2O=Al(OH)3↓+CO +H2O=Al(OH)3↓+CO |
C.将Ba(OH)2溶液滴入明矾[KAl(SO4)2•12H2O]溶液中至沉淀质量最大:Al3++2SO +2Ba2++4OH-=2BaSO4↓+AlO +2Ba2++4OH-=2BaSO4↓+AlO +2H2O +2H2O |
D.同物质的量浓度同体积的NH4H2PO4溶液与NaOH溶液混合:NH +OH-=NH3•H2O +OH-=NH3•H2O |
您最近一年使用:0次
2023-05-15更新
|
1235次组卷
|
3卷引用:河北省部分示范性高中2023届高三三模化学试题
河北省部分示范性高中2023届高三三模化学试题浙江省名校协作体2023-2024学年高三上学期开学适应性考试化学试题(已下线)专题01 基本概念(5大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)
6 . 为探究Na2SO3的性质,实验小组同学进行了如下实验:

| A.③和④中产生的气体成分完全相同 | B.②和⑥中沉淀的主要成分不同 |
| C.①→②和④→⑥均只发生了复分解反应 | D. 的还原性在酸性条件下增强 的还原性在酸性条件下增强 |
您最近一年使用:0次
2023-04-06更新
|
2594次组卷
|
11卷引用:北京市海淀区2022-2023学年高三下学期期中练习化学试题
北京市海淀区2022-2023学年高三下学期期中练习化学试题山东省东营市第一中学2023届高三下学期二模化学试题浙江省杭州第四中学2022-2023学年高一下学期期中考试化学试题(已下线)【2023】【高一下】【期中考】【杭四下沙】【高中化学】【罗梦宇收集】(已下线)题型35 微型成套装置实验流程(已下线)题型45 物质性质探究型综合实验山西省晋城一中2022-2023学年高一下学期第三次调研考试化学试题天津市滨海新区2023-2024学年塘沽第一中学高三上学期第二次月考化学试题(已下线)热点19 化学微型实验北京一零一中2023-2024学年高三上学期第一次月考(开学考)化学试卷 北京市顺义区第二中学2023-2024学年高三下学期开学测化学试题
名校
解题方法
7 . 由下列实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向某溶液中加入适量 溶液,产生白色沉淀;将该白色沉淀加入到足量稀盐酸中,产生能使品红溶液褪色的气体 溶液,产生白色沉淀;将该白色沉淀加入到足量稀盐酸中,产生能使品红溶液褪色的气体 | 原溶液中一定含有大量的 |
| B | 向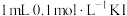 溶液中加入 溶液中加入 溶液,充分反应后,用 溶液,充分反应后,用 萃取分液, 萃取分液, 层呈紫红色;向水层中滴加KSCN溶液,溶液呈红色 层呈紫红色;向水层中滴加KSCN溶液,溶液呈红色 |  与 与 的反应是可逆反应 的反应是可逆反应 |
| C | 向蔗糖溶液中加入少量稀硫酸,水浴加热5min,加氢氧化钠溶液至溶液呈碱性,再加入少量新制的 ;继续加热5min,生成砖红色沉淀 ;继续加热5min,生成砖红色沉淀 | 蔗糖完全水解 |
| D | 取少量实验室保存的 固体溶于蒸馏水,加入过量稀盐酸,再加入 固体溶于蒸馏水,加入过量稀盐酸,再加入 溶液,有白色沉淀产生 溶液,有白色沉淀产生 |  固体样品已经变质 固体样品已经变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-03-10更新
|
521次组卷
|
2卷引用:湖南省名校联盟2023届高三下学期3月调研考试化学试题
名校
解题方法
8 . 某固体混合物可能由SiO2、Fe2O3、Fe、Na2SO3、Na2CO3、BaCl2中的若干种物质组成,设计部分实验方案探究该固体混合物的成分,所加试剂均过量,下列说法正确的是
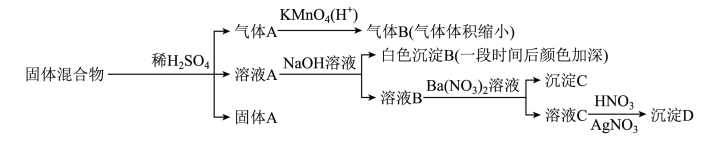

| A.气体A中一定含有H2 |
| B.该固体混合物中Fe2O3和Fe至少有其中一种 |
| C.固体A中可能含有BaSO4 |
| D.该固体混合物一定含有Na2CO3、Na2SO3、BaCl2 |
您最近一年使用:0次
2023-01-10更新
|
888次组卷
|
7卷引用:山东省济南市2022-2023学年高三上学期期中考试化学试题
名校
解题方法
9 . 10mL某无色溶液中可能存在如下离子,取该溶液进行下述实验(不考虑水解),下列推理正确的是
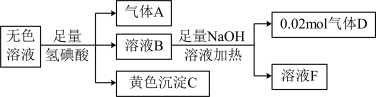
| 阳离子 | NH 、Na+、Ag+、Al3+ 、Na+、Ag+、Al3+ |
| 阴离子 | CO 、S2-、SO 、S2-、SO 、Cr2O 、Cr2O |

A.气体A通入澄清石灰水中,溶液变浑浊,不能确定无色溶液中含有CO |
B.溶液B与足量NaOH溶液加热生成0.02mol气体D,说明无色溶液含有NH 的浓度为2mol/L 的浓度为2mol/L |
| C.生成黄色沉淀C,说明无色溶液含有Ag+ |
| D.用洁净的铂丝蘸取溶液F在火焰上灼烧,火焰呈黄色,说明原无色溶液含有Na+ |
您最近一年使用:0次
2022-12-13更新
|
301次组卷
|
3卷引用:山东省济南市天桥区黄河双语实验学校2021-2022学年高三上学期10月月考化学试题
解题方法
10 . 科研人员提出了雾霾微粒中硫酸盐生成的三个阶段的转化机理,其主要过程示意图如图。下列说法错误的是
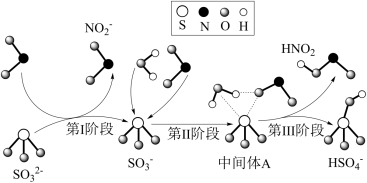

A.氧化性:NO2>SO ,还原性:SO ,还原性:SO >HNO2 >HNO2 |
B.第II、III阶段总的化学方程式为:SO +H2O+NO2=HNO2+HSO +H2O+NO2=HNO2+HSO |
| C.NO2在所有过程中都是被还原 |
| D.上述反应过程中,S的成键数目保持不变 |
您最近一年使用:0次
2022-11-20更新
|
1314次组卷
|
3卷引用:山西省吕梁市2022-2023学年高三上学期阶段性测试化学试题
山西省吕梁市2022-2023学年高三上学期阶段性测试化学试题(已下线)专题04 氧化还原反应及其应用 (测)-2023年高考化学二轮复习讲练测(新高考专用)山东日照市莒县一中2022-2023学年高一下学期3月月考化学试题



