21-22高一·全国·课时练习
1 . Na2SO3中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、Na2S溶液、Na2SO3溶液、H2SO4、NaOH溶液、氨水。
(1)要证明Na2SO3具有还原性,应选用的试剂有___________ ,看到的现象是___________ ,反应的离子方程式为___________ 。
(2)要证明Na2SO3具有氧化性,应选用的试剂有___________ ,看到的现象是___________ ,反应的离子方程式为___________ 。
(3)证明H2SO3的酸性小于H2SO4,选用的试剂有___________ ,反应的现象是___________ ,反应的离子方程式为___________ 。
(1)要证明Na2SO3具有还原性,应选用的试剂有
(2)要证明Na2SO3具有氧化性,应选用的试剂有
(3)证明H2SO3的酸性小于H2SO4,选用的试剂有
您最近一年使用:0次
20-21高三上·江苏泰州·期中
解题方法
2 . 资料显示: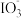 在酸性溶液中能氧化I-,反应为
在酸性溶液中能氧化I-,反应为 +5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。
+5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。
(1)甲同学对这一现象做出如下假设:t秒前生成了I2,但由于存在Na2SO3,I2被消耗,该反应的离子方程式为________ , 的还原性
的还原性________ I-(填“>”“=”或“<”)。
(2)为验证他的猜想,甲同学向反应后的蓝色溶液中加入________ ,蓝色迅速消失,随后再次变蓝。
(3)甲同学设计了如下实验,进一步研究Na2SO3溶液和KIO3溶液反应的过程。
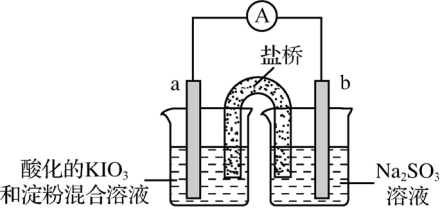
①甲同学在b电极附近的溶液中检测出了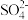
②刚开始放电时,a电极附近溶液未变蓝;取出a电极附近溶液于试管中,溶液变蓝。 在a极放电的产物是
在a极放电的产物是________ 。
③放电一段时间后,a电极附近溶液短暂出现蓝色,随即消失,重复多次后,蓝色不再褪去。电流表显示电路中时而出现电流,时而归零,最终电流消失。电流表短暂归零的原因是________ 。
④下列说法正确的是________ 。
a. a电极附近蓝色不再褪去时, 尚未完全氧化
尚未完全氧化
b. a电极附近短暂出现蓝色,随即消失的原因可能是因为I2被 还原
还原
c. 电流消失后,向b电极附近加入过量Na2SO3溶液,重新产生电流,a电极附近蓝色褪去
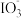 在酸性溶液中能氧化I-,反应为
在酸性溶液中能氧化I-,反应为 +5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。
+5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。(1)甲同学对这一现象做出如下假设:t秒前生成了I2,但由于存在Na2SO3,I2被消耗,该反应的离子方程式为
 的还原性
的还原性(2)为验证他的猜想,甲同学向反应后的蓝色溶液中加入
(3)甲同学设计了如下实验,进一步研究Na2SO3溶液和KIO3溶液反应的过程。

①甲同学在b电极附近的溶液中检测出了
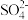
②刚开始放电时,a电极附近溶液未变蓝;取出a电极附近溶液于试管中,溶液变蓝。
 在a极放电的产物是
在a极放电的产物是③放电一段时间后,a电极附近溶液短暂出现蓝色,随即消失,重复多次后,蓝色不再褪去。电流表显示电路中时而出现电流,时而归零,最终电流消失。电流表短暂归零的原因是
④下列说法正确的是
a. a电极附近蓝色不再褪去时,
 尚未完全氧化
尚未完全氧化b. a电极附近短暂出现蓝色,随即消失的原因可能是因为I2被
 还原
还原c. 电流消失后,向b电极附近加入过量Na2SO3溶液,重新产生电流,a电极附近蓝色褪去
您最近一年使用:0次
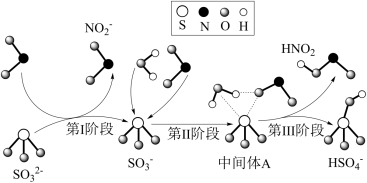
3 . “价—类”二维图是研究物质性质的一种方法,图中a~f表示的均是含硫物质。下列说法正确的是

| A.a可用硫化亚铁与稀硝酸反应制取 |
B.可发生反应: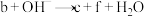 (未配平) (未配平) |
| C.c能使溴水褪色,证明c有漂白性 |
| D.f既有氧化性又有还原性 |
您最近一年使用:0次
2024-02-14更新
|
634次组卷
|
8卷引用:专题01 硫及其化合物(考题猜想)(8大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)
(已下线)专题01 硫及其化合物(考题猜想)(8大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)河北省承德市2023-2024学年高一上学期期末考试化学试题河北省石家庄市第二十三中学2023-2024学年高一下学期第一次月考(3月)化学试题河南省新乡市原阳县实验高级中学2023-2024学年高一下学期3月月考化学试题河南省南阳市社旗县第一高级中学2023-2024学年高一下学期4月期中考试化学试题重庆市璧山来凤中学校2023-2024学年高一下学期3月月考化学试题安徽省淮南市第二中2023-2024学年高一下学期第一次月考化学试题江苏省南宁市第三十三中学2023-2024学年高一下学期3月月考化学试题
22-23高三上·山西吕梁·阶段练习
解题方法
4 . 科研人员提出了雾霾微粒中硫酸盐生成的三个阶段的转化机理,其主要过程示意图如图。下列说法错误的是

A.氧化性:NO2>SO ,还原性:SO ,还原性:SO >HNO2 >HNO2 |
B.第II、III阶段总的化学方程式为:SO +H2O+NO2=HNO2+HSO +H2O+NO2=HNO2+HSO |
| C.NO2在所有过程中都是被还原 |
| D.上述反应过程中,S的成键数目保持不变 |
您最近一年使用:0次
2022-11-20更新
|
1296次组卷
|
3卷引用:专题04 氧化还原反应及其应用 (测)-2023年高考化学二轮复习讲练测(新高考专用)
(已下线)专题04 氧化还原反应及其应用 (测)-2023年高考化学二轮复习讲练测(新高考专用)山西省吕梁市2022-2023学年高三上学期阶段性测试化学试题山东日照市莒县一中2022-2023学年高一下学期3月月考化学试题
2022·山东淄博·三模
名校
5 . 在“价一类”二维图中融入“杠杆模型”,可直观辨析部分物质转化及其定量关系。图中的字母分别代表硫及其常见化合物,相关推断不合理的是
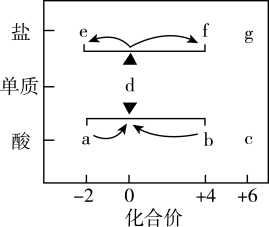

| A.b、d、f既具有氧化性又具有还原性 |
| B.硫酸型酸雨的形成过程涉及b到c的转化 |
| C.d与c在一定条件下反应可生成b或a |
D.d在加热条件下与强碱溶液反应生成e和f,且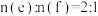 |
您最近一年使用:0次
2022-05-31更新
|
631次组卷
|
6卷引用:考点10 硫及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)
(已下线)考点10 硫及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第13讲 硫及其化合物(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第4讲 浓硫酸 不同价态含硫物质的转化上海市金山区2022-2023学年高三第一次质量调研(一模)化学试题山东省淄博市2022届高三三模化学试题福建省德化第一中学2023-2024学年高三上学期第一次月考化学试题
20-21高一上·江苏连云港·期末
解题方法
6 . 认识含硫物质的性质及转化规律,能帮助我们更好地认识自然和保护环境。
(1)酸雨的形成原因。将SO2气体通入蒸馏水中,取出部分溶液并用pH计测定其pH,每隔10min读数一次,所得数据如下:
随着时间的推移,pH逐渐变小的原因是___________ (用化学方程式表示)。
(2)防治SO2对环境的污染。
①从物质分类角度看,SO2属于酸性氧化物。工业上常用熟石灰将SO2转化为亚硫酸盐,写出所得亚硫酸盐的化学式:___________ 。
②从元素价态看,SO2中S元素为+4价,既具有氧化性,又具有还原性。用生物质热解气(主要成分为CO、CH4、H2)可将SO2在高温下还原成单质硫。写出CO还原SO2反应的化学方程式:___________ 。
(3)获取空气质量信息。某化学小组为了测定空气中SO2的体积分数,做了如下实验:取标准状况下的空气20.00L(含N2、O2、CO2、SO2),缓慢通过足量溴水,反应的化学方程式为: 。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为4.66g。
。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为4.66g。
①检验沉淀是否洗涤干净的方法是___________ 。
②空气样品中SO2的体积分数为___________ 。
(1)酸雨的形成原因。将SO2气体通入蒸馏水中,取出部分溶液并用pH计测定其pH,每隔10min读数一次,所得数据如下:
| 时间(min) | 0 | 10 | 20 | 30 | 40 |
| pH | 4.95 | 4.94 | 4.86 | 4.85 | 4.85 |
随着时间的推移,pH逐渐变小的原因是
(2)防治SO2对环境的污染。
①从物质分类角度看,SO2属于酸性氧化物。工业上常用熟石灰将SO2转化为亚硫酸盐,写出所得亚硫酸盐的化学式:
②从元素价态看,SO2中S元素为+4价,既具有氧化性,又具有还原性。用生物质热解气(主要成分为CO、CH4、H2)可将SO2在高温下还原成单质硫。写出CO还原SO2反应的化学方程式:
(3)获取空气质量信息。某化学小组为了测定空气中SO2的体积分数,做了如下实验:取标准状况下的空气20.00L(含N2、O2、CO2、SO2),缓慢通过足量溴水,反应的化学方程式为:
 。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为4.66g。
。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为4.66g。①检验沉淀是否洗涤干净的方法是
②空气样品中SO2的体积分数为
您最近一年使用:0次
2021-01-27更新
|
457次组卷
|
3卷引用:专题06 非金属及其化合物-备战2021届高考化学二轮复习题型专练
(已下线)专题06 非金属及其化合物-备战2021届高考化学二轮复习题型专练江苏省连云港市2020-2021学年高一上学期期末调研考试化学试题广东省深圳市光明区2022-2023学年高一下学期开学考试化学试题
19-20高二下·黑龙江哈尔滨·阶段练习
7 . 根据下列实验操作和现象所得到的结论错误的是( )
| 选项 | 实验操作和现象 | 实验结论 |
| A | 向2mL0.1FeCl3的溶液中加足量铁粉,振荡,加1滴KSCN溶液,黄色逐渐消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
| B | 向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解 | 部分Na2SO3被氧化 |
| C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| D | 向某黄色溶液中加入淀粉KI溶液,溶液呈蓝色 | 溶液中含Br2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-07-03更新
|
274次组卷
|
3卷引用:第二单元 化学物质的变化测试题-2021年高考化学一轮复习名师精讲练
(已下线)第二单元 化学物质的变化测试题-2021年高考化学一轮复习名师精讲练黑龙江省哈尔滨市第三中学2019-2020学年高二下学期6月阶段性测试化学试题A山东省临沂市莒南第二中学2021届高三10月月考化学试题
8 . 某小组进行如下实验:向0.1mol·L-1 FeCl3溶液中通入SO2或加入Na2SO3溶液,均得到红色溶液。
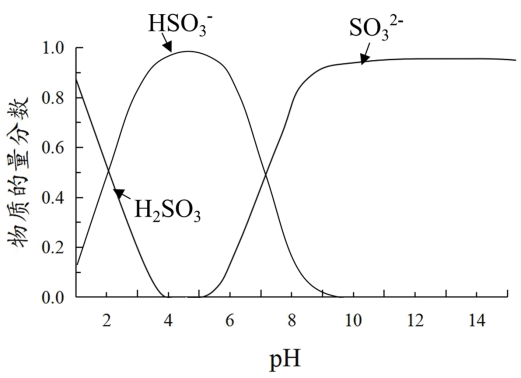
已知:溶液中+4价含硫微粒物质的量分数随pH变化的曲线如下图所示。
I.推测Fe3+与溶液中的某种+4价含硫微粒形成了红色的配离子。设计如下实验(均在常温下进行):
(1)将上述实验补充完整________ 。
(2)配离子的配体为 的实验证据是
的实验证据是_______ 。
II.探究pH对FeCl3和Na2SO3反应的影响。设计如下实验:
(3)探究实验b中溶液褪色更快的原因:
i.甲认为pH降低,有利于Fe3+氧化 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。
①从电极反应的角度,进行理论分析:
还原反应为:Fe3++e-=Fe2+氧化反应为:_______ 。
②已知上述实验条件下pH对Fe3+的氧化性几乎没有影响。从平衡移动的角度判断pH对 还原性的影响是
还原性的影响是_______ (填“增强”或“减弱”)。
③通过理论分析,甲认为其猜测_______ (填“成立”或“不成立”),并进一步实验,获得了证据。实验方案为:反应相同时间,分别取实验a和b中的溶液,检测_______ 浓度(填离子符号),比较其大小关系。
ii.乙猜测pH降低,有利于_______氧化 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。
④将乙的假设补充完整_______ (填化学式)。
⑤乙设计实验进行验证:
取10mL 0.1mol·L-1 Na2SO3溶液加硫酸调pH=1.7,用KMnO4溶液滴定,消耗体积为V1。另取一份相同的溶液放置10分钟后,再用KMnO4溶液滴定,消耗体积为V2.前后差值(V1-V2)为ΔVa。用同样的方法对10mL 0.1mol·L-1 Na2SO3(含H2SO4)pH=1.3进行滴定,消耗KMnO4溶液前后体积差值为ΔVb。
经对比可知,ΔVa>△Vb,由此得出的实验结论是_______ 。
(4)综合上述分析,pH降低,有利于_______ 反应的发生,导致实验b中溶液褪色更快。
已知:溶液中+4价含硫微粒物质的量分数随pH变化的曲线如下图所示。

I.推测Fe3+与溶液中的某种+4价含硫微粒形成了红色的配离子。设计如下实验(均在常温下进行):
| 实验 | 溶液1(1mL) | 溶液2(10mL) | 现象 |
| A | 0.1mol·L-1 FeCl3溶液 | SO2的饱和溶液 | 溶液1与溶液2混合后,实验A、B、C所得溶液红色依次加深 |
| B | 0.1mol·L-1 FeCl3溶液 | SO2的饱和溶液,用NaOH固体调 pH=5.0 | |
| C | 0.1mol·L-1 FeCl3溶液 | _______ |
(2)配离子的配体为
 的实验证据是
的实验证据是II.探究pH对FeCl3和Na2SO3反应的影响。设计如下实验:
| 序号 | 实验a | 实验b |
| 方案 | 5mL酸化的0.1mol·L-1 FeCl3与2mL 0.1mol·L-1 Na2SO3混合得红色溶液,测得pH=1.7 | 5mL酸化的0.1mol·L-1 FeCl3与2mL 0.1mol·L-1 Na2SO3混合得红色溶液,加几滴浓盐酸,调pH=1.3 |
| 现象 | 放置10分钟后,溶液红色均褪去,实验b中溶液褪色更快。经检验,褪色后的溶液中均存在Fe2+。 | |
i.甲认为pH降低,有利于Fe3+氧化
 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。①从电极反应的角度,进行理论分析:
还原反应为:Fe3++e-=Fe2+氧化反应为:
②已知上述实验条件下pH对Fe3+的氧化性几乎没有影响。从平衡移动的角度判断pH对
 还原性的影响是
还原性的影响是③通过理论分析,甲认为其猜测
ii.乙猜测pH降低,有利于_______氧化
 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。④将乙的假设补充完整
⑤乙设计实验进行验证:
取10mL 0.1mol·L-1 Na2SO3溶液加硫酸调pH=1.7,用KMnO4溶液滴定,消耗体积为V1。另取一份相同的溶液放置10分钟后,再用KMnO4溶液滴定,消耗体积为V2.前后差值(V1-V2)为ΔVa。用同样的方法对10mL 0.1mol·L-1 Na2SO3(含H2SO4)pH=1.3进行滴定,消耗KMnO4溶液前后体积差值为ΔVb。
经对比可知,ΔVa>△Vb,由此得出的实验结论是
(4)综合上述分析,pH降低,有利于
您最近一年使用:0次
2022-04-29更新
|
1785次组卷
|
6卷引用:专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)
(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)天天练6-10北京市丰台区2022届高三二模化学试题(已下线)化学-2022年高考押题预测卷03(北京卷)北京市顺义区第一中学2022届高三下学期三模化学试题湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题
2023高三·全国·专题练习
解题方法
9 . 完成下列实验设计题:
(1)证明CO2中含有CO___________
(2)证明SO2中含有CO2___________
(3)证明SO 中含有SO
中含有SO
___________
(4)①证明H2C2O4是弱酸;②证明草酸的酸性强于碳酸;③证明草酸是二元酸___________ (提供的试剂:0.1 mol·L-1 NaHCO3溶液、0.1 mol·L-1草酸溶液、0.1 mol·L-1 NaOH溶液、Na2C2O4晶体、甲基橙、酚酞、pH试纸)
(5)设计一个实验方案证明酸性条件下NaNO2具有氧化性___________ (提供的试剂:0.10 mol·L-1 NaNO2溶液、KMnO4溶液、0.10 mol·L-1 KI溶液、淀粉溶液、稀硝酸、稀硫酸)
(1)证明CO2中含有CO
(2)证明SO2中含有CO2
(3)证明SO
 中含有SO
中含有SO
(4)①证明H2C2O4是弱酸;②证明草酸的酸性强于碳酸;③证明草酸是二元酸
(5)设计一个实验方案证明酸性条件下NaNO2具有氧化性
您最近一年使用:0次
21-22高三上·江西宜春·阶段练习
名校
解题方法
10 . 连二亚硫酸钠(Na2S2O4)俗称保险粉,有强还原性,在空气中极易被氧化。用NaHSO3还原法制备保险粉的流程如下:
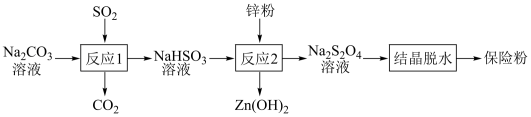
下列说法错误的是

下列说法错误的是
| A.反应1说明酸性:H2SO3>H2CO3 |
| B.反应2中消耗的氧化剂和还原剂的物质的量之比为1∶2 |
| C.反应2最好在无氧条件下进行 |
| D.反应1结束后,可用盐酸酸化的BaCl2溶液检验NaHSO3是否被氧化 |
您最近一年使用:0次
2021-11-04更新
|
803次组卷
|
5卷引用:专题40 硫的含氧酸盐-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)
(已下线)专题40 硫的含氧酸盐-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)3.2.2 硫酸 不同价态硫元素间的转化-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)陕西省安康市2022-2023学年高二上学期11月期中化学试题陕西省安康市2022-2023学年高二下学期开学摸底考试化学试题江西省奉新县第一中学2021-2022学年上学期高三第一次月考化学试题



