1 . 次磷酸钠(NaH2PO2)在食品工业中用作防腐剂、抗氧化剂,也是一种很好的化学镀剂。
(1)NaH2PO2中P的化合价为___________ 价。
(2)将待镀零件浸泡在NiSO4和NaH2PO2的混合溶液中,可达到化学镀镍(在待镀零件表面形成一层金属镍)的目的,该过程中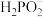 被氧化为二元弱酸H3PO3,写出该反应的离子方程式
被氧化为二元弱酸H3PO3,写出该反应的离子方程式___________ 。
(3)次磷酸钠的制备
将黄磷(P4)和过量烧碱溶液混合加热,生成NaH2PO2和PH3(气体),PH3与NaClO溶液反应可生成次磷酸(H3PO2),实验装置如图:

①装置A中盛放烧碱溶液的仪器名称为___________ 。
②由装置A中发生化学反应可知,次磷酸(H3PO2)属于___________ 元弱酸。
③装置C中发生反应的化学方程式为___________ 。
④已知相关物质的溶解度如表:
充分反应后,将A、C中溶液混合,再将混合液(含极少量NaOH)加热浓缩,有大量杂质晶体析出,然后___________ (填操作名称),得到含NaH2PO2的溶液,进一步处理得到粗产品。
⑤反应结束后,向装置内通入N2的目的是___________ 。
(4)次磷酸钠的纯度测定
先取1.0g粗产品配成100mL溶液,再取25.00mL所配溶液于锥形瓶中,酸化后加入过量的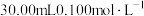 碘水。充分反应后,剩余碘水恰好可消耗
碘水。充分反应后,剩余碘水恰好可消耗 溶液(相关反应方程式为:
溶液(相关反应方程式为: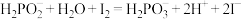 ,
, ),则产品纯度为
),则产品纯度为___________ 。(已知:NaH2PO2相对分子质量为88)
(1)NaH2PO2中P的化合价为
(2)将待镀零件浸泡在NiSO4和NaH2PO2的混合溶液中,可达到化学镀镍(在待镀零件表面形成一层金属镍)的目的,该过程中
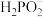 被氧化为二元弱酸H3PO3,写出该反应的离子方程式
被氧化为二元弱酸H3PO3,写出该反应的离子方程式(3)次磷酸钠的制备
将黄磷(P4)和过量烧碱溶液混合加热,生成NaH2PO2和PH3(气体),PH3与NaClO溶液反应可生成次磷酸(H3PO2),实验装置如图:

①装置A中盛放烧碱溶液的仪器名称为
②由装置A中发生化学反应可知,次磷酸(H3PO2)属于
③装置C中发生反应的化学方程式为
④已知相关物质的溶解度如表:
| 25℃ | 100℃ | |
| NaCl | 37g | 39g |
| NaH2PO2 | 100g | 667g |
⑤反应结束后,向装置内通入N2的目的是
(4)次磷酸钠的纯度测定
先取1.0g粗产品配成100mL溶液,再取25.00mL所配溶液于锥形瓶中,酸化后加入过量的
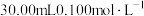 碘水。充分反应后,剩余碘水恰好可消耗
碘水。充分反应后,剩余碘水恰好可消耗 溶液(相关反应方程式为:
溶液(相关反应方程式为: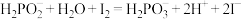 ,
, ),则产品纯度为
),则产品纯度为
您最近一年使用:0次
2 . 碳酸锂是制备各种锂化合物的关键原料。一种以磷酸锂渣(主要成分Li3PO4)为原料制备碳酸锂的工艺流程示意图如下。
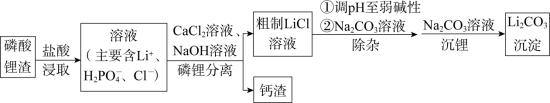
已知:部分物质的溶解性表(20℃)
(1)写出浸取时Li3PO4与盐酸反应的化学方程式:_______ 。
(2)加入盐酸的量不宜过多的原因是_______ 。
(3)钙渣的主要成分是_______ 。
(4)磷锂分离时,需要不断加入适量NaOH溶液以维持溶液的pH基本不变。结合离子方程式解释其原因是_______ 。
(5)沉锂时,反应的离子方程式是_______ 。

已知:部分物质的溶解性表(20℃)
| 阳离子 | 阴离子 | ||
 | 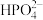 | 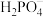 | |
| Li+ | 难溶 | 可溶 | 易溶 |
| Ca2+ | 难溶 | 难溶 | 可溶 |
(2)加入盐酸的量不宜过多的原因是
(3)钙渣的主要成分是
(4)磷锂分离时,需要不断加入适量NaOH溶液以维持溶液的pH基本不变。结合离子方程式解释其原因是
(5)沉锂时,反应的离子方程式是
您最近一年使用:0次
3 . 实验室利用红磷(P)与Cl2反应可制取少量PCl3或PCl5。
I.利用如图所示装置制取少量PCl3(部分夹持装置已略去)。
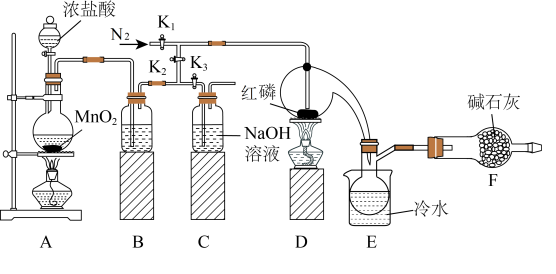
(1)组装好装置,在放入试剂前应先_____ 。
(2)A中发生反应的离子方程式为_____ 。
(3)B中所装试剂为_____ 。
(4)实验开始前,打开K1通入一段时间氮气来除去装置中的空气,除去空气的目的是_____ ;除去装置A、B中空气的具体方法是_____ 。
(5)除去产物中PCl5杂质的化学反应方程式是_____ 。
II.测定产品中PCl3的质量分数
实验步骤:
①迅速称取mg产品,加水反应后配成100mL溶液。
②取上述溶液10.00mL,向其中加入V1mLc1mol/L碘水(足量),充分反应。
③向②所得溶液中加入几滴淀粉溶液,逐滴滴加c2mol/L的Na2S2O3溶液并振荡,当溶液恰好由蓝色变为无色时,记录所消耗Na2S2O3溶液的体积。
④重复②、③操作3次,平均消耗Na2S2O3溶液V2mL。
(6)第①步溶于水的化学反应方程式是_____ 。
(7)逐滴滴加Na2S2O3溶液使用的仪器是_____ 。(已知:H2S2O3是弱酸)。
(8)根据上述数据测得该产品中PCl3的质量分数为_____ 。(已知:H3PO3+I2+H2O=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6)
| 物质 | 熔点/℃ | 沸点/℃ | 性质 |
| PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,与O2反应生成POCl3 |
| PCl5 | — | 约100℃升华 | 遇水生成H3PO4和HCl,与红磷反应生成PCl3 |

(1)组装好装置,在放入试剂前应先
(2)A中发生反应的离子方程式为
(3)B中所装试剂为
| A.饱和碳酸氢钠溶液 | B.饱和氯化钠溶液 |
| C.氢氧化钠溶液 | D.浓硫酸 |
(5)除去产物中PCl5杂质的化学反应方程式是
II.测定产品中PCl3的质量分数
实验步骤:
①迅速称取mg产品,加水反应后配成100mL溶液。
②取上述溶液10.00mL,向其中加入V1mLc1mol/L碘水(足量),充分反应。
③向②所得溶液中加入几滴淀粉溶液,逐滴滴加c2mol/L的Na2S2O3溶液并振荡,当溶液恰好由蓝色变为无色时,记录所消耗Na2S2O3溶液的体积。
④重复②、③操作3次,平均消耗Na2S2O3溶液V2mL。
(6)第①步溶于水的化学反应方程式是
(7)逐滴滴加Na2S2O3溶液使用的仪器是
(8)根据上述数据测得该产品中PCl3的质量分数为
您最近一年使用:0次
名校
解题方法
4 . 磷化铝(AlP)和磷化氢( )都是粮食储备常用的高效熏蒸杀虫剂。
)都是粮食储备常用的高效熏蒸杀虫剂。
(1)AlP遇水蒸气会发生反应放出 气体,该反应的另一种产物的化学式为
气体,该反应的另一种产物的化学式为_______ 。
(2) 具有强还原性,能与
具有强还原性,能与 溶液反应,配平该反应的化学方程式:
溶液反应,配平该反应的化学方程式:_______ 。
_______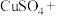 _______
_______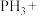 _______
_______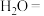 _______
_______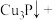 _______
_______ _______
_______
有0.4mol电子转移时被氧化的 的物质的量为
的物质的量为_______ mol。
(3)工业制备 的流程如图所示。
的流程如图所示。

①次磷酸属于_______ 元酸,其化学式为_______ 。
②白磷和烧碱溶液反应的化学方程式为:_______ 。
③若起始时有 参加反应,则整个工业流程中共生成
参加反应,则整个工业流程中共生成_______ 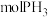 。
。
 )都是粮食储备常用的高效熏蒸杀虫剂。
)都是粮食储备常用的高效熏蒸杀虫剂。(1)AlP遇水蒸气会发生反应放出
 气体,该反应的另一种产物的化学式为
气体,该反应的另一种产物的化学式为(2)
 具有强还原性,能与
具有强还原性,能与 溶液反应,配平该反应的化学方程式:
溶液反应,配平该反应的化学方程式:_______
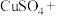 _______
_______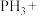 _______
_______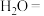 _______
_______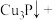 _______
_______ _______
_______
有0.4mol电子转移时被氧化的
 的物质的量为
的物质的量为(3)工业制备
 的流程如图所示。
的流程如图所示。
①次磷酸属于
②白磷和烧碱溶液反应的化学方程式为:
③若起始时有
 参加反应,则整个工业流程中共生成
参加反应,则整个工业流程中共生成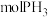 。
。
您最近一年使用:0次



