名校
解题方法
1 . 如图是中学化学常见物质的转化关系,部分物质和反应条件略去。其中A是地壳中含量最多的金属元素的单质,B是一种红棕色粉末;通常情况下,乙为黄绿色气体单质,H是有刺激性气味的气体,在工业上可通过反应⑥在高温高压、催化剂条件下合成;J为难溶于水的红褐色固体;反应⑦在工业上可用于制作印刷电路板。
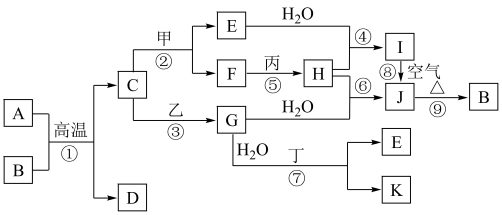
请回答下列问题:
(1)组成物质C的元素在元素周期表中的位置为___________ 。
(2)在反应①~⑨中,不属于氧化还原反应的是___________ 。
(3)写出下列反应的化学方程式:
反应①:___________ 。
反应⑧:___________ 。
(4)写出乙与E在溶液中反应的离子方程式:___________ 。
(5)在E溶液中加入与E等物质的量的一种淡黄色固体,恰好使E转化为J,写出该反应的离子方程式:___________ 。
(6)检验G中阳离子的试剂的化学式为___________ ,反应现象为___________ 。

请回答下列问题:
(1)组成物质C的元素在元素周期表中的位置为
(2)在反应①~⑨中,不属于氧化还原反应的是
(3)写出下列反应的化学方程式:
反应①:
反应⑧:
(4)写出乙与E在溶液中反应的离子方程式:
(5)在E溶液中加入与E等物质的量的一种淡黄色固体,恰好使E转化为J,写出该反应的离子方程式:
(6)检验G中阳离子的试剂的化学式为
您最近一年使用:0次
名校
解题方法
2 . 铜及其化合物在机械制造、国防建设中有着广泛的应用。回答下列问题:
(1)铜元素在元素周期表中的位置是___________ ,已知高温下 比CuO稳定,从核外电子排布角度解释高温下
比CuO稳定,从核外电子排布角度解释高温下 更稳定的原因
更稳定的原因___________ 。
(2)一个 晶胞(见下图)中,晶胞中
晶胞(见下图)中,晶胞中 离子的数目为
离子的数目为___________ 。 和
和 的熔点比较,熔点较高的是
的熔点比较,熔点较高的是___________ ,解释原因___________ 。
(4) 与
与 、
、 、
、 均可形成配位数为4的配离子:
均可形成配位数为4的配离子: 、
、 ,
, 。其转化关系如图所示:
。其转化关系如图所示: 呈黄色,溶液Ⅰ加水稀释呈蓝色,其原因是
呈黄色,溶液Ⅰ加水稀释呈蓝色,其原因是___________ 。
② 与
与 的结合能力
的结合能力___________ (填“>”、“=”或“<”) 与
与 的结合能力。
的结合能力。
③若 中两个
中两个 分别被
分别被 取代,能得到(m)、(n)两种不同结构的
取代,能得到(m)、(n)两种不同结构的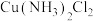 ;
; 的空间构型是
的空间构型是___________ ;。
在有机溶剂的溶解度:(m)___________ (n)(填“>”、“=”或“<”)。
(5)Cu是叶绿素的必要成分,叶绿素的结构如下图,请回答相关问题: 与N原子之间形成的化学键称为
与N原子之间形成的化学键称为___________ 。
②构成叶绿素的非金属元素中,N和O第一电离能较大的为___________ ,请从原子结构角度解释原因___________ 。
(1)铜元素在元素周期表中的位置是
 比CuO稳定,从核外电子排布角度解释高温下
比CuO稳定,从核外电子排布角度解释高温下 更稳定的原因
更稳定的原因(2)一个
 晶胞(见下图)中,晶胞中
晶胞(见下图)中,晶胞中 离子的数目为
离子的数目为
 和
和 的熔点比较,熔点较高的是
的熔点比较,熔点较高的是(4)
 与
与 、
、 、
、 均可形成配位数为4的配离子:
均可形成配位数为4的配离子: 、
、 ,
, 。其转化关系如图所示:
。其转化关系如图所示: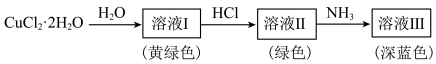
 呈黄色,溶液Ⅰ加水稀释呈蓝色,其原因是
呈黄色,溶液Ⅰ加水稀释呈蓝色,其原因是②
 与
与 的结合能力
的结合能力 与
与 的结合能力。
的结合能力。③若
 中两个
中两个 分别被
分别被 取代,能得到(m)、(n)两种不同结构的
取代,能得到(m)、(n)两种不同结构的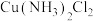 ;
;
 的空间构型是
的空间构型是在有机溶剂的溶解度:(m)
(5)Cu是叶绿素的必要成分,叶绿素的结构如下图,请回答相关问题:

 与N原子之间形成的化学键称为
与N原子之间形成的化学键称为②构成叶绿素的非金属元素中,N和O第一电离能较大的为
您最近一年使用:0次
解题方法
3 . 铁及其化合物在生产、生活中有着重要作用。按要求回答下列问题。
(1)基态Fe原子的价层电子排布式为___________ ;铁元素在元素周期表中的位置是___________ ,属于___________ 区。
(2)铁及其化合物A~E的分类分布及其转化关系如下图所示:
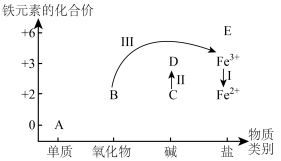
①从图中(A~E)选择反应物,实现Ⅰ的转化,写出反应Ⅰ的离子方程式:___________ 。
②预测物质E中铁元素具有___________ (填“氧化性”或“还原性”)。
③写出反应Ⅱ的化学方程式:___________ 。
④实现反应Ⅲ的转化,可选择含N元素的试剂为___________ 。
(3)探究铁盐X的组成与性质(忽略过程中氧气的参与)
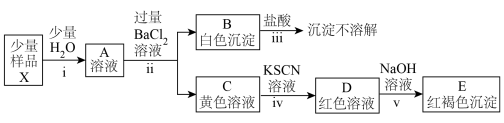
①由步骤ⅰ及其现象可推知铁盐X的物理性质:___________ 。
②由步骤ⅱ、ⅲ及其现象可推知该铁盐X中含有的阴离子为___________ 。
③C溶液呈黄色,不可能是因其体系中含有的___________ 、___________ 、___________ 、___________ (填离子符号)所致;
而可能是因其体系中含有的___________ 、___________ (填粒子的化学式)等所致。
④由步骤iv、v及其现象,体系中与 结合能力最强的离子是
结合能力最强的离子是___________ 。
(1)基态Fe原子的价层电子排布式为
(2)铁及其化合物A~E的分类分布及其转化关系如下图所示:

①从图中(A~E)选择反应物,实现Ⅰ的转化,写出反应Ⅰ的离子方程式:
②预测物质E中铁元素具有
③写出反应Ⅱ的化学方程式:
④实现反应Ⅲ的转化,可选择含N元素的试剂为
(3)探究铁盐X的组成与性质(忽略过程中氧气的参与)

①由步骤ⅰ及其现象可推知铁盐X的物理性质:
②由步骤ⅱ、ⅲ及其现象可推知该铁盐X中含有的阴离子为
③C溶液呈黄色,不可能是因其体系中含有的
而可能是因其体系中含有的
④由步骤iv、v及其现象,体系中与
 结合能力最强的离子是
结合能力最强的离子是
您最近一年使用:0次
名校
解题方法
4 . 中学化学中几种常见物质的转化关系如下:
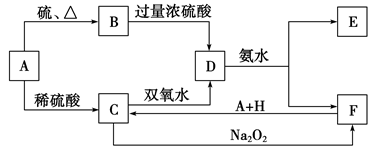
将饱和D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)A、B、H的化学式:A___________ ;B___________ ;H___________ 。
(2)A元素在元素周期表中的位置为:___________ ;红褐色胶体中F粒子直径大小的范围:___________ 。
(3)①Na2O2的电子式:___________ ;NH3极易溶于水的原因:___________ 。
②写出C的酸性溶液与双氧水反应的离子方程式:___________ 。
(4)写出鉴定E中阳离子的实验方法和现象:___________ 。

将饱和D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)A、B、H的化学式:A
(2)A元素在元素周期表中的位置为:
(3)①Na2O2的电子式:
②写出C的酸性溶液与双氧水反应的离子方程式:
(4)写出鉴定E中阳离子的实验方法和现象:
您最近一年使用:0次
5 . 氟他胺 G 是一种可用于治疗肿瘤的药物。实验室由芳香烃 A 制备 G 的合成路线如下:
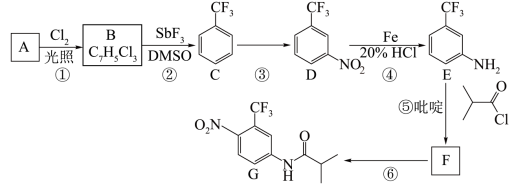
回答下列问题:
(1)C 的名称是_____________ 。
(2)③的反应试剂和反应条件分别是_____________ ,该反应类型是_____________ 。
(3)⑤的反应方程式为______________ 。
(4)G 的分子式为_____________ 。
(5)H 是G 的同分异构体,其苯环上的取代基与G 的相同但位置不同,则H 可能的结构有_____________ 种。
(6)4-甲氧基乙酰苯胺(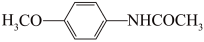 )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(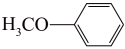 )制备 4-甲氧基乙酰苯胺的合成路线
)制备 4-甲氧基乙酰苯胺的合成路线______________ (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件,其他试剂任选)

回答下列问题:
(1)C 的名称是
(2)③的反应试剂和反应条件分别是
(3)⑤的反应方程式为
(4)G 的分子式为
(5)H 是G 的同分异构体,其苯环上的取代基与G 的相同但位置不同,则H 可能的结构有
(6)4-甲氧基乙酰苯胺(
 )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚( )制备 4-甲氧基乙酰苯胺的合成路线
)制备 4-甲氧基乙酰苯胺的合成路线
您最近一年使用:0次
解题方法
6 . A、B、C是中学化学中常见的物质,且A、B、C均含有同一种元素,在一定条件下相互转化关系如下图所示(部分产物已略去)。请回答:
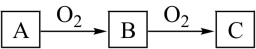
(1)若B是无色气体,C是红棕色气体。
① A、B、C所含相同元素在元素周期表中的位置是______ 。
② 下列说法正确的是______ (填字母)。
a.常温下,A为无色气体
b.A、B、C中所含相同元素的化合价依次升高
c.C与水反应只做还原剂。
③若A是化合物,写出由A氧化生产B的化学方程式__________________ 。
(2)若B是一种有刺激性气味的有毒气体,C与水反应生成硫酸
① A、B、C所含相同元素的原子结构示意图是______ 。
② 下列说法不正确的是______ (填字母)。
a.A一定是黄色晶体
b.可以用上述转化关系制备硫酸
c.B与水反应做还原剂。
③C的水溶液与氢氧化钠的反应为______________ (填吸热或放热)反应。
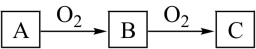
(1)若B是无色气体,C是红棕色气体。
① A、B、C所含相同元素在元素周期表中的位置是
② 下列说法正确的是
a.常温下,A为无色气体
b.A、B、C中所含相同元素的化合价依次升高
c.C与水反应只做还原剂。
③若A是化合物,写出由A氧化生产B的化学方程式
(2)若B是一种有刺激性气味的有毒气体,C与水反应生成硫酸
① A、B、C所含相同元素的原子结构示意图是
② 下列说法不正确的是
a.A一定是黄色晶体
b.可以用上述转化关系制备硫酸
c.B与水反应做还原剂。
③C的水溶液与氢氧化钠的反应为
您最近一年使用:0次
2020-07-07更新
|
197次组卷
|
2卷引用:天津市河东区三校2020-2021学年高一下学期期中联考化学试题
名校
7 . Ⅰ.形式一:(由粒子数推断)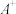 、
、 、
、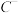 、D、E 5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①
、D、E 5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①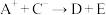 ;②
;② 。据此,回答下列问题:写出
。据此,回答下列问题:写出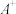 、
、 的化学式:
的化学式:____ 、______ 、
Ⅱ. 形式二:(由元素原子结构推断)A、B、C、D、E、F的原子序数依次增大,它们都是同周期的元素。已知:A、C、F 三种原子最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多2。
(1)写出下列元素的符号:A________ ,B________ ,E________
(2)F在元素周期表中的位置为___________________________________
(3)写出C的单质和A的最高价氧化物的水化物反应的离子方程式_______
(4)元素的非金属性为(原子的得电子能力):E________ F(填“强于”或“弱于”),请以E、F为例列举元素非金属性强弱的比较方法__________________________________________________ (至少2条)
通过Ⅱ的解题你认为推断出本题各元素的关键环节为___________
III.形式三:(由元素位置推断)下表为元素周期表的一部分:
请参照元素①-⑧在表中的位置,用化学用语 回答下列问题:
(1)请画出元素⑦的离子结构示意图________________ 。
(2)写出元素⑤在周期表中的位置______________ 。
(3)②、③、⑥的离子半径由大到小的顺序为_________________________ 。
(4)⑤、⑥、⑦的最高价氧化物对应水化物酸性由强到弱的顺序是______ 。
(5)①、②、③三种元素可形成既含离子键又含极性共价键的化合物,写出该化合物的电子式:____________________ 。该化合物与④的最高价氧化物反应的离子方程式为____________________ 。
(6)请你预测:如果发现了原子序数为116号元素,它在周期表中的位置是第________ 周期_______ 族,它属于_____ 元素(填“金属”或“非金属”)
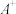 、
、 、
、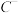 、D、E 5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①
、D、E 5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:① ;②
;② 。据此,回答下列问题:写出
。据此,回答下列问题:写出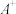 、
、 的化学式:
的化学式:Ⅱ. 形式二:(由元素原子结构推断)A、B、C、D、E、F的原子序数依次增大,它们都是同周期的元素。已知:A、C、F 三种原子最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多2。
(1)写出下列元素的符号:A
(2)F在元素周期表中的位置为
(3)写出C的单质和A的最高价氧化物的水化物反应的离子方程式
(4)元素的非金属性为(原子的得电子能力):E
通过Ⅱ的解题你认为推断出本题各元素的关键环节为
III.形式三:(由元素位置推断)下表为元素周期表的一部分:
族 周期 | ||||||||
| 1 | ① | |||||||
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
请参照元素①-⑧在表中的位置,用
(1)请画出元素⑦的离子结构示意图
(2)写出元素⑤在周期表中的位置
(3)②、③、⑥的离子半径由大到小的顺序为
(4)⑤、⑥、⑦的最高价氧化物对应水化物酸性由强到弱的顺序是
(5)①、②、③三种元素可形成既含离子键又含极性共价键的化合物,写出该化合物的电子式:
(6)请你预测:如果发现了原子序数为116号元素,它在周期表中的位置是第
您最近一年使用:0次
名校
8 . Ⅰ.形式一:(由粒子数推断)A+、B+、C-、D、E5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①A++ C-→D+E;②B++C-→2D。据此,回答下列问题:写出A+、B+的化学式:____________ 、____________ 。
Ⅱ. 形式二:(由元素原子结构推断)A、B、C、D、E、F的原子序数依次增大,它们都是同周期的元素。已知:A、C、F三种原子最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多2。
(1)写出下列元素的符号:A________ ,B________ ,E________ 。
(2)F在元素周期表中的位置为___________________________________ 。
(3)写出C的单质和A的最高价氧化物的水化物反应的离子方程式_______ 。
(4)元素的非金属性为(原子的得电子能力):E________ F(填“强于”或“弱于”),请以E、F为例列举元素非金属性强弱的比较方法_________________ 、___________________ (至少2条)。
(学法题)通过Ⅱ的解题你认为推断出本题各元素的关键环节为___________ 。
III.形式三:(由元素位置推断)下表为元素周期表的一部分:
请参照元素①-⑧在表中的位置,用化学用语 回答下列问题:
(1)请画出元素⑦的离子结构示意图________________ 。
(2)写出元素⑤在周期表中的位置______________ 。
(3)②、③、⑥的离子半径由大到小的顺序为_________________________ 。
(4)⑤、⑥、⑦的最高价氧化物对应水化物酸性由强到弱的顺序是______ 。
(5)①、②、③三种元素形成化合物与④的最高价氧化物反应的离子方程式为_________ 。
(6)请你预测:如果发现了原子序数为116号元素,它在周期表中的位置是第________ 周期_______ 族,它属于_____ 元素(填“金属”或“非金属”)。
Ⅱ. 形式二:(由元素原子结构推断)A、B、C、D、E、F的原子序数依次增大,它们都是同周期的元素。已知:A、C、F三种原子最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多2。
(1)写出下列元素的符号:A
(2)F在元素周期表中的位置为
(3)写出C的单质和A的最高价氧化物的水化物反应的离子方程式
(4)元素的非金属性为(原子的得电子能力):E
(学法题)通过Ⅱ的解题你认为推断出本题各元素的关键环节为
III.形式三:(由元素位置推断)下表为元素周期表的一部分:
| 族 周期 | ||||||||
| 1 | ① | |||||||
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
(1)请画出元素⑦的离子结构示意图
(2)写出元素⑤在周期表中的位置
(3)②、③、⑥的离子半径由大到小的顺序为
(4)⑤、⑥、⑦的最高价氧化物对应水化物酸性由强到弱的顺序是
(5)①、②、③三种元素形成化合物与④的最高价氧化物反应的离子方程式为
(6)请你预测:如果发现了原子序数为116号元素,它在周期表中的位置是第
您最近一年使用:0次
解题方法
9 . A→J有如图所示的转化关系(反应条件、部分反应物和产物已忽略):其中A、D为银白色金属单质;B为淡黄色粉末,C为红棕色粉末,E为黑色晶体;H久置于空气中,由白色固体变为灰绿色,最终变成红褐色Ⅰ;B和I在一定条件下反应生成J,J的化学式为Na2FeO4,它能够杀菌消毒,是一种优良的净水剂。
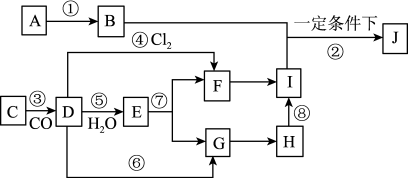
(1) (1)写出物质B的电子式_______ ;D元素在元素周期表中的位置为_______
(填写哪个周期和哪个族),写出物质B与水反应的化学方程式_______
(2) (2)写出下列反应的化学反应方程式:
⑤__________________________________________________________
⑧________________________________________________________________
(3) (3)写出反应的离子方程式:⑦_______
(4) (4)在①−⑧的所有反应中,属于非氧化还原反应的有(填序号)_______
(5) (5)根据Na2FeO4元素的价态及反应前后的产物推测Na2FeO4杀菌消毒做净水剂的原因_______________________________________

(1) (1)写出物质B的电子式
(填写哪个周期和哪个族),写出物质B与水反应的化学方程式
(2) (2)写出下列反应的化学反应方程式:
⑤
⑧
(3) (3)写出反应的离子方程式:⑦
(4) (4)在①−⑧的所有反应中,属于非氧化还原反应的有(填序号)
(5) (5)根据Na2FeO4元素的价态及反应前后的产物推测Na2FeO4杀菌消毒做净水剂的原因
您最近一年使用:0次
解题方法
10 . 短周期主族元素A、B、C、D、E、G的原子序数依次增大,在元素周期表中A的原子半径最小(稀有气体元素除外),B与C相邻且C的最外层电子数是次外层的3倍,C、D的最外层电子数之和与G的最外层电子数相等,E是地壳中含量最多的金属元素。回答下列问题:
(1)C在元素周期表中的位置是_________ 周期、_________ 族;G的元素符号是_________ 。
(2)B的原子结构示意图是_________ ;C与D组成的既含离子键又含共价键的化合物电子式是_________ 。
(3)E单质能与D的最高价氧化物的水化物浓溶液反应放出氢气,反应的化学方程式是__________________ ;由上述六种元素中的三种组成的某种盐,水溶液显碱性,将该盐溶液滴入硫酸酸化的KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式是__________________ 。
(4)由A、B、C、E中的某些元素组成的化合物X、Y、Z、W有如下转化关系:
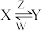
X、Y、Z、W中均由三种元素组成,Z是一种强酸,则Z的化学式是___________ ,Y溶液与过量W反应的离子方程式是___________________________________ 。
(1)C在元素周期表中的位置是
(2)B的原子结构示意图是
(3)E单质能与D的最高价氧化物的水化物浓溶液反应放出氢气,反应的化学方程式是
(4)由A、B、C、E中的某些元素组成的化合物X、Y、Z、W有如下转化关系:
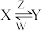
X、Y、Z、W中均由三种元素组成,Z是一种强酸,则Z的化学式是
您最近一年使用:0次



