名校
解题方法
1 . 下列实验方案的设计能达到相应实验目的的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 验证 的氧化性强于 的氧化性强于 | 向 溶液中通入少量 溶液中通入少量 |
| B | 比较HF与 的酸性强弱 的酸性强弱 | 常温下,用pH试纸分别测定浓度均为 的 的 溶液和 溶液和 溶液的pH 溶液的pH |
| C | 验证 与KI的反应是可逆反应 与KI的反应是可逆反应 | 向 溶液中滴加 溶液中滴加 溶液,充分反应后,取少许混合液滴加KSCN溶液 溶液,充分反应后,取少许混合液滴加KSCN溶液 |
| D | 比较Fe与Cu的金属活动性 | 常温下,将Fe、Cu与浓硝酸组成原电池 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-05-09更新
|
1135次组卷
|
4卷引用:黑龙江省大兴安岭实验中学2021-2022学年高三上学期期末考试化学试题
2 . 石蜡油分解可产生乙烯。乙烯是一种重要的化工原料,某同学设计实验探究工业制备乙烯的原理和乙烯的主要化学性质,实验装置如图所示。
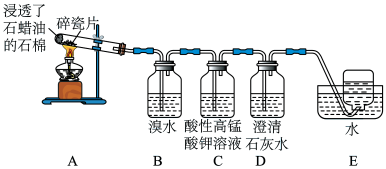
(1)用化学反应方程式解释B装置中的实验现象:_________ 。
(2)C装置中的现象是_________ ,其发生反应的类型是__________ 。
(3)查阅资料可知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置_______ (填序号)中的实验现象可判断该资料是否真实。

(1)用化学反应方程式解释B装置中的实验现象:
(2)C装置中的现象是
(3)查阅资料可知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置
您最近一年使用:0次
2020-04-11更新
|
576次组卷
|
3卷引用:黑龙江省大兴安岭实验中学(西校区)2020-2021学年高一下学期期中考试化学试题
3 . 某化学小组用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
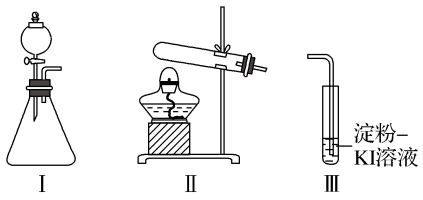
供选试剂:质量分数为30%的H2O2溶液、0.1 mol·L-1的H2SO4溶液、MnO2固体、KMnO4固体。
(1)小组同学设计甲、乙、丙三组实验,记录如下:
(2)丙实验中O2与KI溶液反应的离子方程式为_____________ 。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是_____ 。为进一步探究该条件对反应速率的影响,可采取的实验措施是____________ 。
(4)由甲、乙、丙三组实验推测,甲实验中可能是_____ 使溶液变蓝。为了验证推测,可将装置Ⅰ中产生的气体通入_____ (填字母)溶液中,依据实验现象来证明。
A.酸性KMnO4 B.FeCl2 C.H2S
(5)资料显示:KI溶液在空气中久置的过程中会被缓慢氧化:4KI+O2+2H2O=2I2+4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应__________ (写离子方程式)造成的,请设计实验证明他们的猜想是否正确:__________ 。

供选试剂:质量分数为30%的H2O2溶液、0.1 mol·L-1的H2SO4溶液、MnO2固体、KMnO4固体。
(1)小组同学设计甲、乙、丙三组实验,记录如下:
| 操作 | 现象 | |
| 甲 | 向装置Ⅰ的锥形瓶中加入MnO2固体,向装置Ⅰ的 | 装置Ⅰ中产生无色气体并伴随大量白雾;装置Ⅲ中有气泡冒出,溶液迅速变蓝 |
| 乙 | 向装置Ⅱ中加入KMnO4固体,连接装置Ⅱ、Ⅲ,点燃酒精灯 | 装置Ⅲ中有气泡冒出,溶液不变蓝 |
| 丙 | 向装置Ⅱ中加入 | 装置Ⅲ中有气泡冒出,溶液变蓝 |
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是
(4)由甲、乙、丙三组实验推测,甲实验中可能是
A.酸性KMnO4 B.FeCl2 C.H2S
(5)资料显示:KI溶液在空气中久置的过程中会被缓慢氧化:4KI+O2+2H2O=2I2+4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应
您最近一年使用:0次
名校
4 . 单质X和Y相互反应生成X 2+ 和 Y2-,现有下列叙述:(a)X被氧化;(b)X是氧化剂;(c)X具有氧化性;(d)Y2-是还原产物;(e)Y2-具有还原性;(f)X2+具有氧化性。其中正确的是
| A.(a)(b)(c)(d) | B.(b)(c)(d) |
| C.(a)(d)(e)(f) | D.(a)(c)(d)(e) |
您最近一年使用:0次
名校
5 . 按下图装置进行实验,可证明碳与浓硫酸反应放出的气体是SO2和CO2。
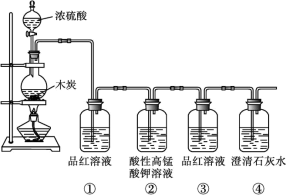
(1)木炭与浓硫酸反应的化学方程式是___________ ,该反应的氧化剂为___________ (填化学式)。
(2)洗气瓶①②中溶液褪色,体现的二氧化硫的性质依次为___________(填字母)。

(1)木炭与浓硫酸反应的化学方程式是
(2)洗气瓶①②中溶液褪色,体现的二氧化硫的性质依次为___________(填字母)。
| A.氧化性、还原性 | B.漂白性、还原性 |
| C.漂白性、氧化性 | D.还原性、漂白性 |
您最近一年使用:0次
名校
解题方法
6 . 下列说法正确的是( )
| A.元素处于最高价时,该物质一定具有强氧化性 |
| B.某元素从游离态变为化合态,该元素一定被氧化 |
| C.金属阳离子只具有氧化性,不具有还原性 |
| D.氧化还原反应中不一定所有元素的化合价都发生变化 |
您最近一年使用:0次
2020-08-24更新
|
60次组卷
|
3卷引用:黑龙江省大兴安岭漠河县高级中学2019-2020学年高一上学期第二次月考化学试题
7 . 下列实验“操作和现象”与“结论”对应关系正确的是
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向酸性KMnO4溶液中滴加双氧水,紫色消失 | H2O2具有氧化性 |
| B | 氯气通入紫色石蕊试液中,溶液先变红后褪色 | 氯水有酸性,氯气有漂白性 |
| C | 将NaOH溶液滴加到饱和FeC13溶液中呈红褐色 | 制Fe(OH)3胶体 |
| D | 向Fe2(SO4)3溶液中加入铜粉,固体溶解,溶液变蓝 | Fe3+氧化性强于Cu2+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
8 . 某研究小组为探究元素周期表中元素性质的递变规律,设计了如下实验。
(1)将钠、钾、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:________ 与盐酸反应最剧烈,________ 与盐酸反应的速度最慢,________ 与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为_______________ 。
(3)资料显示:钠、镁、铝都可以用于制备储氢的金属氢化物。
① NaH是离子化合物,能与水发生氧化还原反应生成H2,该反应的还原剂是________________ 。
② NaAlH4是一种良好的储氢材料。NaAlH4与水反应产生氢气的化学方程式为____________________ 。
(1)将钠、钾、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为
(3)资料显示:钠、镁、铝都可以用于制备储氢的金属氢化物。
① NaH是离子化合物,能与水发生氧化还原反应生成H2,该反应的还原剂是
② NaAlH4是一种良好的储氢材料。NaAlH4与水反应产生氢气的化学方程式为
您最近一年使用:0次
2020-01-19更新
|
81次组卷
|
2卷引用:黑龙江省大兴安岭漠河县第一中学2018-2019学年高一上学期期中考试化学试题
9 . 氰基丙烯酸酯在碱性条件下能快速聚合为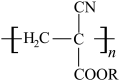 ,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
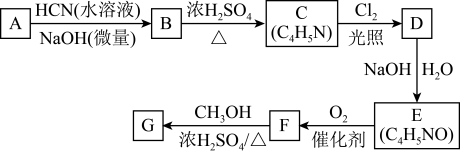
已知:①A的相对分子量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰
②
回答下列问题:
(1)A的化学名称为_______ 。
(2)B的结构简式为____ ,其核磁共振氢谱显示为_____ 组峰,峰面积比为_______ 。
(3)由C生成D的反应类型为_______ 。
(4)由D生成E的化学方程式为_______ 。
(5)G中的官能团有_______ 、 _______ 、_______ 。(填官能团名称)
 ,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
已知:①A的相对分子量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰
②

回答下列问题:
(1)A的化学名称为
(2)B的结构简式为
(3)由C生成D的反应类型为
(4)由D生成E的化学方程式为
(5)G中的官能团有
您最近一年使用:0次
名校
解题方法
10 . 根据以下几个反应:①Cl2+2KI=2KC1+I2②2FeCl2+Cl2=2FeCl3③2FeCl3+2KI=2FeCl2+2KC1+I2判断氧化性由强到弱的顺序是
| A.Cl2>I2>Fe3+ | B.Cl2>Fe3+>I2 | C.Fe3+>Cl2>I2 | D.Fe3+>I2>Cl2 |
您最近一年使用:0次
2021-11-25更新
|
84次组卷
|
10卷引用:黑龙江省大兴安岭漠河县高级中学2019-2020学年高一上学期第二次月考化学试题
黑龙江省大兴安岭漠河县高级中学2019-2020学年高一上学期第二次月考化学试题2015-2016学年四川省资阳市高一上学期期末质检化学试卷2016-2017学年黑龙江省虎林市高级中学高一下学期第二次月考化学试卷贵州省安顺市普定县第一中学2018-2019学年高一上学期12月份考试化学试题陕西省咸阳百灵中学2019-2020学年高一上学期期中考试化学试题云南省玉溪市江川二中2019-2020学年高一上学期期中考试化学试题宁夏育才中学学益校区2019-2020学年高一上学期第二次月考化学试题陕西省咸阳百灵中学2019-2020学年高一上学期第二次月考化学试题河北省石家庄市第十八中学2021-2022学年高一上学期期中考试化学试题新疆伊犁哈萨克自治州奎屯市第一高级中学2023-2024学年高三上学期9月月考化学试题



