名校
解题方法
1 . A、B、C、D、E、F、G为中学化学常见物质,它们之间有如图转化关系(反应条件已略去)。已知:A、C、D、E均含有同种非金属元素M,A为气态氢化物;G是一种紫红色的金属单质;B是空气的组成成分,在空气中占比约为21%。根据学知识,按要求回答下列问题:
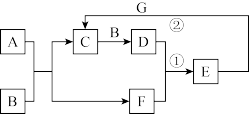
I.若A具有臭鸡蛋气味,且能与C反应生成一种淡黄色非金属单质,反应①为非氧化还原反应,反应②为E的浓溶液与G反应,则:
(1)M元素在元素周期表中的位置为______ 。
(2)写出反应②的化学方程式:_____ ,该反应中体现了E的浓溶液的强氧化性和_____ 性。
(3)将C通入足量溴水中,发生反应的离子方程式为_____ ;将C通入少量品红溶液中可观察到的现象为_____ 。
II.若光照条件下,E的浓溶液易分解得到B、D、F三种物质;大量排放汽车尾气中的C、D会导致光化学烟雾,已知:反应②为E的稀溶液与G反应。
(4)写出A+B→C+F的化学方程式:______ 。

I.若A具有臭鸡蛋气味,且能与C反应生成一种淡黄色非金属单质,反应①为非氧化还原反应,反应②为E的浓溶液与G反应,则:
(1)M元素在元素周期表中的位置为
(2)写出反应②的化学方程式:
(3)将C通入足量溴水中,发生反应的离子方程式为
II.若光照条件下,E的浓溶液易分解得到B、D、F三种物质;大量排放汽车尾气中的C、D会导致光化学烟雾,已知:反应②为E的稀溶液与G反应。
(4)写出A+B→C+F的化学方程式:
您最近一年使用:0次
名校
解题方法
2 . 结构决定性质是元素周期律和有机化学中展现的淋漓尽致,是高中化学重要思想。
Ⅰ.一种扇形元素周期表的一部分如图所示。字母a~n表示元素周期表中的对应元素。
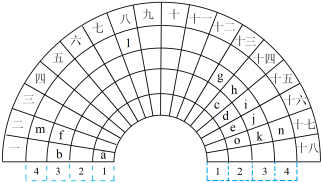
(1)元素n在元素周期表中的位置___________ 。
(2)比较f、o、k简单离子的半径,由大到小的顺序是___________ (用离子符号表示)。
(3)b与e组成的化合物中,含有非极性共价键的化合物的电子式___________ 。
(4)i的最高价氧化物对应水化物的化学式___________ ,i、d的最简单氢化物中稳定性更高的为___________ (用化学式表示)。
Ⅱ.A、B、C、D是四种常见的有机物,其中A的产量通常用来衡量一个国家的石油化工发展水平,B与C在浓硫酸和加热条件下发生反应,生成的有机物有特殊香味;A、B、C、D在一定条件下的转化关系如图所示(反应条件已省略):
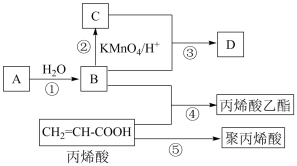
(5)A的结构简式为___________ ,C中官能团的名称为___________ 。
(6)丙烯酸乙酯的结构简式为___________ 。
(7)写出反应①化学方程式和有机反应基本类型:___________ ,___________ 反应。
(8)写出反应⑤化学方程式和有机反应基本类型:___________ ,___________ 反应。
Ⅰ.一种扇形元素周期表的一部分如图所示。字母a~n表示元素周期表中的对应元素。

(1)元素n在元素周期表中的位置
(2)比较f、o、k简单离子的半径,由大到小的顺序是
(3)b与e组成的化合物中,含有非极性共价键的化合物的电子式
(4)i的最高价氧化物对应水化物的化学式
Ⅱ.A、B、C、D是四种常见的有机物,其中A的产量通常用来衡量一个国家的石油化工发展水平,B与C在浓硫酸和加热条件下发生反应,生成的有机物有特殊香味;A、B、C、D在一定条件下的转化关系如图所示(反应条件已省略):

(5)A的结构简式为
(6)丙烯酸乙酯的结构简式为
(7)写出反应①化学方程式和有机反应基本类型:
(8)写出反应⑤化学方程式和有机反应基本类型:
您最近一年使用:0次
解题方法
3 . A、B、C、D.E五种元素中,A、B、C、D为原子序数依次增大的短周期主族元素,A的电子层数等于其最外层电子数且在同周期中A的原子半径最小, B、C、D元素的常见单质均为气体,其中B、C的单质是空气的主要成分,D与其他元素不在同一周期,E为常见使用量最大的金属。在一定条件下,A的单质可以分别与C、D的单质化合生成甲、乙。各物质间有如图转化关系,回答下列问题:
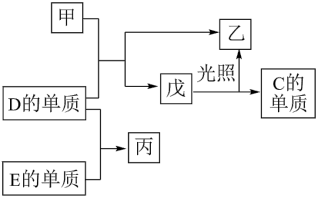
(1)D在元素周期表中的位置为_______ 。
(2)写出B的单质的电子式:_______ 。
(3)戊的分子中D元素的化合价为_______ 。写出戊在光照条件下发生反应的化学方程式:_______ 。
(4)A、B、C三种元素的原子半径从大到小的顺序为_______ (用元素符号表示)。
(5)钠在C的气体中燃烧可以生成淡黄色固体,该物质中阳离子与阴离子的个数比为_______

(1)D在元素周期表中的位置为
(2)写出B的单质的电子式:
(3)戊的分子中D元素的化合价为
(4)A、B、C三种元素的原子半径从大到小的顺序为
(5)钠在C的气体中燃烧可以生成淡黄色固体,该物质中阳离子与阴离子的个数比为
您最近一年使用:0次
4 . 镓是一种低熔点、高沸点的稀有金属,有“电子工业脊梁”的美誉,被广泛应用到光电子工业和微波通信工业。回答下列问题:
(1)镓 的原子结构示意图为
的原子结构示意图为 ,镓元素在元素周期表中的位置是
,镓元素在元素周期表中的位置是_______ 。
(2) 的熔点为1238℃,且熔融状态不导电,据此判断,该化合物是
的熔点为1238℃,且熔融状态不导电,据此判断,该化合物是_______ (填“共价化合物”或“离子化合物”)。
(3)已知 与
与 同周期,
同周期, 与N同主族。
与N同主族。
①用原子结构理论推测, 中
中 元素的化合价为
元素的化合价为_______ ;
②下列事实不能用元素周期律解释的是_______ (填标序号);
a.原子半径: b.热稳定性:
b.热稳定性: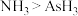
c.碱性: d.酸性:
d.酸性: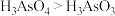
(4) 是一种直接能隙的半导体,自1990年起常用在发光二极管中。一种镍催化法生产
是一种直接能隙的半导体,自1990年起常用在发光二极管中。一种镍催化法生产 的工艺如图。
的工艺如图。_______ 。
(1)镓
 的原子结构示意图为
的原子结构示意图为 ,镓元素在元素周期表中的位置是
,镓元素在元素周期表中的位置是(2)
 的熔点为1238℃,且熔融状态不导电,据此判断,该化合物是
的熔点为1238℃,且熔融状态不导电,据此判断,该化合物是(3)已知
 与
与 同周期,
同周期, 与N同主族。
与N同主族。①用原子结构理论推测,
 中
中 元素的化合价为
元素的化合价为②下列事实不能用元素周期律解释的是
a.原子半径:
 b.热稳定性:
b.热稳定性: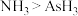
c.碱性:
 d.酸性:
d.酸性: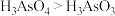
(4)
 是一种直接能隙的半导体,自1990年起常用在发光二极管中。一种镍催化法生产
是一种直接能隙的半导体,自1990年起常用在发光二极管中。一种镍催化法生产 的工艺如图。
的工艺如图。
①“热转化”时 转化为
转化为
 化学方程式是
化学方程式是
您最近一年使用:0次
名校
5 . W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,且四种元素的原子最外层电子数之和为24。以上元素都是工业生产中的常见元素,工业生产中常会产生废气、废水需要无害化处理后再排放。
推进含W元素物质转化的研究对改善人类的生存环境具有重要意义。W元素的固定指的是游离态的W转化为化合态的W,一种新型人工合成固定W元素的原理如图。
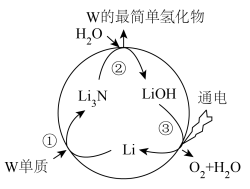
下列说法正确的是:
| W | X | |
| Y | Z |

下列说法正确的是:
| A.该转化过程①②③反应均为氧化还原反应 |
B.假设每一步均完全转化,每生成 ,同时生成 ,同时生成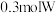 的最简单氢化物 的最简单氢化物 |
C. 的碱性在同主族元素的最高价氧化物的水化物中碱性最弱 的碱性在同主族元素的最高价氧化物的水化物中碱性最弱 |
| D.该过程的总反应中W的单质置换出氧气,说明W的非金属性比氧强 |
您最近一年使用:0次
名校
解题方法
6 . 1869年门捷列夫根据当时已有的元素编制出第一张元素周期表,他在适当的位置预留下空格,并预言了新元素的性质。后来锗与镓的发现对元素周期律有力的证明。锗、镓元素能形成一些无机化合物(如Na2GeO3、GaCl3、GaN等),回答下列问题:
(1)基态锗原子价层电子排布式为___________ ,Na2GeO3中锗原子的杂化方式为___________ 。
(2)GaCl3分子的空间结构为___________ ,与其互为等电子体的一种常见离子是___________ 。(填化学式)
(3)化学家利用图丁反应首次成功合成纯碳环C18。下列说法正确的是___________(填字母标号)。
(4)在药物化学中,某些饱和碳上的氢原子被甲基替换后,对分子的药性、代谢等产生显著影响作用,这种现象被称为“甲基化效应”,例如:

以上A、B两种分子结构中属于手性分子的是___________ (填字母序号)
(5)GaN被誉为21世纪引领5 G时代的基石材料,是目前全球半导体研究的前沿和热点。有一种氮化镓的六方晶胞结构如图所示,其晶胞参数: ,
,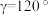 。已知:该晶体的密度为
。已知:该晶体的密度为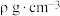 ,晶胞底边边长为acm,高为bcm,则阿伏加德罗常数为
,晶胞底边边长为acm,高为bcm,则阿伏加德罗常数为___________  (用含a、b、
(用含a、b、 的代数式表示)。
的代数式表示)。
(1)基态锗原子价层电子排布式为
(2)GaCl3分子的空间结构为
(3)化学家利用图丁反应首次成功合成纯碳环C18。下列说法正确的是___________(填字母标号)。

| A.C24O6和C18均为非极性分子 |
| B.C22O4分子中碳原子的杂化方式有3种 |
| C.C20O2晶体中所含σ键类型为p-pσ键和s-pσ键有 |
| D.图丁中涉及的物质都是分子晶体 |
(4)在药物化学中,某些饱和碳上的氢原子被甲基替换后,对分子的药性、代谢等产生显著影响作用,这种现象被称为“甲基化效应”,例如:

以上A、B两种分子结构中属于手性分子的是
(5)GaN被誉为21世纪引领5 G时代的基石材料,是目前全球半导体研究的前沿和热点。有一种氮化镓的六方晶胞结构如图所示,其晶胞参数:
 ,
,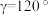 。已知:该晶体的密度为
。已知:该晶体的密度为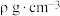 ,晶胞底边边长为acm,高为bcm,则阿伏加德罗常数为
,晶胞底边边长为acm,高为bcm,则阿伏加德罗常数为 (用含a、b、
(用含a、b、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
7 . A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,相关信息如下表:
请用化学用语填空:
(1)A元素在元素周期表中的位置___________ ;C元素和F元素的电负性比较,较小的是___________ (填元素符号)。
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的电子式为___________ ,B元素所形成的单质分子中σ键与π键数目之比为___________ 。
(3)F元素原子的价电子的轨道表示式是___________ ;G的高价阳离子的溶液与H单质反应的离子方程式为___________ ;元素X与元素E在周期表中呈对角线关系,且元素X的最高价氧化物的水化物也具有两性,试写出X元素的最高价氧化物的水化物与D元素的最高价氧化物的水化物反应的化学方程式___________ 。
| 元素 | 元素相关信息 |
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为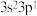 |
| F | 基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
| G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
| H | 是我国使用最早的合金中的最主要元素 |
(1)A元素在元素周期表中的位置
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的电子式为
(3)F元素原子的价电子的轨道表示式是
您最近一年使用:0次
名校
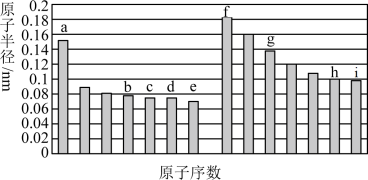
8 . 部分短周期主族元素原子半径与原子序数的关系如图,根据所学知识回答下列问题。 、
、 、
、 、
、 四种元素的最简单氢化物中,最稳定的是
四种元素的最简单氢化物中,最稳定的是________ (填化学式)。
(2) 与
与 能形成一种淡黄色的物质,其电子式为
能形成一种淡黄色的物质,其电子式为________ 。
(3) 的最高价氧化物对应的水化物与
的最高价氧化物对应的水化物与 的最高价氧化物对应的水化物反应的离子方程式为
的最高价氧化物对应的水化物反应的离子方程式为________ 。
(4)由 的单质制成的电池需要注意防水,其原因为
的单质制成的电池需要注意防水,其原因为________ (用化学方程式表示)。
(5)门捷列卡在研究元素周期表时,科学地预言了11种当时尚未发现的元素,他认为 的下一周期存在一种“类
的下一周期存在一种“类 ”元素,该元素多年后被法国化学家发现,命名为镓(Ga),镓在元素周期表中的位置为
”元素,该元素多年后被法国化学家发现,命名为镓(Ga),镓在元素周期表中的位置为________ 。预测 与
与 的最高价氧化物对应水化物的碱性较强的是
的最高价氧化物对应水化物的碱性较强的是________ (填最高价氧化物对应水化物的化学式)。
(6)使用下列装置再添加合适的药品,可以证明 和
和 两种元素的非金属性强弱顺序,可供选择的药品为:①浓硫酸②稀硫酸③盐酸④
两种元素的非金属性强弱顺序,可供选择的药品为:①浓硫酸②稀硫酸③盐酸④ 固体⑤
固体⑤ ⑥澄清石灰水⑦NaOH溶液
⑥澄清石灰水⑦NaOH溶液________ 、丁________ 。
 、
、 、
、 、
、 四种元素的最简单氢化物中,最稳定的是
四种元素的最简单氢化物中,最稳定的是(2)
 与
与 能形成一种淡黄色的物质,其电子式为
能形成一种淡黄色的物质,其电子式为(3)
 的最高价氧化物对应的水化物与
的最高价氧化物对应的水化物与 的最高价氧化物对应的水化物反应的离子方程式为
的最高价氧化物对应的水化物反应的离子方程式为(4)由
 的单质制成的电池需要注意防水,其原因为
的单质制成的电池需要注意防水,其原因为(5)门捷列卡在研究元素周期表时,科学地预言了11种当时尚未发现的元素,他认为
 的下一周期存在一种“类
的下一周期存在一种“类 ”元素,该元素多年后被法国化学家发现,命名为镓(Ga),镓在元素周期表中的位置为
”元素,该元素多年后被法国化学家发现,命名为镓(Ga),镓在元素周期表中的位置为 与
与 的最高价氧化物对应水化物的碱性较强的是
的最高价氧化物对应水化物的碱性较强的是(6)使用下列装置再添加合适的药品,可以证明
 和
和 两种元素的非金属性强弱顺序,可供选择的药品为:①浓硫酸②稀硫酸③盐酸④
两种元素的非金属性强弱顺序,可供选择的药品为:①浓硫酸②稀硫酸③盐酸④ 固体⑤
固体⑤ ⑥澄清石灰水⑦NaOH溶液
⑥澄清石灰水⑦NaOH溶液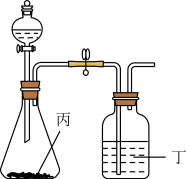
您最近一年使用:0次
名校
9 . 镓是一种低熔点、高沸点的稀有金属,有“电子工业脊梁”的美誉,被广泛应用到光电子工业和微波通信工业.回答下列问题:
(1)镓 的原子结构示意图为
的原子结构示意图为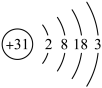 ,镓元素在元素周期表中的位置是
,镓元素在元素周期表中的位置是_________ .
(2) 的熔点为1238℃,且熔融状态不导电,据此判断,该化合物是
的熔点为1238℃,且熔融状态不导电,据此判断,该化合物是_____________ (填“共价化合物”或“离子化合物”).
(3)已知 与
与 同周期,
同周期, 与N同主族.
与N同主族.
①用原子结构理论推测, 中
中 元素的化合价为
元素的化合价为____________ ;
②下列事实不能用元素周期律解释的是___________ (填标序号);
a.原子半径: b.热稳定性:
b.热稳定性: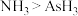
c.碱性: d.酸性:
d.酸性: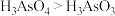
(4) 是一种直接能隙(directbandgap)的半导体,自1990年起常用在发光二极管中.一种镍催化法生产
是一种直接能隙(directbandgap)的半导体,自1990年起常用在发光二极管中.一种镍催化法生产 的工艺如图.
的工艺如图.
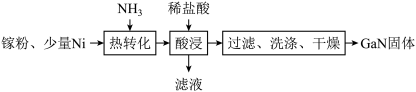
①“热转化”时 转化为
转化为 的化学方程式是
的化学方程式是______________ ;
②“酸浸”操作的目的是_______________ ;
③某学校化学兴趣小组在实验室利用如图装置模拟制备氮化镓:
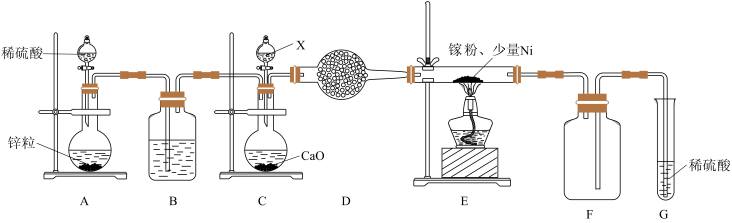
仪器X中的试剂是____________ ;加热前需先通入一段时间的 ,原因是
,原因是____________ ;装置G的作用是___________ .
(1)镓
 的原子结构示意图为
的原子结构示意图为 ,镓元素在元素周期表中的位置是
,镓元素在元素周期表中的位置是(2)
 的熔点为1238℃,且熔融状态不导电,据此判断,该化合物是
的熔点为1238℃,且熔融状态不导电,据此判断,该化合物是(3)已知
 与
与 同周期,
同周期, 与N同主族.
与N同主族.①用原子结构理论推测,
 中
中 元素的化合价为
元素的化合价为②下列事实不能用元素周期律解释的是
a.原子半径:
 b.热稳定性:
b.热稳定性: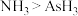
c.碱性:
 d.酸性:
d.酸性: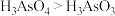
(4)
 是一种直接能隙(directbandgap)的半导体,自1990年起常用在发光二极管中.一种镍催化法生产
是一种直接能隙(directbandgap)的半导体,自1990年起常用在发光二极管中.一种镍催化法生产 的工艺如图.
的工艺如图.
①“热转化”时
 转化为
转化为 的化学方程式是
的化学方程式是②“酸浸”操作的目的是
③某学校化学兴趣小组在实验室利用如图装置模拟制备氮化镓:

仪器X中的试剂是
 ,原因是
,原因是
您最近一年使用:0次
2021-06-11更新
|
492次组卷
|
3卷引用:福建省厦门第二中学2022-2023学年高一下学期4月月考化学试题
名校
10 . 1869年俄国化学家门捷列夫制出第一张元素周期表。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。回答下列问题:
(1)元素Se在元素周期表中的位置为____________ (写明周期数和族序数),汞是80号元素,原子结构示意图如图,汞在第________________ 周期。

(2)Ge的最高正价为____________ ,Bi的最高价氧化物为____________ (填化学式)。
(3)根据元素周期律推断:
①氢化物稳定性最强的卤族元素是____________ (填元素符号)。
② 、
、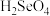 的酸性强弱:
的酸性强弱:
____________ 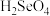 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③氢化物的还原性:
____________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(4)过渡元素中可以寻找到 (填序号)。
(5)① 常用作溶剂,其电子式为
常用作溶剂,其电子式为____________ ,分子空间构型为____________ 。
②镓( )的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列说法正确的是
)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列说法正确的是____________ (填序号)。
A.原子半径: B.N的非金属性比O强 C.Ga的金属性比Al弱 D.As和Sb的氧化物可能是两性氧化物
B.N的非金属性比O强 C.Ga的金属性比Al弱 D.As和Sb的氧化物可能是两性氧化物
(6)甲烷可直接应用于燃料电池,该电池采用可传导 的固体氧化物为电解质,其工作原理如图所示:
的固体氧化物为电解质,其工作原理如图所示:
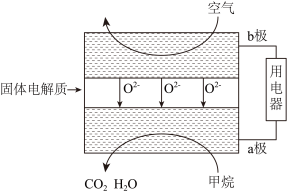
①外电路电子移动方向:__________________ (填“a极到b极”或“b极到a极”)。
②若燃料电池消耗的空气在标准状况下的体积是5.6L(假设空气中 体积分数为20%),则理论上消耗甲烷
体积分数为20%),则理论上消耗甲烷________ mol。
(1)元素Se在元素周期表中的位置为

(2)Ge的最高正价为
(3)根据元素周期律推断:
①氢化物稳定性最强的卤族元素是
②
 、
、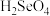 的酸性强弱:
的酸性强弱:
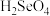 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③氢化物的还原性:

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(4)过渡元素中可以寻找到 (填序号)。
| A.农药 | B.黑色金属 | C.半导体材料 | D.优良的催化剂 |
 常用作溶剂,其电子式为
常用作溶剂,其电子式为②镓(
 )的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列说法正确的是
)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列说法正确的是A.原子半径:
 B.N的非金属性比O强 C.Ga的金属性比Al弱 D.As和Sb的氧化物可能是两性氧化物
B.N的非金属性比O强 C.Ga的金属性比Al弱 D.As和Sb的氧化物可能是两性氧化物(6)甲烷可直接应用于燃料电池,该电池采用可传导
 的固体氧化物为电解质,其工作原理如图所示:
的固体氧化物为电解质,其工作原理如图所示:
①外电路电子移动方向:
②若燃料电池消耗的空气在标准状况下的体积是5.6L(假设空气中
 体积分数为20%),则理论上消耗甲烷
体积分数为20%),则理论上消耗甲烷
您最近一年使用:0次



