名校
解题方法
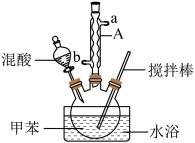
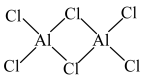
1 . 某同学设计如图所示装置制备一硝基甲苯。
③甲苯的密度0.866g/ml,沸点110.6℃,硝基苯的密度1.20g/ml,沸点210.9℃。
实验步骤如下:
①配制浓硫酸和浓硝酸(按体积比1:3)的混合物(混酸)
②在三颈瓶里装15ml甲苯
③装好其它药品,并组装好仪器
④向三颈烧瓶中加入混酸,并不断搅拌
⑤控制温度,大约反应10min至三颈烧瓶底有大量液体(淡黄色油状)出现
⑥分离出一硝基甲苯。
请回答下列问题:
(1)本实验的关键是控制温度在30℃左右,如果温度过高,产生的后果是_______ 。
(2)仪器A的名称_______ ,浓硫酸的作用_______ ;
(3)三颈烧瓶中甲苯与混酸反应生成间硝基甲苯的化学方程式_______ 。
(4)分离产品方案如下图所示_______ 、______ 。
②操作2的名称是_______ 。
A.过滤 B.蒸馏 C.重结晶 D.萃取
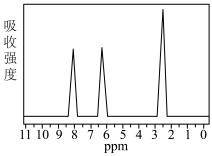
(5)经测定,产品1为一硝基甲苯,其中一种的核磁共振氢谱如图所示,该有机物的结构简式为___ 。
已知:①一硝基甲苯可能的结构简式为 、
、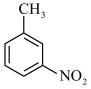 、
、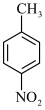 。
。
③甲苯的密度0.866g/ml,沸点110.6℃,硝基苯的密度1.20g/ml,沸点210.9℃。
实验步骤如下:
①配制浓硫酸和浓硝酸(按体积比1:3)的混合物(混酸)
②在三颈瓶里装15ml甲苯
③装好其它药品,并组装好仪器
④向三颈烧瓶中加入混酸,并不断搅拌
⑤控制温度,大约反应10min至三颈烧瓶底有大量液体(淡黄色油状)出现
⑥分离出一硝基甲苯。
请回答下列问题:
(1)本实验的关键是控制温度在30℃左右,如果温度过高,产生的后果是
(2)仪器A的名称
(3)三颈烧瓶中甲苯与混酸反应生成间硝基甲苯的化学方程式
(4)分离产品方案如下图所示

②操作2的名称是
A.过滤 B.蒸馏 C.重结晶 D.萃取
(5)经测定,产品1为一硝基甲苯,其中一种的核磁共振氢谱如图所示,该有机物的结构简式为
您最近一年使用:0次
名校
2 . 近年来美国为了遏制中国发展,对我国发起了以封锁“芯片”为核心的全方位打压,此举激发了中国科技人员自研的决心。回答下列问题:
(1)我国现已能够拉制出直径为300mm、重达81kg的大直径硅单晶,晶体硅材料被大量用于电子产业。 反应生成
反应生成 ,判断
,判断 的沸点比
的沸点比 的
的_______ (填“高”或“低”),理由_______ 。
(2)超高导热绝缘耐高温纳米氮化铝,是制造5G芯片的重要绝缘材料。氮化铝晶体与金刚石类似,每个铝原子与_______ 个氮原子相连,氮化铝晶体属于_______ 晶体。
(3)“遥遥领先”的华为芯片制造过程用了蚀刻技术。利用 进行硅芯片蚀刻时的产物均为气体,在蚀刻物表面不留任何残留物。
进行硅芯片蚀刻时的产物均为气体,在蚀刻物表面不留任何残留物。
① 分子的空间构型为
分子的空间构型为_______ 。
② 的一种下游产品三聚氟氰(分子式为:
的一种下游产品三聚氟氰(分子式为: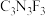 ),分子结构中有类似苯环结构,所有原子均满足8电子结构。写出三聚氟氰的结构式
),分子结构中有类似苯环结构,所有原子均满足8电子结构。写出三聚氟氰的结构式_______ 。
(4)2022年10月宁波南大光电ArF光刻胶生产线正式投产,国内7nm芯片制造材料获得重大突破。一种聚碳酸酯胶的曝光分解原理如下:_______ 。
②聚碳酸酯膜曝光后的产物加热可汽化或溶于水,加热汽化或溶于水克服的作用力有_______ 。
a.配位键 b.离子键 c.范德华力 d.氢键 e.共价键
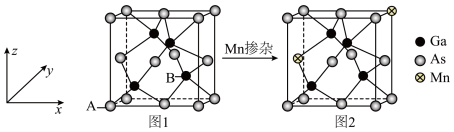
(5)GaAs是一种制造芯片重要的半导体材料,晶胞结构如图1,将Mn掺杂到GaAs的晶体中得到稀磁性半导体材料,如图2。_______ 。
②若GaAs晶体密度为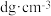 ,设
,设 为阿伏加德罗常数的值,则晶胞中两个As原子间的最小距离为
为阿伏加德罗常数的值,则晶胞中两个As原子间的最小距离为_______ cm(列出计算式即可)。
③稀磁性半导体材料中Mn、As的原子个数比为_______ 。
(1)我国现已能够拉制出直径为300mm、重达81kg的大直径硅单晶,晶体硅材料被大量用于电子产业。
①某同学画出基态Si原子的价层电子排布图: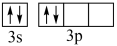 ,该电子排布图违背
,该电子排布图违背
 反应生成
反应生成 ,判断
,判断 的沸点比
的沸点比 的
的(2)超高导热绝缘耐高温纳米氮化铝,是制造5G芯片的重要绝缘材料。氮化铝晶体与金刚石类似,每个铝原子与
(3)“遥遥领先”的华为芯片制造过程用了蚀刻技术。利用
 进行硅芯片蚀刻时的产物均为气体,在蚀刻物表面不留任何残留物。
进行硅芯片蚀刻时的产物均为气体,在蚀刻物表面不留任何残留物。①
 分子的空间构型为
分子的空间构型为②
 的一种下游产品三聚氟氰(分子式为:
的一种下游产品三聚氟氰(分子式为: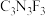 ),分子结构中有类似苯环结构,所有原子均满足8电子结构。写出三聚氟氰的结构式
),分子结构中有类似苯环结构,所有原子均满足8电子结构。写出三聚氟氰的结构式(4)2022年10月宁波南大光电ArF光刻胶生产线正式投产,国内7nm芯片制造材料获得重大突破。一种聚碳酸酯胶的曝光分解原理如下:
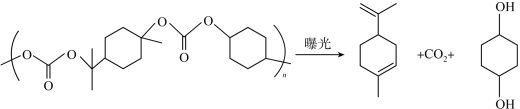
②聚碳酸酯膜曝光后的产物加热可汽化或溶于水,加热汽化或溶于水克服的作用力有
a.配位键 b.离子键 c.范德华力 d.氢键 e.共价键
(5)GaAs是一种制造芯片重要的半导体材料,晶胞结构如图1,将Mn掺杂到GaAs的晶体中得到稀磁性半导体材料,如图2。
②若GaAs晶体密度为
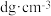 ,设
,设 为阿伏加德罗常数的值,则晶胞中两个As原子间的最小距离为
为阿伏加德罗常数的值,则晶胞中两个As原子间的最小距离为③稀磁性半导体材料中Mn、As的原子个数比为
您最近一年使用:0次
名校
解题方法
3 . 含Cu、Zn、Sn及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
(1) 与
与 相比,第二电离能与第一电离能差值更大的是
相比,第二电离能与第一电离能差值更大的是___________ ,原因是___________ 。
(2) 与C处于同一族,
与C处于同一族, 的几何构型为
的几何构型为___________ 。
(3)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是___________(填标号)。
(4)如图是硫的四种含氧酸根的结构: 转化为
转化为 的是
的是___________ (填标号)。理由是___________ 。
(5)如图是CZTS四元半导体化合物的四方晶胞。该物质的化学式为___________ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若图中A原子的坐标为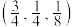 ,则B的原子坐标为
,则B的原子坐标为___________ 。
(1)
 与
与 相比,第二电离能与第一电离能差值更大的是
相比,第二电离能与第一电离能差值更大的是(2)
 与C处于同一族,
与C处于同一族, 的几何构型为
的几何构型为(3)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是___________(填标号)。
A. | B. |
C. | D.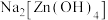 |
(4)如图是硫的四种含氧酸根的结构:
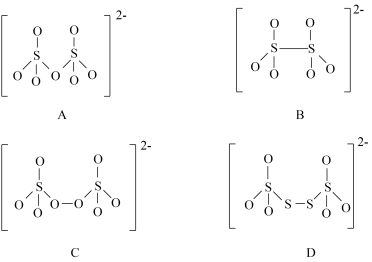
 转化为
转化为 的是
的是(5)如图是CZTS四元半导体化合物的四方晶胞。该物质的化学式为
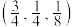 ,则B的原子坐标为
,则B的原子坐标为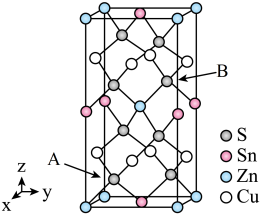
您最近一年使用:0次
名校
解题方法
4 . 材料是人类文明进步的阶梯,第IIIA、IVA、VA族元素是组成特殊材料的重要元素。请回答下列问题:
(1)基态As原子核外能量最高能级的电子云形状为___________ 。
(2)M与 位于同周期,
位于同周期, 的一种配合物组成为
的一种配合物组成为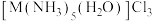 。
。
①下列有关 、
、 的说法正确的是
的说法正确的是___________ (填字母)。
a.分子空间构型相同 b.中心原子杂化类型相同 c.键角大小相同
② 含
含___________ molσ键。
③配合物T与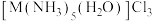 组成元素相同,中心离子的配位数相同。
组成元素相同,中心离子的配位数相同。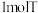 溶于水,加入足量
溶于水,加入足量 溶液可生成
溶液可生成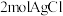 ;且T溶于水加强碱再加热不产生氨气。则T的化学式为
;且T溶于水加强碱再加热不产生氨气。则T的化学式为___________ 。
(3)常压、180℃时, 升华形成的二聚体
升华形成的二聚体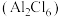 的结构如图所示。
的结构如图所示。___________ 。 的配位数为
的配位数为___________ 。
(4)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如右图所示,该晶胞中B原子填在P原子所围成的___________ (填“立方体”“正四面体”或“正八面体”)空隙中;若该晶体的密度为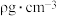 ,
, 是阿伏伽德罗常数的值。BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为
是阿伏伽德罗常数的值。BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为___________  (列式即可)。
(列式即可)。
(1)基态As原子核外能量最高能级的电子云形状为
(2)M与
 位于同周期,
位于同周期, 的一种配合物组成为
的一种配合物组成为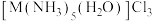 。
。①下列有关
 、
、 的说法正确的是
的说法正确的是a.分子空间构型相同 b.中心原子杂化类型相同 c.键角大小相同
②
 含
含③配合物T与
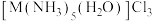 组成元素相同,中心离子的配位数相同。
组成元素相同,中心离子的配位数相同。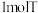 溶于水,加入足量
溶于水,加入足量 溶液可生成
溶液可生成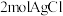 ;且T溶于水加强碱再加热不产生氨气。则T的化学式为
;且T溶于水加强碱再加热不产生氨气。则T的化学式为(3)常压、180℃时,
 升华形成的二聚体
升华形成的二聚体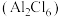 的结构如图所示。
的结构如图所示。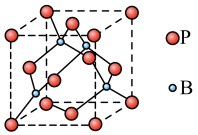
 的配位数为
的配位数为(4)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如右图所示,该晶胞中B原子填在P原子所围成的
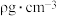 ,
, 是阿伏伽德罗常数的值。BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为
是阿伏伽德罗常数的值。BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为 (列式即可)。
(列式即可)。
您最近一年使用:0次
名校
5 . I.回答下列问题:
(1)对以下有机物进行系统命名: 的结构简式改写为键线式:
的结构简式改写为键线式:___________ 。
(3)上述(1)中分子②最多有___________ 个碳原子共平面。
(4)分子式为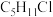 的同分异构体共有___________(不考虑立体异构)。
的同分异构体共有___________(不考虑立体异构)。
II.青蒿素是我国科学家从传统中药中发现的能治疗疟疾的有机化合物,其分子结构如图所示,它可以用有机溶剂A从中药中提取。
(5)下列关于青蒿素的说法不正确的是___________ (填字母)。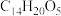
b.分子中含有酯基和醚键
c.易溶于有机溶剂A,不易溶于水
d.分子的空间结构不是平面形
(6)使用现代分析仪器对有机化合物A的分子结构进行测定,相关结果如下:___________ 。
②根据图2,推测A可能所属的有机化合物类别:___________ ,A的分子式:___________ 。
③根据以上结果和图3(两个峰的面积比为2:3),推测A的结构简式___________ 。
(1)对以下有机物进行系统命名:
①键线式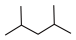 :
:
② :
:
 的结构简式改写为键线式:
的结构简式改写为键线式:(3)上述(1)中分子②最多有
(4)分子式为
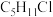 的同分异构体共有___________(不考虑立体异构)。
的同分异构体共有___________(不考虑立体异构)。| A.6种 | B.7种 | C.8种 | D.9种 |
II.青蒿素是我国科学家从传统中药中发现的能治疗疟疾的有机化合物,其分子结构如图所示,它可以用有机溶剂A从中药中提取。
(5)下列关于青蒿素的说法不正确的是

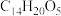
b.分子中含有酯基和醚键
c.易溶于有机溶剂A,不易溶于水
d.分子的空间结构不是平面形
(6)使用现代分析仪器对有机化合物A的分子结构进行测定,相关结果如下:
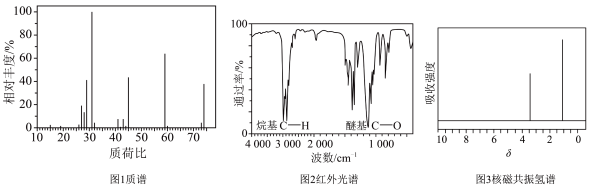
②根据图2,推测A可能所属的有机化合物类别:
③根据以上结果和图3(两个峰的面积比为2:3),推测A的结构简式
您最近一年使用:0次
名校
解题方法
6 . 席夫碱A和含席夫碱A的红光铂配合物的分子结构如图所示。
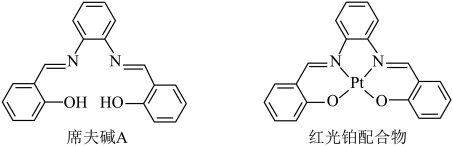
A.元素的电负性大小为: |
B.席夫碱A分子内可以形成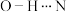 氢键 氢键 |
C.红光铂配合物分子中 的化合价为+4 的化合价为+4 |
D.席夫碱A分子中氮原子的孤电子对处于 杂化轨道上 杂化轨道上 |
您最近一年使用:0次
名校
解题方法
7 . LDFCB是电池的一种电解质,该电解质阴离子由同周期元素原子W、X、Z构成(如图),Y的最外层电子数等于X的核外电子总数,四种原子最外层电子数之和为20,下列说法正确的是
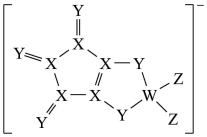
A.X的杂化方式是 |
| B.四种元素形成的简单氢化物中Z的沸点最高 |
C.对应简单离子半径: |
| D.元素Z的最高价氧化物的水化物为一元强酸 |
您最近一年使用:0次
名校
解题方法
8 . 下列一些说法及理论解释正确的是
| 选项 | 说法 | 理论解释 |
| A | P原子的第一电离能大于S原子 | P原子3p能级半充满 |
| B | 键角: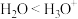 | 中心原子杂化方式不同 |
| C | 硝酸的沸点高于醋酸 | 硝酸的范德华力比醋酸大 |
| D | 氨易液化 | 氨分子与水分子能形成分子间氢键 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
9 . 物质结构的知识被科学家应用于各个科学领域,如医药、材料、染料等,造福着人类。下列说法不正确的是
| A.微波炉的工作原理是微波对食物中的极性分子产生作用 |
| B.石墨的导电性具有一定的方向性 |
| C.DNA的双螺旋结构靠大量氢键相连而稳定存在于生命体中 |
D.铁血红素分子中都以 与原卟啉环形成配合物的形式存在 与原卟啉环形成配合物的形式存在 |
您最近一年使用:0次
名校
10 . 有A、B、C、D、E5种元素,它们的核电荷数依次增大,且都小于20.其中只有C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为 ;B和D也属同一族,它们原子最外层的p能级电子数是最外层的s能级电子数的两倍;C基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。
;B和D也属同一族,它们原子最外层的p能级电子数是最外层的s能级电子数的两倍;C基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。
请回答下列问题:
(1)C是_______ (填元素名称)。
(2)上述元素中位于s区的有_______ (填元素符号)。
(3)与 互为等电子体的阴离子为
互为等电子体的阴离子为_______ 。
(4)已知C的氧化物CO与NiO的晶体结构相同,其中 和
和 的离子半径分别为66pm和69pm,则熔点:CO
的离子半径分别为66pm和69pm,则熔点:CO_____ NiO(填“>”“<”或“=”)。
(5)浸金时,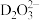 作为配体可提供孤电子对与
作为配体可提供孤电子对与 形成
形成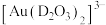 。
。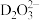 中的配位原子为
中的配位原子为_____ (填元素符号),其位置在______ (填“中心”或“端位”),理由是______ 。
 ;B和D也属同一族,它们原子最外层的p能级电子数是最外层的s能级电子数的两倍;C基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。
;B和D也属同一族,它们原子最外层的p能级电子数是最外层的s能级电子数的两倍;C基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。请回答下列问题:
(1)C是
(2)上述元素中位于s区的有
(3)与
 互为等电子体的阴离子为
互为等电子体的阴离子为(4)已知C的氧化物CO与NiO的晶体结构相同,其中
 和
和 的离子半径分别为66pm和69pm,则熔点:CO
的离子半径分别为66pm和69pm,则熔点:CO(5)浸金时,
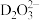 作为配体可提供孤电子对与
作为配体可提供孤电子对与 形成
形成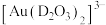 。
。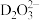 中的配位原子为
中的配位原子为
您最近一年使用:0次



