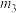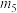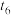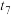1 . 下列化学用语或图示表达正确的是
A.CO2的电子式为: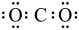 | B.基态锗原子的简化电子排布式: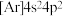 |
C. 的空间结构为 的空间结构为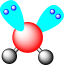 | D.铝原子最高能级的电子云轮廓图: |
您最近一年使用:0次
2 . 某校化学学习小组探究 与
与 溶液的反应,装置如下图所示,分液漏斗中盛有浓硫酸,锥形瓶中装有
溶液的反应,装置如下图所示,分液漏斗中盛有浓硫酸,锥形瓶中装有 固体。回答下列问题:
固体。回答下列问题:
(1)写出实验中制备 的化学方程式
的化学方程式________ 。
(2)配制100mL
 溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和
溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和________ 。
【实验探究】
向3mL
 溶液中通入
溶液中通入 ,观察到溶液立即由黄色变成红棕色,放置12小时后,,红棕色消失,溶液变为浅绿色。结合已有知识,针对溶液呈红棕色学习小组提出以下猜想:
,观察到溶液立即由黄色变成红棕色,放置12小时后,,红棕色消失,溶液变为浅绿色。结合已有知识,针对溶液呈红棕色学习小组提出以下猜想:
猜想1: 水解产生了红棕色的
水解产生了红棕色的 胶体;
胶体;
猜想2: 与溶液中某种
与溶液中某种 价含硫微粒形成了红棕色的配合物。
价含硫微粒形成了红棕色的配合物。
(3)为验证上述猜想,甲同学用激光笔照射该红棕色溶液,________ ,证明猜想1不成立。
(4)乙同学查阅文献得知猜想2正确,并设计了下表3组实验,以确定红棕色配合物的配体是 、
、 、
、 中的哪一种(实验均在常温下进行)。
中的哪一种(实验均在常温下进行)。
已知:常温下,溶液中 价含硫微粒物质的量分数随pH变化曲线如图所示。
价含硫微粒物质的量分数随pH变化曲线如图所示。________ (填写微粒符号),依据的实验证据是________ 。
(5)丙同学查阅资料得知:
利用分光光度计可测定溶液中有色物质的吸光度,吸光度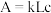 ,其中k为摩尔吸收系数;L为液层厚度即光路长度,在实验中液层厚度保持一致;c为有色物质的浓度。
,其中k为摩尔吸收系数;L为液层厚度即光路长度,在实验中液层厚度保持一致;c为有色物质的浓度。
丙同学经过思考,认为乙同学的实验方案不严谨,除了pH会影响溶液红棕色的深浅,还有一个因素也可能会影响溶液红棕色的深浅。于是设计如下实验进行探究,请帮助该同学完成实验方案,填写下表中空白处。
实验结果讨论:若 ,则该因素不影响溶液红棕色的深浅;若
,则该因素不影响溶液红棕色的深浅;若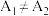 ,则该因素会影响溶液红棕色的深浅。
,则该因素会影响溶液红棕色的深浅。
(6)丁同学查阅资料得知:
配合物在溶液中存在解离平衡,如: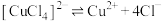 。
。
丁同学设计实验,利用分光光度计测定上述溶液中红棕色物质的吸光度,证明解离平衡的存在。请完成表中内容。
实验限选试剂为: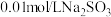 溶液,
溶液,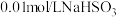 溶液,
溶液, 固体,
固体,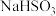 固体
固体
 与
与 溶液的反应,装置如下图所示,分液漏斗中盛有浓硫酸,锥形瓶中装有
溶液的反应,装置如下图所示,分液漏斗中盛有浓硫酸,锥形瓶中装有 固体。回答下列问题:
固体。回答下列问题: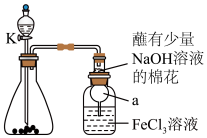
(1)写出实验中制备
 的化学方程式
的化学方程式(2)配制100mL

 溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和
溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和【实验探究】
向3mL

 溶液中通入
溶液中通入 ,观察到溶液立即由黄色变成红棕色,放置12小时后,,红棕色消失,溶液变为浅绿色。结合已有知识,针对溶液呈红棕色学习小组提出以下猜想:
,观察到溶液立即由黄色变成红棕色,放置12小时后,,红棕色消失,溶液变为浅绿色。结合已有知识,针对溶液呈红棕色学习小组提出以下猜想:猜想1:
 水解产生了红棕色的
水解产生了红棕色的 胶体;
胶体;猜想2:
 与溶液中某种
与溶液中某种 价含硫微粒形成了红棕色的配合物。
价含硫微粒形成了红棕色的配合物。(3)为验证上述猜想,甲同学用激光笔照射该红棕色溶液,
(4)乙同学查阅文献得知猜想2正确,并设计了下表3组实验,以确定红棕色配合物的配体是
 、
、 、
、 中的哪一种(实验均在常温下进行)。
中的哪一种(实验均在常温下进行)。组别 | 溶液1(1mL) | 溶液2(2mL) | 现象 |
a |
|
| 溶液1和溶液2混合后,组别a、b、c所得溶液红棕色依次加深。 |
b |  的饱和溶液,用 的饱和溶液,用 固体调节. 固体调节. | ||
c |  的饱和溶液,用 的饱和溶液,用 固体调节 固体调节 |
 价含硫微粒物质的量分数随pH变化曲线如图所示。
价含硫微粒物质的量分数随pH变化曲线如图所示。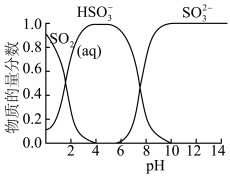
(5)丙同学查阅资料得知:
利用分光光度计可测定溶液中有色物质的吸光度,吸光度
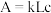 ,其中k为摩尔吸收系数;L为液层厚度即光路长度,在实验中液层厚度保持一致;c为有色物质的浓度。
,其中k为摩尔吸收系数;L为液层厚度即光路长度,在实验中液层厚度保持一致;c为有色物质的浓度。丙同学经过思考,认为乙同学的实验方案不严谨,除了pH会影响溶液红棕色的深浅,还有一个因素也可能会影响溶液红棕色的深浅。于是设计如下实验进行探究,请帮助该同学完成实验方案,填写下表中空白处。
实验序号 | 操作 | 吸光度 |
1 | 把1mL 0.1mol/L 溶液与2mL 溶液与2mL 饱和溶液混合均匀,溶液变成红棕色,测定溶液中红棕色物质的吸光度。 饱和溶液混合均匀,溶液变成红棕色,测定溶液中红棕色物质的吸光度。 |
|
2 |
|
 ,则该因素不影响溶液红棕色的深浅;若
,则该因素不影响溶液红棕色的深浅;若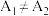 ,则该因素会影响溶液红棕色的深浅。
,则该因素会影响溶液红棕色的深浅。(6)丁同学查阅资料得知:
配合物在溶液中存在解离平衡,如:
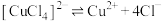 。
。丁同学设计实验,利用分光光度计测定上述溶液中红棕色物质的吸光度,证明解离平衡的存在。请完成表中内容。
实验限选试剂为:
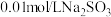 溶液,
溶液,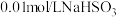 溶液,
溶液, 固体,
固体,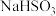 固体
固体实验序号 | 操作 | 吸光度 | 结论 |
3 | 向3mL 0.1mol/L 溶液中通入 溶液中通入 ,溶液立即由黄色变成红棕色,测定溶液中红棕色物质的吸光度 ,溶液立即由黄色变成红棕色,测定溶液中红棕色物质的吸光度 |
| |
4 |
  (填“大于”、“小于”或“等于”) (填“大于”、“小于”或“等于”) | 平衡向 |
您最近一年使用:0次
名校
3 . 肼(N2H4)可作火箭发射的燃料。某实验兴趣小组利用氨气与次氯酸钠反应制备N2H4,并探究N2H4的性质,其制备装置如图所示。
(1)N2H4的电子式是_________________________________ 。
(2)仪器b的名称为_________________________ ,仪器a的作用是_________________________________ 。
(3)装置 中发生反应的化学方程式为
中发生反应的化学方程式为_________________________________ 。
(4)采用上述装置制备N2H4时产率较低,可能的原因是_________________________________ 。
(5)写出装置 中生成N2H4的化学方程式
中生成N2H4的化学方程式_________________________________ 。
(6)探究N2H4的性质。将制得的N2H4分离提纯后,进行如下实验。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如下方案,进行实验。
(7)肼是一种常用的还原剂,可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上1kg肼可除去水中溶解的O2的质量为_________________ kg。
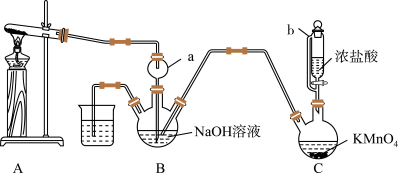
(1)N2H4的电子式是
(2)仪器b的名称为
(3)装置
 中发生反应的化学方程式为
中发生反应的化学方程式为(4)采用上述装置制备N2H4时产率较低,可能的原因是
(5)写出装置
 中生成N2H4的化学方程式
中生成N2H4的化学方程式(6)探究N2H4的性质。将制得的N2H4分离提纯后,进行如下实验。
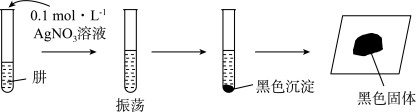
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如下方案,进行实验。
操作 | 现象 | 结论 |
 取少量黑色固体于试管中,加入足量 取少量黑色固体于试管中,加入足量 | 黑色固体部分溶解 | 黑色固体中有Ag2O |
 取少量黑色固体于试管中,加入足量稀硝酸,振荡 取少量黑色固体于试管中,加入足量稀硝酸,振荡 | 黑色固体是Ag和Ag2O,则肼具有的性质是碱性和 |
(7)肼是一种常用的还原剂,可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上1kg肼可除去水中溶解的O2的质量为
您最近一年使用:0次
2024-04-20更新
|
452次组卷
|
2卷引用:广东省韶关市2023-2024学年高三上学期第一次综合检测化学试题
4 . 锌铁液流电池由于安全、稳定、电解液成本低等优点成为电化学储能热点技术之一,如图为碱性锌铁液流电池放电时的工作原理示意图,以 和
和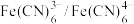 作为电极氧化还原产物。已知:聚苯并咪唑(PBI)膜允许
作为电极氧化还原产物。已知:聚苯并咪唑(PBI)膜允许 离子通过。下列说法正确的是
离子通过。下列说法正确的是
 和
和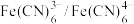 作为电极氧化还原产物。已知:聚苯并咪唑(PBI)膜允许
作为电极氧化还原产物。已知:聚苯并咪唑(PBI)膜允许 离子通过。下列说法正确的是
离子通过。下列说法正确的是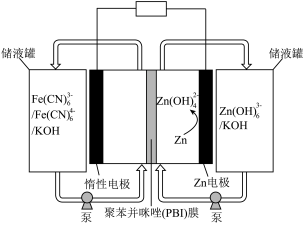
| A.充电时,惰性电极连接电源的负极 |
| B.放电过程中,当有2mol电子转移时,负极区电解液增重65g |
C.充电过程中,总反应为: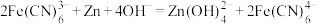 |
| D.充电过程中,惰性电极区的溶液pH逐渐增大 |
您最近一年使用:0次
5 . “回望飞天路,逐梦新征程”。下列说法正确的是
| A.月球中的3He与地球上的3H互为同位素 |
| B.“太空快递小哥”天舟六号壳体材料主要为铝合金,其强度大于纯铝 |
C.“问天”实验舱使用砷化镓 太阳能电池,其中 太阳能电池,其中 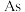 位于周期表的d区 位于周期表的d区 |
| D.长征七号遥七运载火箭采用液氧、煤油等燃料作为推进剂,液氧和煤油均属于混合物 |
您最近一年使用:0次
2024-04-16更新
|
463次组卷
|
2卷引用:广东省韶关市2023-2024学年高三上学期第一次综合检测化学试题
6 . 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的重大贡献。
(1)将纯锌片和纯铜片按图甲、图乙方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:______ ,该烧杯中铜片上的现象为______ 。
②在相同时间内,两烧杯中产生气泡的速度:甲______ 乙(填“>”“<”或“=”)。
③形成原电池的装置中电子移动的方向是:流向______ (写电极材料的名称)
④当甲中溶液质量增重31.5g时,电极上转移电子数目为______ 。
(2)燃料电池是一种高效、环境友好的发电装置,图丁为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH。通甲烷一极的为电池的______ (填“正极”或“负极”),写出负极电极反应式______ 。
(1)将纯锌片和纯铜片按图甲、图乙方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
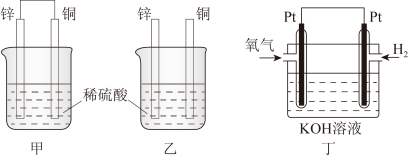
②在相同时间内,两烧杯中产生气泡的速度:甲
③形成原电池的装置中电子移动的方向是:流向
④当甲中溶液质量增重31.5g时,电极上转移电子数目为
(2)燃料电池是一种高效、环境友好的发电装置,图丁为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH。通甲烷一极的为电池的
您最近一年使用:0次
解题方法
7 . 下列图片所示内容的能量转化方式主要为化学能转化为热能的是
|
|
|
|
A | B | C | D |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
8 . 石墨在材料领域有重要应用,某初级石墨中含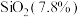 、
、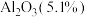 和
和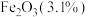 等杂质,提纯与综合利用工艺流程如下:
等杂质,提纯与综合利用工艺流程如下:
② 的沸点为57.6℃,金属氯化物的沸点均高于150℃.
的沸点为57.6℃,金属氯化物的沸点均高于150℃.
(1)“氯化”时,先向反应器中通入 一段时间,再加热,主要目的是
一段时间,再加热,主要目的是______ 。
(2)“冷凝”后,所得“气体”的成分有 和
和______ (填化学式)。
(3)“溶解过滤”时,加过量NaOH溶液的目的是______ ;取少量滤液于试管中,______ (实验操作及现象),证明已完全沉淀。
(4)“沉铝”得到的产物为 ,工业上由
,工业上由 制Al需发生两步反应,写出第一步得到
制Al需发生两步反应,写出第一步得到 的化学方程式
的化学方程式______ 。
(5)写出A1的一种用途______ 。
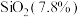 、
、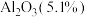 和
和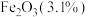 等杂质,提纯与综合利用工艺流程如下:
等杂质,提纯与综合利用工艺流程如下:
②
 的沸点为57.6℃,金属氯化物的沸点均高于150℃.
的沸点为57.6℃,金属氯化物的沸点均高于150℃.(1)“氯化”时,先向反应器中通入
 一段时间,再加热,主要目的是
一段时间,再加热,主要目的是(2)“冷凝”后,所得“气体”的成分有
 和
和(3)“溶解过滤”时,加过量NaOH溶液的目的是
(4)“沉铝”得到的产物为
 ,工业上由
,工业上由 制Al需发生两步反应,写出第一步得到
制Al需发生两步反应,写出第一步得到 的化学方程式
的化学方程式(5)写出A1的一种用途
您最近一年使用:0次
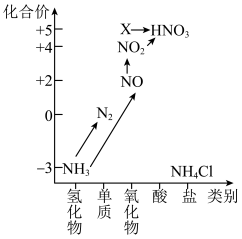
9 . 依据图中氮元素及其化合物的转化关系,回答下列问题:______ 。
(2)回答下列关于 的问题:
的问题:
①利用下列方法制氨气,其中合理的是______ (填字母)。
A.将浓氨水滴入氢氧化钠固体中
B.将氯化铵稀溶液滴入氧化钙固体中
C.将氯化铵固体加热分解
D.加热浓氨水
E.将浓氨水滴入碱石灰固体中
②氨气是重要的化工原料,可以合成多种物质,写出其催化氧化的化学方程式:______ 。
③ 、
、 合成
合成 的反应中,当分别用以下各种物质表示反应速率时,则反应速率最快的是
的反应中,当分别用以下各种物质表示反应速率时,则反应速率最快的是______ 。
A. B.
B.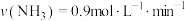
C.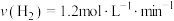 D.
D.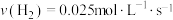
(3)下列关于NO、 的问题:
的问题:
①汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体C0和NO反应可转化为无害气体排放,写出相关反应的化学方程式:______ 。
②NO和 按一定比例混合可以被NaOH溶液完全吸收生成一种正盐,写出相关反应的化学方程式:
按一定比例混合可以被NaOH溶液完全吸收生成一种正盐,写出相关反应的化学方程式:______ 。
(2)回答下列关于
 的问题:
的问题:①利用下列方法制氨气,其中合理的是
A.将浓氨水滴入氢氧化钠固体中
B.将氯化铵稀溶液滴入氧化钙固体中
C.将氯化铵固体加热分解
D.加热浓氨水
E.将浓氨水滴入碱石灰固体中
②氨气是重要的化工原料,可以合成多种物质,写出其催化氧化的化学方程式:
③
 、
、 合成
合成 的反应中,当分别用以下各种物质表示反应速率时,则反应速率最快的是
的反应中,当分别用以下各种物质表示反应速率时,则反应速率最快的是A.
 B.
B.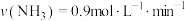
C.
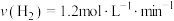 D.
D.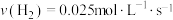
(3)下列关于NO、
 的问题:
的问题:①汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体C0和NO反应可转化为无害气体排放,写出相关反应的化学方程式:
②NO和
 按一定比例混合可以被NaOH溶液完全吸收生成一种正盐,写出相关反应的化学方程式:
按一定比例混合可以被NaOH溶液完全吸收生成一种正盐,写出相关反应的化学方程式:
您最近一年使用:0次
解题方法
10 . Ⅰ.控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
(1)化学反应速率本质上是由反应物本身的性质决定的,但外界条件也会影响反应速率的大小。本实验中实验2和实验3表明______ 对反应速率有影响。
(2)我们最好选取实验______ (填3个实验序号)研究锌的形状对反应速率的影响。我们发现在其它条件相同时,反应物间的______ 反应速率越快。
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快。原因是______ 。
Ⅱ.某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:______ 。
(5)分析有关数据,写出X、Y、Z的反应方程式______ 。
序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
1 | 50.0 | 2.0 | 薄片 | 25 | 100 |
|
2 | 50.0 | 2.0 | 颗粒 | 25 | 70 |
|
3 | 50.0 | 2.0 | 颗粒 | 35 | 35 |
|
4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
5 | 50.0 | 6.0 | 粉末 | 35 | 30 |
|
6 | 50.0 | 8.0 | 粉末 | 25 |
| 16.1 |
7 | 50.0 | 10.0 | 粉末 | 25 |
| 16.1 |
(1)化学反应速率本质上是由反应物本身的性质决定的,但外界条件也会影响反应速率的大小。本实验中实验2和实验3表明
(2)我们最好选取实验
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快。原因是
Ⅱ.某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:
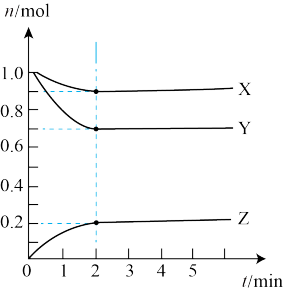
(5)分析有关数据,写出X、Y、Z的反应方程式
您最近一年使用:0次

 溶液
溶液