1 . 某立方卤化物可用于制作光电材料,其晶胞结构如图所示。该晶胞在体对角线方向的投影为

A. | B. | C. | D. |
您最近一年使用:0次
2024-05-12更新
|
351次组卷
|
2卷引用:广东省湛江市2024届高三下学期第二次模拟测试化学试题
解题方法
2 . 宏观辨识与微观探析是高中化学核心素养的重要组成部分。下列解释相应实验现象的离子方程式错误的是
A.往AgCl沉淀中加入KI溶液,沉淀由白色变为黄色: |
B.向 溶液中滴入过量 溶液中滴入过量 溶液: 溶液: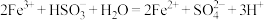 |
C.南方水果运往北方时,用浸泡了酸性高锰酸钾溶液的硅藻土除去乙烯,防止水果腐烂: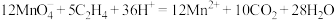 |
D.苯甲醛与新制的 共热: 共热: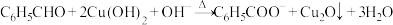 |
您最近一年使用:0次
2024-05-12更新
|
539次组卷
|
2卷引用:广东省湛江市2024届高三下学期第二次模拟测试化学试题
解题方法
3 . 有X、Y、Z、M、R五种短周期的主族元素,部分信息如下表所示:
(1)写出X元素中中子数为2的核素的原子符号_____ 。
(2)R在元素周期表中的位置是____ 。
(3)Z原子形成的简单离子的半径____ M原子形成的简单离子半径(填“大于”或“小于”)
(4)化合物Z2M2的阴阳离子个数比是_____ 。
(5)元素X与Z可以形成一种离子化合物ZX,写出该离子化合物的化学式______ ;将该离子化合物ZX加入到水中,滴加酚酞可以观察到水溶液显红色,同时有气泡生成,写出该过程发生的化学反应方程式_____ 。
(6)下列事实能作为比较元素Y与R的非金属性相对强弱依据的是_______。
| X | Y | Z | M | R | |
| 原子半径/nm | 0.086 | 0.186 | 0.074 | 0.099 | |
| 主要化合价 | +4、-4 | -2 | -1、+7 | ||
| 其它信息 | 某种核素无中子 | 某种核素用于考古 | 短周期主族元素中原子半径最大 |
(1)写出X元素中中子数为2的核素的原子符号
(2)R在元素周期表中的位置是
(3)Z原子形成的简单离子的半径
(4)化合物Z2M2的阴阳离子个数比是
(5)元素X与Z可以形成一种离子化合物ZX,写出该离子化合物的化学式
(6)下列事实能作为比较元素Y与R的非金属性相对强弱依据的是_______。
| A.元素R的最高正化合价高于Y | B.稳定性:XR>YX4 |
| C.元素R最外层电子数多于Y | D.酸性HR>H2XO3 |
您最近一年使用:0次
4 . 设 为阿伏加德罗常数的值。侯氏制碱法涉及
为阿伏加德罗常数的值。侯氏制碱法涉及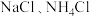 和
和 等物质。下列叙述正确的是
等物质。下列叙述正确的是
 为阿伏加德罗常数的值。侯氏制碱法涉及
为阿伏加德罗常数的值。侯氏制碱法涉及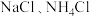 和
和 等物质。下列叙述正确的是
等物质。下列叙述正确的是A.1mol 含有的电子数目为11NA 含有的电子数目为11NA |
B.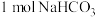 完全分解,得到的 完全分解,得到的 分子数目为 分子数目为 |
C.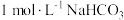 溶液中, 溶液中, 数目为 数目为 |
D. 和 和 的混合物中含 的混合物中含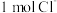 ,则混合物中质子数为 ,则混合物中质子数为 |
您最近一年使用:0次
解题方法
5 . 氮氧化物是大气的主要污染物,为防治环境污染,科研人员做了大量研究。
I.汽油燃油车上安装三元催化转化器,可以使 和
和 两种尾气反应生成
两种尾气反应生成 ,可有效降低汽车尾气污染,反应为
,可有效降低汽车尾气污染,反应为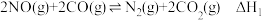 。
。
(1)下表中数据是该反应中的相关物质的标准摩尔生成焓(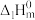 )(标准摩尔生成焓是指在
)(标准摩尔生成焓是指在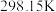 、
、 条件下,由稳定态单质生成
条件下,由稳定态单质生成 化合物时的焓变)数据。
化合物时的焓变)数据。
则
__________  。
。
(2)将 和
和 按物质的量之比
按物质的量之比 以一定的流速分别通过两种催化剂(
以一定的流速分别通过两种催化剂(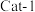 和
和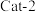 )进行反应,相同时间内测定逸出气体中
)进行反应,相同时间内测定逸出气体中 的含量,从而确定尾气脱氮率(
的含量,从而确定尾气脱氮率( 的转化率),结果如图所示。
的转化率),结果如图所示。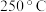 下脱氮率较高的催化剂是
下脱氮率较高的催化剂是__________ (填“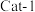 ”或“
”或“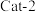 ”)。
”)。
②催化剂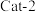 催化条件下,
催化条件下,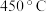 后,脱氮率随温度升高而下降的原因是
后,脱氮率随温度升高而下降的原因是_______________ 。
Ⅱ.一定条件下 与
与 可发生反应:
可发生反应: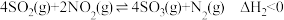 。
。
(3)将 与
与 按物质的量之比
按物质的量之比 置于恒温恒容密闭容器中反应。下列能说明反应达到平衡状态的是__________(填标号)。
置于恒温恒容密闭容器中反应。下列能说明反应达到平衡状态的是__________(填标号)。
(4)将一定量的 与
与 置于密闭容器中发生反应,在相同时间内测得
置于密闭容器中发生反应,在相同时间内测得 的物质的量分数与温度的变化曲线如图1所示(虚线为平衡时的曲线)。
的物质的量分数与温度的变化曲线如图1所示(虚线为平衡时的曲线)。 的平衡转化率与压强、温度及氮硫比
的平衡转化率与压强、温度及氮硫比 的关系如图2所示。
的关系如图2所示。_______________ 。
②图2中压强:
__________ (填“>”“<”或“=”,下同) ,氮硫比:
,氮硫比:
__________  。
。
③温度为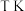 ,压强恒定为
,压强恒定为 时,反应平衡常数
时,反应平衡常数
__________ 。
I.汽油燃油车上安装三元催化转化器,可以使
 和
和 两种尾气反应生成
两种尾气反应生成 ,可有效降低汽车尾气污染,反应为
,可有效降低汽车尾气污染,反应为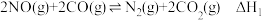 。
。(1)下表中数据是该反应中的相关物质的标准摩尔生成焓(
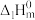 )(标准摩尔生成焓是指在
)(标准摩尔生成焓是指在 、
、 条件下,由稳定态单质生成
条件下,由稳定态单质生成 化合物时的焓变)数据。
化合物时的焓变)数据。物质 |
|
|
|
|
| 0 |
|
| 90 |

 。
。(2)将
 和
和 按物质的量之比
按物质的量之比 以一定的流速分别通过两种催化剂(
以一定的流速分别通过两种催化剂(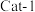 和
和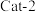 )进行反应,相同时间内测定逸出气体中
)进行反应,相同时间内测定逸出气体中 的含量,从而确定尾气脱氮率(
的含量,从而确定尾气脱氮率( 的转化率),结果如图所示。
的转化率),结果如图所示。
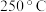 下脱氮率较高的催化剂是
下脱氮率较高的催化剂是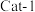 ”或“
”或“ ”)。
”)。②催化剂
 催化条件下,
催化条件下,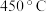 后,脱氮率随温度升高而下降的原因是
后,脱氮率随温度升高而下降的原因是Ⅱ.一定条件下
 与
与 可发生反应:
可发生反应: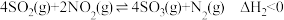 。
。(3)将
 与
与 按物质的量之比
按物质的量之比 置于恒温恒容密闭容器中反应。下列能说明反应达到平衡状态的是__________(填标号)。
置于恒温恒容密闭容器中反应。下列能说明反应达到平衡状态的是__________(填标号)。| A.体系压强保持不变 | B. 与 与 的物质的量之比保持不变 的物质的量之比保持不变 |
C. | D.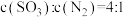 |
(4)将一定量的
 与
与 置于密闭容器中发生反应,在相同时间内测得
置于密闭容器中发生反应,在相同时间内测得 的物质的量分数与温度的变化曲线如图1所示(虚线为平衡时的曲线)。
的物质的量分数与温度的变化曲线如图1所示(虚线为平衡时的曲线)。 的平衡转化率与压强、温度及氮硫比
的平衡转化率与压强、温度及氮硫比 的关系如图2所示。
的关系如图2所示。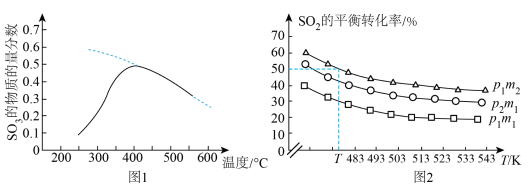
②图2中压强:

 ,氮硫比:
,氮硫比:
 。
。③温度为
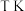 ,压强恒定为
,压强恒定为 时,反应平衡常数
时,反应平衡常数
您最近一年使用:0次
2024-05-01更新
|
553次组卷
|
4卷引用:广东省湛江市2024届高三下学期第二次模拟测试化学试题
名校
6 . 甲烷是重要的资源,通过下列过程可实现由甲烷到氢气的转化。 与
与 重整主要发生下列反应:
重整主要发生下列反应:

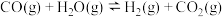
已知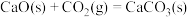
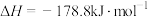 。向重整反应体系中加入适量多孔CaO,其优点是
。向重整反应体系中加入适量多孔CaO,其优点是________ 。
(2) 与
与 重整的主要反应的热化学方程式为
重整的主要反应的热化学方程式为
反应Ⅰ:
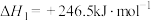
反应Ⅱ: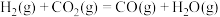

反应Ⅲ: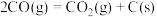

①在 与
与 重整体系中通入适量
重整体系中通入适量 ,可减少C(s)的生成,反应3
,可减少C(s)的生成,反应3 的
的
________ 。
② 下,将
下,将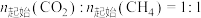 的混合气体置于密闭容器中,不同温度下重整体系中
的混合气体置于密闭容器中,不同温度下重整体系中 和
和 的平衡转化率如图1所示。800℃下
的平衡转化率如图1所示。800℃下 平衡转化率远大于600℃下
平衡转化率远大于600℃下 平衡转化率,其原因是
平衡转化率,其原因是________ 。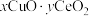 ,Ce是活泼金属)催化氧化可除去
,Ce是活泼金属)催化氧化可除去 中少量CO,催化氧化过程中Cu、Ce的化合价均发生变化,可能机理如图2所示。将
中少量CO,催化氧化过程中Cu、Ce的化合价均发生变化,可能机理如图2所示。将 的混合气体以一定流速通过装有
的混合气体以一定流速通过装有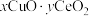 催化剂的反应器,CO的转化率随温度变化的曲线如图3所示。
催化剂的反应器,CO的转化率随温度变化的曲线如图3所示。 ,基态Cu原子核外电子排布式为
,基态Cu原子核外电子排布式为________ ,图2所示机理的步骤(i)中,元素Cu、Ce化合价发生的变化为________ 。
②图2所表示的总反应为________ 。
③当催化氧化温度超过150℃时,催化剂的催化活性下降,其可能原因是________ 。

 与
与 重整主要发生下列反应:
重整主要发生下列反应:
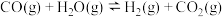
已知
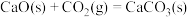
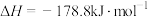 。向重整反应体系中加入适量多孔CaO,其优点是
。向重整反应体系中加入适量多孔CaO,其优点是(2)
 与
与 重整的主要反应的热化学方程式为
重整的主要反应的热化学方程式为反应Ⅰ:

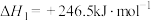
反应Ⅱ:
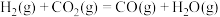

反应Ⅲ:
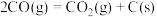

①在
 与
与 重整体系中通入适量
重整体系中通入适量 ,可减少C(s)的生成,反应3
,可减少C(s)的生成,反应3 的
的
②
 下,将
下,将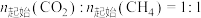 的混合气体置于密闭容器中,不同温度下重整体系中
的混合气体置于密闭容器中,不同温度下重整体系中 和
和 的平衡转化率如图1所示。800℃下
的平衡转化率如图1所示。800℃下 平衡转化率远大于600℃下
平衡转化率远大于600℃下 平衡转化率,其原因是
平衡转化率,其原因是 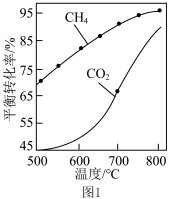
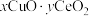 ,Ce是活泼金属)催化氧化可除去
,Ce是活泼金属)催化氧化可除去 中少量CO,催化氧化过程中Cu、Ce的化合价均发生变化,可能机理如图2所示。将
中少量CO,催化氧化过程中Cu、Ce的化合价均发生变化,可能机理如图2所示。将 的混合气体以一定流速通过装有
的混合气体以一定流速通过装有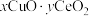 催化剂的反应器,CO的转化率随温度变化的曲线如图3所示。
催化剂的反应器,CO的转化率随温度变化的曲线如图3所示。

 ,基态Cu原子核外电子排布式为
,基态Cu原子核外电子排布式为②图2所表示的总反应为
③当催化氧化温度超过150℃时,催化剂的催化活性下降,其可能原因是
您最近一年使用:0次
名校
解题方法
7 . 下列指定反应的离子方程式正确的是
A.磁性氧化铁溶于足量稀硝酸: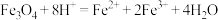 |
B.NaClO溶液与HI溶液反应: |
C. 溶液和过量 溶液和过量 溶液混合: 溶液混合: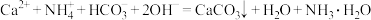 |
D.明矾溶液中滴入 溶液使 溶液使 恰好完全沉淀: 恰好完全沉淀: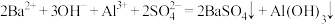 |
您最近一年使用:0次
名校
8 . 钛白粉(纳米级)广泛应用于功能陶瓷、催化剂、化妆品和光敏材料等白色无机颜料。具有优良的遮盖力和着色牢度,适用于不透明的白色制品。其制备原料钛铁矿( )中往往含有
)中往往含有 、MgO、CaO、
、MgO、CaO、 、
、 等杂质。一种硫酸法制取白色颜料钛白粉(
等杂质。一种硫酸法制取白色颜料钛白粉( )的生产工艺如图:
)的生产工艺如图: 形式存在;
形式存在;
②强电解质 在溶液中仅能电离出
在溶液中仅能电离出 和一种阳离子;
和一种阳离子;
③ 不溶于水和稀酸。
不溶于水和稀酸。
(1)要提高酸浸速率,可采取的措施是________ (写出一条即可)。
(2)滤渣①中除铁粉外,还可能含有的成分是________ 。
(3)酸浸过程中, 发生反应的离子方程式为
发生反应的离子方程式为________ 。
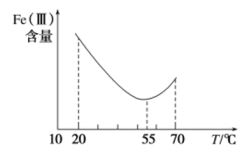
(4)加入铁粉的目的是还原体系中的 。为探究最佳反应条件,某实验室做了如下尝试。
。为探究最佳反应条件,某实验室做了如下尝试。
①在其他条件不变的情况下,体系中Fe(III)[指 和
和 等含正三价铁元素的微粒]含量随pH变化如图,试分析,在pH介于4~6之间时,Fe(III)主要以
等含正三价铁元素的微粒]含量随pH变化如图,试分析,在pH介于4~6之间时,Fe(III)主要以________ (填微粒化学式,已知pH>3时近似认为 沉淀完全)形式存在。
沉淀完全)形式存在。________ 。________ 。在实验室中,滤渣③一般在________ (填仪器名称)中灼烧。
 )中往往含有
)中往往含有 、MgO、CaO、
、MgO、CaO、 、
、 等杂质。一种硫酸法制取白色颜料钛白粉(
等杂质。一种硫酸法制取白色颜料钛白粉( )的生产工艺如图:
)的生产工艺如图: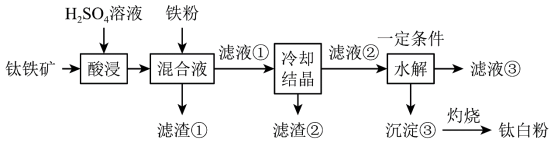
 形式存在;
形式存在;②强电解质
 在溶液中仅能电离出
在溶液中仅能电离出 和一种阳离子;
和一种阳离子;③
 不溶于水和稀酸。
不溶于水和稀酸。(1)要提高酸浸速率,可采取的措施是
(2)滤渣①中除铁粉外,还可能含有的成分是
(3)酸浸过程中,
 发生反应的离子方程式为
发生反应的离子方程式为(4)加入铁粉的目的是还原体系中的
 。为探究最佳反应条件,某实验室做了如下尝试。
。为探究最佳反应条件,某实验室做了如下尝试。①在其他条件不变的情况下,体系中Fe(III)[指
 和
和 等含正三价铁元素的微粒]含量随pH变化如图,试分析,在pH介于4~6之间时,Fe(III)主要以
等含正三价铁元素的微粒]含量随pH变化如图,试分析,在pH介于4~6之间时,Fe(III)主要以 沉淀完全)形式存在。
沉淀完全)形式存在。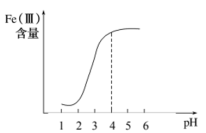
您最近一年使用:0次
名校
9 . 硫代硫酸钠( )为无色透明晶体,易溶于水,难溶于乙醇,在中性或碱性环境中稳定,酸性环境中不稳定,受热易分解,有较强的还原性。工业上常用硫化碱法制备,反应原理为
)为无色透明晶体,易溶于水,难溶于乙醇,在中性或碱性环境中稳定,酸性环境中不稳定,受热易分解,有较强的还原性。工业上常用硫化碱法制备,反应原理为 ,某实验探究小组模拟该工业原理在实验室制备
,某实验探究小组模拟该工业原理在实验室制备 ,实验装置如图所示。
,实验装置如图所示。
(1)仪器a的名称为________ ,装置D中NaOH溶液的作用是________ 。
(2)实验开始时,先关闭开关 ,打开开关
,打开开关 ,再打开活塞
,再打开活塞 。制备过程中必须监测装置C中溶液的pH,当溶液的pH降至7时,反应完成,立即停止反应,停止反应的操作是
。制备过程中必须监测装置C中溶液的pH,当溶液的pH降至7时,反应完成,立即停止反应,停止反应的操作是________ 。如果继续通入 ,最终得到的产品会略带黄色,出现此现象的原因是
,最终得到的产品会略带黄色,出现此现象的原因是________ 。
(3)该制备方法得到的粗产品中常含有少量 、
、 、
、 等杂质,设计实验,验证粗产品含有
等杂质,设计实验,验证粗产品含有 杂质的方法是
杂质的方法是________ (写出操作步骤、现象和结论)。
(4)已知: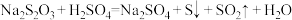 ,某研究小组利用该反应探究外界条件对反应速率的影响,设计实验如下:分3个小组进行实验,每个小组都准备了3支试管和1个装有水的烧杯,3支试管分别加入
,某研究小组利用该反应探究外界条件对反应速率的影响,设计实验如下:分3个小组进行实验,每个小组都准备了3支试管和1个装有水的烧杯,3支试管分别加入 溶液、
溶液、 稀硫酸、蒸馏水若干毫升,将3支试管放入烧杯中,经过一段时间后,再将3支试管的溶液混合,记录溶液出现浑浊的时间。
稀硫酸、蒸馏水若干毫升,将3支试管放入烧杯中,经过一段时间后,再将3支试管的溶液混合,记录溶液出现浑浊的时间。
①设计第1组和第2组实验的目的是________ 。
②设计第3组实验的目的是探究反应温度为40℃时, 溶液浓度变化对反应速率的影响,则x=
溶液浓度变化对反应速率的影响,则x=________ ,y=________ 。
 )为无色透明晶体,易溶于水,难溶于乙醇,在中性或碱性环境中稳定,酸性环境中不稳定,受热易分解,有较强的还原性。工业上常用硫化碱法制备,反应原理为
)为无色透明晶体,易溶于水,难溶于乙醇,在中性或碱性环境中稳定,酸性环境中不稳定,受热易分解,有较强的还原性。工业上常用硫化碱法制备,反应原理为 ,某实验探究小组模拟该工业原理在实验室制备
,某实验探究小组模拟该工业原理在实验室制备 ,实验装置如图所示。
,实验装置如图所示。
(1)仪器a的名称为
(2)实验开始时,先关闭开关
 ,打开开关
,打开开关 ,再打开活塞
,再打开活塞 。制备过程中必须监测装置C中溶液的pH,当溶液的pH降至7时,反应完成,立即停止反应,停止反应的操作是
。制备过程中必须监测装置C中溶液的pH,当溶液的pH降至7时,反应完成,立即停止反应,停止反应的操作是 ,最终得到的产品会略带黄色,出现此现象的原因是
,最终得到的产品会略带黄色,出现此现象的原因是(3)该制备方法得到的粗产品中常含有少量
 、
、 、
、 等杂质,设计实验,验证粗产品含有
等杂质,设计实验,验证粗产品含有 杂质的方法是
杂质的方法是(4)已知:
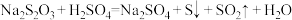 ,某研究小组利用该反应探究外界条件对反应速率的影响,设计实验如下:分3个小组进行实验,每个小组都准备了3支试管和1个装有水的烧杯,3支试管分别加入
,某研究小组利用该反应探究外界条件对反应速率的影响,设计实验如下:分3个小组进行实验,每个小组都准备了3支试管和1个装有水的烧杯,3支试管分别加入 溶液、
溶液、 稀硫酸、蒸馏水若干毫升,将3支试管放入烧杯中,经过一段时间后,再将3支试管的溶液混合,记录溶液出现浑浊的时间。
稀硫酸、蒸馏水若干毫升,将3支试管放入烧杯中,经过一段时间后,再将3支试管的溶液混合,记录溶液出现浑浊的时间。烧杯中水的温度/℃ | 试管1 | 试管2稀硫酸/mL | 试管3蒸馏水/mL | |
第1组 | 20 | 10 | 10 | 0 |
第2组 | 40 | 10 | 10 | 0 |
第3组 | 40 | x | y | 3 |
②设计第3组实验的目的是探究反应温度为40℃时,
 溶液浓度变化对反应速率的影响,则x=
溶液浓度变化对反应速率的影响,则x=
您最近一年使用:0次
名校
10 . 下列说法正确的是
A. 、 、 都是由极性键构成的非极性分子 都是由极性键构成的非极性分子 |
| B.金刚石与石墨烯中的C-C-C夹角都为120° |
C.锗原子( )基态核外电子排布式为 )基态核外电子排布式为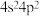 |
| D.ⅣA族元素单质的晶体类型相同 |
您最近一年使用:0次





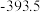
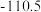
 溶液/mL
溶液/mL

