1 . 下列实验操作或说法中,正确的是
A.用分液漏斗分离苯和 ,先将 ,先将 从下口放出,再将苯从上口倒出 从下口放出,再将苯从上口倒出 |
| B.滴定实验用的锥形瓶用待测液润洗2~3次后,再加入一定体积的待测液 |
| C.实验室制备无水乙醇时,向95%的乙醇溶液中加入足量CaO,然后蒸馏 |
| D.将浓溴水分别加入苯酚溶液和苯中观察实验现象,以证明苯环活化羟基 |
您最近一年使用:0次
2024-09-09更新
|
69次组卷
|
3卷引用:山东省临沂市百师联盟2024-2025学年高三上学期开学考试化学试题
解题方法
2 . 淀粉水解及产物检验的实验步骤如下。
步骤1:取 淀粉溶液,加入
淀粉溶液,加入 滴稀硫酸,水浴加热
滴稀硫酸,水浴加热 ;
;
步骤2:向步骤1所得溶液中加入 溶液调节
溶液调节 至碱性;
至碱性;
步骤3:再加入少量新制 悬浊液,加热
悬浊液,加热 ,观察到有砖红色沉淀生成;
,观察到有砖红色沉淀生成;
步骤4:取 淀粉溶液,重复步骤3操作,未观察到砖红色沉淀生成。
淀粉溶液,重复步骤3操作,未观察到砖红色沉淀生成。
下列有关说法正确的是
步骤1:取
 淀粉溶液,加入
淀粉溶液,加入 滴稀硫酸,水浴加热
滴稀硫酸,水浴加热 ;
;步骤2:向步骤1所得溶液中加入
 溶液调节
溶液调节 至碱性;
至碱性;步骤3:再加入少量新制
 悬浊液,加热
悬浊液,加热 ,观察到有砖红色沉淀生成;
,观察到有砖红色沉淀生成;步骤4:取
 淀粉溶液,重复步骤3操作,未观察到砖红色沉淀生成。
淀粉溶液,重复步骤3操作,未观察到砖红色沉淀生成。下列有关说法正确的是
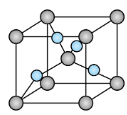
| A.上述实验可证明淀粉水解产生还原性糖 |
B.上图所示的 晶胞中铜原子的配位数为4 晶胞中铜原子的配位数为4 |
| C.向步骤2所得溶液中加入碘水检验水解是否完全 |
| D.步骤1中稀硫酸是淀粉水解的重要反应物之一 |
您最近一年使用:0次
3 . 工业上煅烧含硫矿物产生的 可以按如下流程脱除或利用。
可以按如下流程脱除或利用。
(1)若含硫矿物为黄铁矿( ),则途径Ⅰ煅烧得到的还原产物为
),则途径Ⅰ煅烧得到的还原产物为___________ 。
(2)途径Ⅱ的反应为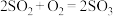 ,该反应在
,该反应在 催化作用下,反应分两步完成。已知第一步反应为:
催化作用下,反应分两步完成。已知第一步反应为: ;写出第二步反应化学方程式
;写出第二步反应化学方程式___________ 。
(3)下列有关说法不正确 的是___________。
(4)若白色沉淀为 ,则X可能是
,则X可能是___________ (写出一种物质化学式即可,下同)若白色沉淀为 ,则X可能是
,则X可能是___________ 。
(5)已知A与水作用能得到 和另一种强酸,则物质A的化学式为
和另一种强酸,则物质A的化学式为___________ ,请设计实验证明A的水溶液中另一种强酸的阴离子___________ 。
 可以按如下流程脱除或利用。
可以按如下流程脱除或利用。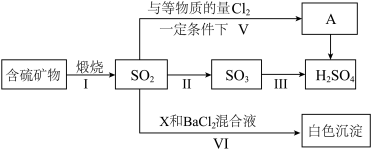
(1)若含硫矿物为黄铁矿(
 ),则途径Ⅰ煅烧得到的还原产物为
),则途径Ⅰ煅烧得到的还原产物为(2)途径Ⅱ的反应为
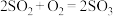 ,该反应在
,该反应在 催化作用下,反应分两步完成。已知第一步反应为:
催化作用下,反应分两步完成。已知第一步反应为: ;写出第二步反应化学方程式
;写出第二步反应化学方程式(3)下列有关说法
A. 通入石蕊试液中,先变红后褪色 通入石蕊试液中,先变红后褪色 |
B.工业上途径Ⅲ常用浓 吸收 吸收 制硫酸 制硫酸 |
C.食品中添加适量的 可以起到防腐作用 可以起到防腐作用 |
| D.铜与浓硫酸反应中,仅体现浓硫酸的强氧化性 |
(4)若白色沉淀为
 ,则X可能是
,则X可能是 ,则X可能是
,则X可能是(5)已知A与水作用能得到
 和另一种强酸,则物质A的化学式为
和另一种强酸,则物质A的化学式为
您最近一年使用:0次
4 . 下列说法合理的是
| A.铁片丢入浓硝酸,常温下不会反应 |
| B.若身上的衣物着火且燃烧面积较大,应躺在地上翻滚以达到灭火的目的 |
| C.向铜和浓硫酸反应后的混合物中加水,若溶液呈蓝色,则证明有硫酸铜生成 |
| D.容量瓶在洗净后,若瓶底有少量水残留则必须烘干,否则所配溶液浓度偏低 |
您最近一年使用:0次
5 . 氮及其化合物的价类二维图如图所示,下列有关说法正确的是
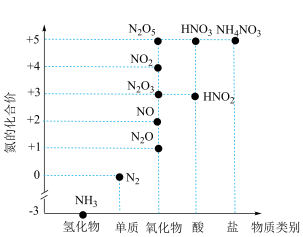
A. 受热易分解,可用作氮肥 受热易分解,可用作氮肥 |
B. 生成 生成 的过程属于氮的固定 的过程属于氮的固定 |
C.“雷雨发庄稼”的原理为: 盐 盐 |
D.向浓HNO3中投入红热的木炭,产生红棕色气体,证明木炭可与浓HNO3反应生成 |
您最近一年使用:0次
6 . 海带中含有碘元素。从海带中提取碘的实验过程如下图所示:_______ (填标号)。
a.酒精灯 b.漏斗 c.坩埚 d.泥三角
(2)步骤⑤的操作名称是_______ 。
(3)碘在水中溶解度不大,但在碘化钾溶液中会形成 从而增大溶解度,
从而增大溶解度, 的空间构型是
的空间构型是__ 。
(4)本试验中没有使用氯水作氧化剂,可能的原因是_______ 。
(5)某实验小组用欲测定海带预处理后所得溶液的碘含量,实验步骤及现象如下: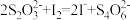 。下列说法不正确的是
。下列说法不正确的是_______ (填标号)。
A.溶液b为蓝色是因为发生了反应:
B.该实验可证明蓝色恢复与空气有关
C.溶液反复由无色变蓝的原因可能是 氧化
氧化 的反应速率比
的反应速率比 还原
还原 的反应速率快
的反应速率快
D.上述实验不能准确测定待定液中的碘含量,应补充实验步骤:滴定前向溶液b中加入少量 ,反应至不再产生气泡,过滤,对滤液进行滴定
,反应至不再产生气泡,过滤,对滤液进行滴定
E. 溶液要装在酸式滴定管中
溶液要装在酸式滴定管中
F.当滴入最后半滴 溶液,溶液从蓝色变为无色,半分钟后不变色即可确定滴定终点
溶液,溶液从蓝色变为无色,半分钟后不变色即可确定滴定终点
(6)单质碘晶胞如图所示: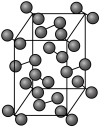 ,每个晶胞平均有
,每个晶胞平均有_______ 个碘原子。
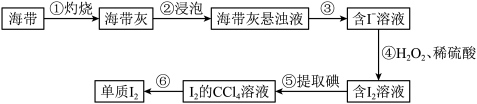
a.酒精灯 b.漏斗 c.坩埚 d.泥三角
(2)步骤⑤的操作名称是
(3)碘在水中溶解度不大,但在碘化钾溶液中会形成
 从而增大溶解度,
从而增大溶解度, 的空间构型是
的空间构型是(4)本试验中没有使用氯水作氧化剂,可能的原因是
(5)某实验小组用欲测定海带预处理后所得溶液的碘含量,实验步骤及现象如下:
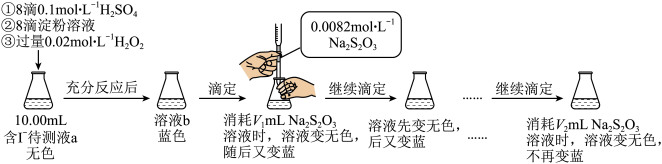
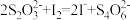 。下列说法不正确的是
。下列说法不正确的是A.溶液b为蓝色是因为发生了反应:

B.该实验可证明蓝色恢复与空气有关
C.溶液反复由无色变蓝的原因可能是
 氧化
氧化 的反应速率比
的反应速率比 还原
还原 的反应速率快
的反应速率快D.上述实验不能准确测定待定液中的碘含量,应补充实验步骤:滴定前向溶液b中加入少量
 ,反应至不再产生气泡,过滤,对滤液进行滴定
,反应至不再产生气泡,过滤,对滤液进行滴定E.
 溶液要装在酸式滴定管中
溶液要装在酸式滴定管中F.当滴入最后半滴
 溶液,溶液从蓝色变为无色,半分钟后不变色即可确定滴定终点
溶液,溶液从蓝色变为无色,半分钟后不变色即可确定滴定终点(6)单质碘晶胞如图所示:
 ,每个晶胞平均有
,每个晶胞平均有
您最近一年使用:0次
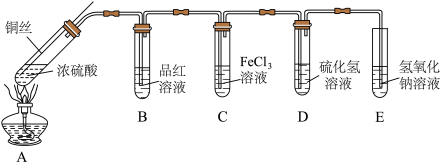
7 . 某化学实验小组的同学利用铜与浓硫酸反应制取二氧化硫并研究其性质,所用实验装置如下:
(1)装置A中发生反应的化学方程式是_____ 。
(2)向外拉铜丝,终止反应,冷却后,进一步证明A装置试管中反应所得产物含有铜离子的操作和现象是______ 。
(3)D中观察到的现象是_______ 。三支试管中的现象分别体现了 的漂白性、
的漂白性、______ 性和_____ 性。
(4)C中发生反应的离子方程式为______ 。E装置的作用是______ 。
(5)化学实验小组的同学发现试管中有黑色物质产生,猜测黑色物质中可能含有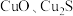 和
和 ,针对产生的黑色物质,该小组同学利用装置A用不同浓度的浓硫酸与铜反应继续实验探究,并获得数据如下表。下列说法错误的是______(填字母)。
,针对产生的黑色物质,该小组同学利用装置A用不同浓度的浓硫酸与铜反应继续实验探究,并获得数据如下表。下列说法错误的是______(填字母)。
已知: 不溶于稀硫酸。
不溶于稀硫酸。
(1)装置A中发生反应的化学方程式是
(2)向外拉铜丝,终止反应,冷却后,进一步证明A装置试管中反应所得产物含有铜离子的操作和现象是
(3)D中观察到的现象是
 的漂白性、
的漂白性、(4)C中发生反应的离子方程式为
(5)化学实验小组的同学发现试管中有黑色物质产生,猜测黑色物质中可能含有
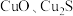 和
和 ,针对产生的黑色物质,该小组同学利用装置A用不同浓度的浓硫酸与铜反应继续实验探究,并获得数据如下表。下列说法错误的是______(填字母)。
,针对产生的黑色物质,该小组同学利用装置A用不同浓度的浓硫酸与铜反应继续实验探究,并获得数据如下表。下列说法错误的是______(填字母)。硫酸浓度/( ) )15 | 黑色物质出现的温度 约150 | 黑色物质消失的温度 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
 不溶于稀硫酸。
不溶于稀硫酸。A.取黑色物质洗涤、干燥后称量,加入足量稀硫酸充分混合,再将所得固体洗涤、干燥后称量,固体质量不变,说明黑色物质中不含 |
B.黑色物质消失过程中有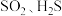 生成 生成 |
| C.相同条件下,硫酸浓度越大,反应速率越快,黑色物质越易出现、越易消失 |
D.硫酸浓度为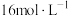 时,先升温至 时,先升温至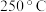 以上,再将铜丝与浓硫酸接触,可以避免产生黑色物质 以上,再将铜丝与浓硫酸接触,可以避免产生黑色物质 |
您最近一年使用:0次
2024-07-16更新
|
15次组卷
|
2卷引用:吉林省吉林市友好学校2023-2024学年高一下学期7月期末考试化学试题
名校
8 . 溴乙烷是重要的化工原料,沸点38.4℃。某兴趣小组设计如下实验装置,利用如下反应制备溴乙烷:NaBr+H2SO4(浓)+C2H5OH→NaHSO4+C2H5Br,并验证可能存在的几种副产物,已知SO2不与Br2的CCl4溶液反应。下列说法错误的是
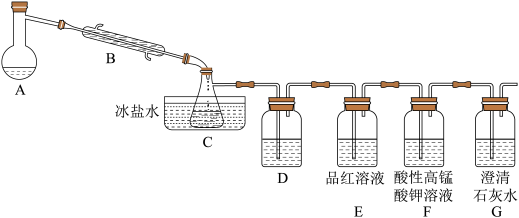
| A.装置C中所得物质可通过水洗-Na2CO3溶液洗-水洗-干燥-蒸馏的方式进行除杂 |
| B.分离提纯过程中将所需产物从分液漏斗下口放出 |
| C.装置D 中盛有Br2的CCl4溶液,用于检验存在副产物乙烯 |
| D.装置G中有白色沉淀的产生即可证明一定有CO2的生成 |
您最近一年使用:0次
解题方法
9 . 周期表中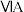 中的O、S、
中的O、S、 及其化合物应用广泛。
及其化合物应用广泛。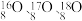 是氧元素的3种核素,其中
是氧元素的3种核素,其中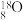 常用作示踪原子;实验证明在室温和常压下
常用作示踪原子;实验证明在室温和常压下 中含有
中含有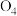 分子,
分子, 在放电的条件下得到
在放电的条件下得到 得到电子生成
得到电子生成 ,吸收
,吸收 的热量;钾的含氧化合物有
的热量;钾的含氧化合物有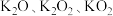 等,
等, 和
和 常用于潜水时的供氧剂。常温下,S在潮湿的空气中可以被缓慢氧化成
常用于潜水时的供氧剂。常温下,S在潮湿的空气中可以被缓慢氧化成 ,S可以用于制黑火药:
,S可以用于制黑火药: 。
。 可以用于橡胶工业的硫化。
可以用于橡胶工业的硫化。 单质具有半导体的特性,可以用于制作半导体材料。回答下列问题。
单质具有半导体的特性,可以用于制作半导体材料。回答下列问题。
1.下列有关说法正确的是
2.下列化学反应表示正确的是
3.下列物质结构与性质或物质性质与用途具有对应关系的是
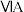 中的O、S、
中的O、S、 及其化合物应用广泛。
及其化合物应用广泛。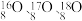 是氧元素的3种核素,其中
是氧元素的3种核素,其中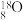 常用作示踪原子;实验证明在室温和常压下
常用作示踪原子;实验证明在室温和常压下 中含有
中含有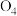 分子,
分子, 在放电的条件下得到
在放电的条件下得到 得到电子生成
得到电子生成 ,吸收
,吸收 的热量;钾的含氧化合物有
的热量;钾的含氧化合物有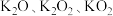 等,
等, 和
和 常用于潜水时的供氧剂。常温下,S在潮湿的空气中可以被缓慢氧化成
常用于潜水时的供氧剂。常温下,S在潮湿的空气中可以被缓慢氧化成 ,S可以用于制黑火药:
,S可以用于制黑火药: 。
。 可以用于橡胶工业的硫化。
可以用于橡胶工业的硫化。 单质具有半导体的特性,可以用于制作半导体材料。回答下列问题。
单质具有半导体的特性,可以用于制作半导体材料。回答下列问题。1.下列有关说法正确的是
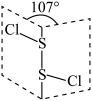
A. 互称为同分异构体 互称为同分异构体 |
B.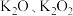 中阴阳离子的个数比不同 中阴阳离子的个数比不同 |
C. 分子中氧原子轨道杂化类型均为 分子中氧原子轨道杂化类型均为 |
D. 的结构如图所示,属于非极性分子 的结构如图所示,属于非极性分子 |
A.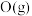 得到电子生成 得到电子生成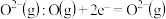  |
B. 与水的反应: 与水的反应: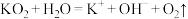 |
C.S在潮湿的空气中氧化成 的反应: 的反应: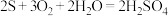 |
D.酸性 溶液与 溶液与 反应: 反应: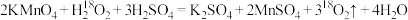 |
| A.S具有还原性,可用于制造黑火药 |
B. 分子中存在 分子中存在 键, 键, 的沸点比 的沸点比 低 低 |
C. 是非金属元素,可以用于制作半导体材料 是非金属元素,可以用于制作半导体材料 |
D. 分子中O上有孤对电子对,可与 分子中O上有孤对电子对,可与 形成配位键 形成配位键 |
您最近一年使用:0次
解题方法
10 . 下列有关实验装置和说法不正确 的是
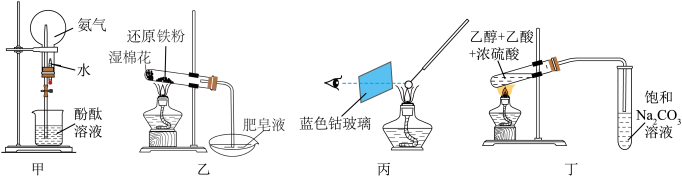
A.图甲圆底烧瓶中看到红色的喷泉,证明 是易溶于水的碱性气体 是易溶于水的碱性气体 |
B.图乙肥皂液中有气泡产生,说明Fe与 反应生成了 反应生成了 |
| C.图丙中观察到火焰颜色为紫色,说明试样中一定存在钾元素 |
D.图丁中饱和 溶液的作用是除去乙酸乙酯中的杂质并降低其溶解度 溶液的作用是除去乙酸乙酯中的杂质并降低其溶解度 |
您最近一年使用:0次



