名校
1 . 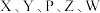 为原子序数依次增大的短周期主族元素。X的电子总数等于电子层数,Y最外层电子数为电子层数的3倍,Z的气态氢化物与其最高价氧化物的水化物反应可生成淡黄色的Z单质,元素P的简单离子半径是同周期元素中最小的。由
为原子序数依次增大的短周期主族元素。X的电子总数等于电子层数,Y最外层电子数为电子层数的3倍,Z的气态氢化物与其最高价氧化物的水化物反应可生成淡黄色的Z单质,元素P的简单离子半径是同周期元素中最小的。由 四种元素及元素Q组成的物质之间的转化关系如图所示,其中C为强酸,
四种元素及元素Q组成的物质之间的转化关系如图所示,其中C为强酸,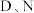 分别是元素Q和W组成的单质(反应过程中部分产物略去);
分别是元素Q和W组成的单质(反应过程中部分产物略去);
(1)W在元素周期表中的位置是___________ ;Z简单阴离子的结构示意图为___________ 。
(2)若A与M均为 微粒,则A的化学式为
微粒,则A的化学式为___________ ,M的电子式为___________ ;
(3)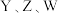 的非金属性由强到弱的顺序为
的非金属性由强到弱的顺序为___________ (用元素符号表示)。
(4)F与B反应生成E的离子方程式为___________ 。
(5)P与W形成的化合物为___________ 化合物(填“离子”或“共价”),其与过量 溶液反应的离子方程式为
溶液反应的离子方程式为___________ 。
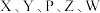 为原子序数依次增大的短周期主族元素。X的电子总数等于电子层数,Y最外层电子数为电子层数的3倍,Z的气态氢化物与其最高价氧化物的水化物反应可生成淡黄色的Z单质,元素P的简单离子半径是同周期元素中最小的。由
为原子序数依次增大的短周期主族元素。X的电子总数等于电子层数,Y最外层电子数为电子层数的3倍,Z的气态氢化物与其最高价氧化物的水化物反应可生成淡黄色的Z单质,元素P的简单离子半径是同周期元素中最小的。由 四种元素及元素Q组成的物质之间的转化关系如图所示,其中C为强酸,
四种元素及元素Q组成的物质之间的转化关系如图所示,其中C为强酸,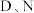 分别是元素Q和W组成的单质(反应过程中部分产物略去);
分别是元素Q和W组成的单质(反应过程中部分产物略去);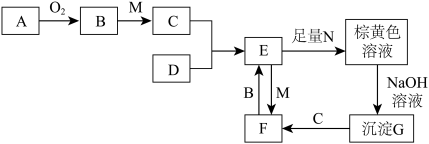
(1)W在元素周期表中的位置是
(2)若A与M均为
 微粒,则A的化学式为
微粒,则A的化学式为(3)
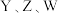 的非金属性由强到弱的顺序为
的非金属性由强到弱的顺序为(4)F与B反应生成E的离子方程式为
(5)P与W形成的化合物为
 溶液反应的离子方程式为
溶液反应的离子方程式为
您最近一年使用:0次
名校
解题方法
2 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经一百多年。元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
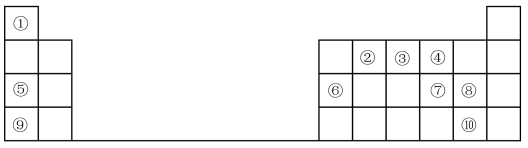
(1)元素②在周期表中的位置___________
(2)元素⑤和⑨的最高价氧化物的水化物中,碱性较强的是___________ (填化学式)。
(3)元素①与⑦可形成18电子分子,请用电子式表示该分子的形成过程:___________ 。
(4)元素⑦⑧⑨的简单离子半径由大到小的顺序是___________ (用离子符号表示),
(5)元素⑨的最高价氧化物的水化物与元素⑥的单质反应的化学方程式为:___________ 。
(6)元素的非金属性⑩___________ ⑧(填“>”或“<”);下列事实不能 证明上述结论的是___________ 。
A.元素⑧的单质与⑩的气态氢化物的水溶液反应,溶液变为橙黄色
B.元素⑧的气态氢化物的水溶液的酸性比元素⑩的弱
C.元素⑧和⑩的气态氢化物受热分解,前者的分解温度高
D.元素⑧的最高价氧化物的水化物的酸性比元素⑩的强
E.元素⑧的气态氢化物的还原性比元素⑩的弱

(1)元素②在周期表中的位置
(2)元素⑤和⑨的最高价氧化物的水化物中,碱性较强的是
(3)元素①与⑦可形成18电子分子,请用电子式表示该分子的形成过程:
(4)元素⑦⑧⑨的简单离子半径由大到小的顺序是
(5)元素⑨的最高价氧化物的水化物与元素⑥的单质反应的化学方程式为:
(6)元素的非金属性⑩
A.元素⑧的单质与⑩的气态氢化物的水溶液反应,溶液变为橙黄色
B.元素⑧的气态氢化物的水溶液的酸性比元素⑩的弱
C.元素⑧和⑩的气态氢化物受热分解,前者的分解温度高
D.元素⑧的最高价氧化物的水化物的酸性比元素⑩的强
E.元素⑧的气态氢化物的还原性比元素⑩的弱
您最近一年使用:0次
2024-02-13更新
|
159次组卷
|
2卷引用:天津市重点校2023-2024学年高一上学期期末联考化学试题
3 . 上海有机化学研究所施世良课题组以Ni(cod)2为催化剂实现了叔醇的手性合成。
(1)Ni在元素周期表中的位置是___________ ,写出其基态原子的最外层电子排布图:___________ 。
(2)Ni(cod)2是指双-(1,5-环辛二烯)镍,其结构如图所示。___________ 种。
②Ni(cod)2分子内存在的作用力有___________ (填序号)。
a.配位键 b.金属键 c.极性键 d.非极性键 e.氢键
(3)葡萄糖(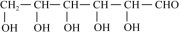 )分子中,手性碳原子个数为
)分子中,手性碳原子个数为 ___________ 。
(4)红银矿NiAs晶体结构如图所示:___________ 。
②两个As原子的原子分数坐标依次为( ,
, ,
, )和
)和___________ 。
③已知晶体密度为pg·cm-3,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则阿伏加德罗常数NA可表示为___________ mol-1(用含m、n和p的代数式表示)。
(1)Ni在元素周期表中的位置是
(2)Ni(cod)2是指双-(1,5-环辛二烯)镍,其结构如图所示。
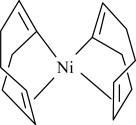
②Ni(cod)2分子内存在的作用力有
a.配位键 b.金属键 c.极性键 d.非极性键 e.氢键
(3)葡萄糖(
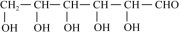 )分子中,手性碳原子个数为
)分子中,手性碳原子个数为 (4)红银矿NiAs晶体结构如图所示:
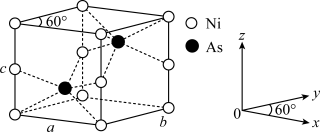
②两个As原子的原子分数坐标依次为(
 ,
, ,
, )和
)和③已知晶体密度为pg·cm-3,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则阿伏加德罗常数NA可表示为
您最近一年使用:0次
4 . 富硒酵母、二氧化硅、硫黄等食品添加剂用于食品生产中,丰富舌尖上的营养和美味。请回答下列问题:
(1)富硒酵母是一种新型添加剂,34Se在元素周期表中的位置为___________ 。
(2)下列说法正确的是___________(填字母)。
(3)短周期元素d、e、f、g、h都可能存在于某些食品添加剂中,其最高正化合价或最低负化合价与原子序数的关系如图所示:
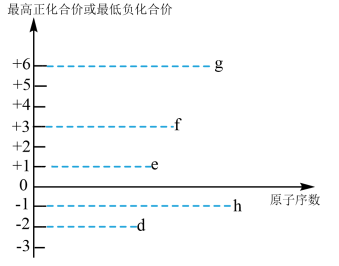
①g的最简单氢化物中含有的化学键类型为___________ (填字母)。
A.离子键 B.非极性共价键 C.极性共价键
②d、e、f、g、h元素形成的简单离子中,半径最大的离子结构示意图为___________ 。
③e和d组成的淡黄色固体的电子式为___________ 。
④写出一种比较e、f两种元素金属性的方法___________ 。
(1)富硒酵母是一种新型添加剂,34Se在元素周期表中的位置为
(2)下列说法正确的是___________(填字母)。
| A.稳定性:H2Se>H2S>H2O | B.36S与74Se的中子数之和为60 |
| C.酸性:H2SeO4>H2SO4>HClO4 | D.还原性:S2>Se2﹣ |
(3)短周期元素d、e、f、g、h都可能存在于某些食品添加剂中,其最高正化合价或最低负化合价与原子序数的关系如图所示:

①g的最简单氢化物中含有的化学键类型为
A.离子键 B.非极性共价键 C.极性共价键
②d、e、f、g、h元素形成的简单离子中,半径最大的离子结构示意图为
③e和d组成的淡黄色固体的电子式为
④写出一种比较e、f两种元素金属性的方法
您最近一年使用:0次
5 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系,如图是元素周期表的一部分,回答下列问题:

(1)元素B在周期表中的位置:___________ ;C元素的名称:___________ 。
(2)元素E最高价氧化物对应水化物的化学式:___________ ;其含有化学键的类型包括:___________ 。
(3)E与F的简单离子半径较大的是___________ (填离子符号),工业冶炼F单质的化学方程式为___________ 。
(4)高温条件下,金属铁可与C的氢化物反应,其化学方程式为:___________ 。

(1)元素B在周期表中的位置:
(2)元素E最高价氧化物对应水化物的化学式:
(3)E与F的简单离子半径较大的是
(4)高温条件下,金属铁可与C的氢化物反应,其化学方程式为:
您最近一年使用:0次
2024-01-25更新
|
63次组卷
|
2卷引用:陕西省安康市第二中学2023-2024学年高一上学期期末考试化学试卷
名校
解题方法
6 . 某钙钛矿 是一种新型半导体材料,用于制造太阳能电池。可用
是一种新型半导体材料,用于制造太阳能电池。可用 、
、 、
、 、
、 制备钙钛矿。
制备钙钛矿。
(1)晶体 属于
属于______ 。
A.离子晶体 B.分子晶体 C.共价晶体
(2)设计实验比较 在
在 、水中的溶解性:
、水中的溶解性:______ 。
(3)制备 的过程如下所示:
的过程如下所示:

①Ⅰ中, 的沸点高于
的沸点高于 的沸点,原因是
的沸点,原因是____________ 。
②Ⅱ中,由于 分子中的
分子中的______ 具有孤电子对,容易与 反应生成盐
反应生成盐 。
。
(4)钙钛矿的稳定性受空气中 、
、 、紫外线等因素的影响。
、紫外线等因素的影响。
ⅰ.
ⅱ.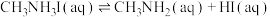
研究发现,一旦生成HI,钙钛矿的分解程度就会增大,请结合化学平衡移动原理解释:____________ 。
我国研究人员利用聚乙二醇有效地解决了该问题。
(5)在钙钛矿中引入有机物M能抑制离子扩散,增加其稳定性。M的合成路线如下:______ 、______ 、______ 。
②以乙醇为起始原料,选用必要的无机试剂合成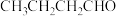 ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
__________________ 。
 是一种新型半导体材料,用于制造太阳能电池。可用
是一种新型半导体材料,用于制造太阳能电池。可用 、
、 、
、 、
、 制备钙钛矿。
制备钙钛矿。(1)晶体
 属于
属于A.离子晶体 B.分子晶体 C.共价晶体
(2)设计实验比较
 在
在 、水中的溶解性:
、水中的溶解性:(3)制备
 的过程如下所示:
的过程如下所示:
①Ⅰ中,
 的沸点高于
的沸点高于 的沸点,原因是
的沸点,原因是②Ⅱ中,由于
 分子中的
分子中的 反应生成盐
反应生成盐 。
。(4)钙钛矿的稳定性受空气中
 、
、 、紫外线等因素的影响。
、紫外线等因素的影响。ⅰ.

ⅱ.
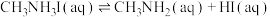
研究发现,一旦生成HI,钙钛矿的分解程度就会增大,请结合化学平衡移动原理解释:
我国研究人员利用聚乙二醇有效地解决了该问题。
(5)在钙钛矿中引入有机物M能抑制离子扩散,增加其稳定性。M的合成路线如下:
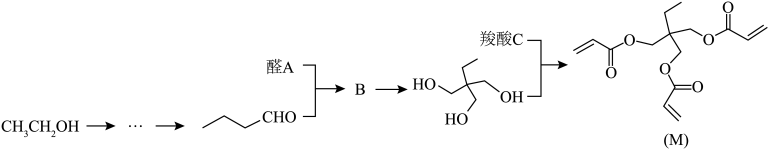
已知: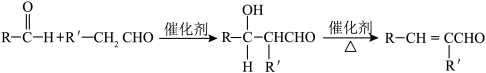 (R、
(R、 表示烃基或氢)
表示烃基或氢)
②以乙醇为起始原料,选用必要的无机试剂合成
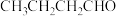 ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
您最近一年使用:0次
名校
解题方法
7 . X、V、Z、M、Q、R皆为周期表中前20号元素,其原子半径与主要化合价的关系如图所示。
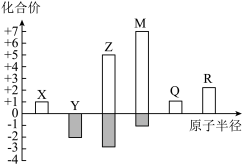
(1)已知X位于第一周期,则 电子式为
电子式为___________ 。
(2)比较Y和Z的简单氢化物,更稳定的是___________ (填化学式)。
(3)已知Q位于第三周期,则R在元素周期表中的位置是___________ 。
(4)下列推断正确的是___________ 。
a.简单离子半径: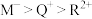
b.由X、Y、Z三种元素组成的化合物可能是盐或碱
c.Z与M的最高价氧化物对应水化物均为强酸
(5)M的单质通入淀粉-KI溶液,溶液变蓝,写出该反应的离子方程式___________ ;比较 和M的阴离子,还原性更强的是
和M的阴离子,还原性更强的是___________ (填离子符号),从原子结构的角度解释原因___________ 。

(1)已知X位于第一周期,则
 电子式为
电子式为(2)比较Y和Z的简单氢化物,更稳定的是
(3)已知Q位于第三周期,则R在元素周期表中的位置是
(4)下列推断正确的是
a.简单离子半径:
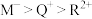
b.由X、Y、Z三种元素组成的化合物可能是盐或碱
c.Z与M的最高价氧化物对应水化物均为强酸
(5)M的单质通入淀粉-KI溶液,溶液变蓝,写出该反应的离子方程式
 和M的阴离子,还原性更强的是
和M的阴离子,还原性更强的是
您最近一年使用:0次
2023-07-12更新
|
267次组卷
|
3卷引用:北京市丰台区2022-2023学年高一下学期期末考试化学试题
8 . 请概括元素的原子结构与元素在元素周期表中位置的关系。______
您最近一年使用:0次
名校
9 . 己二酸是一种重要的化工原料,科学家在现有工业路线基础上,提出了一条“绿色”合成路线;
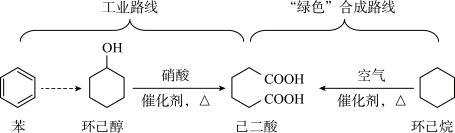
| A.环己烷分子的组成元素均位于元素周期表p区 |
| B.工业路线中涉及苯的取代反应,该反应需使用苯、浓溴水混合加热制得溴苯 |
C.由于环己醇分子之间存在氢键,环己醇的沸点比甲基环己烷(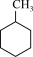 )高 )高 |
| D.己二酸分子中所含σ键个数与π键个数之比为11∶2 |
您最近一年使用:0次
10 . 不同元素的第一电离能 如下图所示。试根据元素在元素周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
如下图所示。试根据元素在元素周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
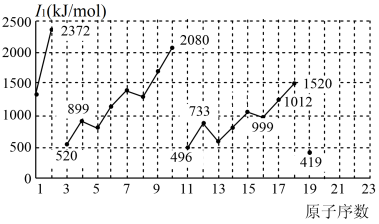
(1)总结同主族内不同元素的 变化的特点
变化的特点______ 。
(2)同周期内,随原子序数增大, 增大。但个别元素的
增大。但个别元素的 出现反常,试预测下列关系中正确的是
出现反常,试预测下列关系中正确的是_______ (填序号)。
① (砷)>
(砷)>  (硒) ②
(硒) ② (砷)<
(砷)<  (硒)
(硒)
③ (溴) >
(溴) >  (硒) ④
(硒) ④ (溴) <
(溴) <  (硒)
(硒)
(3)解释10号元素 较大的原因
较大的原因______ 。
(4)请估计1mol气态基态Ca原子失去最外层一个电子所需能量E的范围______ 。
 如下图所示。试根据元素在元素周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
如下图所示。试根据元素在元素周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
(1)总结同主族内不同元素的
 变化的特点
变化的特点(2)同周期内,随原子序数增大,
 增大。但个别元素的
增大。但个别元素的 出现反常,试预测下列关系中正确的是
出现反常,试预测下列关系中正确的是①
 (砷)>
(砷)>  (硒) ②
(硒) ② (砷)<
(砷)<  (硒)
(硒)③
 (溴) >
(溴) >  (硒) ④
(硒) ④ (溴) <
(溴) <  (硒)
(硒)(3)解释10号元素
 较大的原因
较大的原因(4)请估计1mol气态基态Ca原子失去最外层一个电子所需能量E的范围
您最近一年使用:0次



