名校
解题方法
1 . 下列离子方程式正确的是
A.二元弱碱 与足量稀硫酸溶液反应: 与足量稀硫酸溶液反应: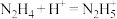 |
B. 溶于浓氨水: 溶于浓氨水: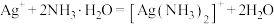 |
C. 溶液中加 溶液中加 溶液: 溶液: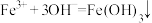 |
D. 溶液吸收 溶液吸收 : : |
您最近一年使用:0次
名校
2 . 化合物 是一种重要中间体,其合成路线如下:
是一种重要中间体,其合成路线如下:_______ 。
(2) 的分子式为C11H14O2,则
的分子式为C11H14O2,则 的结构简式:
的结构简式:_______ 。
(3)1mol 中sp3杂化的原子数目为
中sp3杂化的原子数目为_______ 。
(4)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式_______ 。
①能发生银镜反应;
②能与FeCl3溶液发生显色反应;
③分子中只有4种不同化学环境的氢。
(5)已知: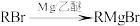
 是一种重要中间体,其合成路线如下:
是一种重要中间体,其合成路线如下:
(2)
 的分子式为C11H14O2,则
的分子式为C11H14O2,则 的结构简式:
的结构简式:(3)1mol
 中sp3杂化的原子数目为
中sp3杂化的原子数目为(4)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式
①能发生银镜反应;
②能与FeCl3溶液发生显色反应;
③分子中只有4种不同化学环境的氢。
(5)已知:
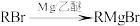
设计以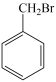 为原料制备
为原料制备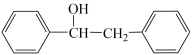 的合成路线(无机试剂和有机溶剂任用,合成路线示例见本题题干)。
的合成路线(无机试剂和有机溶剂任用,合成路线示例见本题题干)。
您最近一年使用:0次
名校
3 . 近年来美国为了遏制中国发展,对我国发起了以封锁“芯片”为核心的全方位打压,此举激发了中国科技人员自研的决心。回答下列问题:
(1)我国现已能够拉制出直径为300mm、重达81kg的大直径硅单晶,晶体硅材料被大量用于电子产业。 反应生成
反应生成 ,判断
,判断 的沸点比
的沸点比 的
的_______ (填“高”或“低”),理由_______ 。
(2)超高导热绝缘耐高温纳米氮化铝,是制造5G芯片的重要绝缘材料。氮化铝晶体与金刚石类似,每个铝原子与_______ 个氮原子相连,氮化铝晶体属于_______ 晶体。
(3)“遥遥领先”的华为芯片制造过程用了蚀刻技术。利用 进行硅芯片蚀刻时的产物均为气体,在蚀刻物表面不留任何残留物。
进行硅芯片蚀刻时的产物均为气体,在蚀刻物表面不留任何残留物。
① 分子的空间构型为
分子的空间构型为_______ 。
② 的一种下游产品三聚氟氰(分子式为:
的一种下游产品三聚氟氰(分子式为: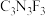 ),分子结构中有类似苯环结构,所有原子均满足8电子结构。写出三聚氟氰的结构式
),分子结构中有类似苯环结构,所有原子均满足8电子结构。写出三聚氟氰的结构式_______ 。
(4)2022年10月宁波南大光电ArF光刻胶生产线正式投产,国内7nm芯片制造材料获得重大突破。一种聚碳酸酯胶的曝光分解原理如下:_______ 。
②聚碳酸酯膜曝光后的产物加热可汽化或溶于水,加热汽化或溶于水克服的作用力有_______ 。
a.配位键 b.离子键 c.范德华力 d.氢键 e.共价键
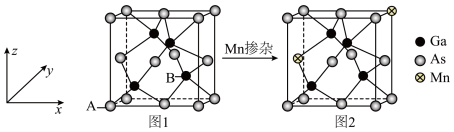
(5)GaAs是一种制造芯片重要的半导体材料,晶胞结构如图1,将Mn掺杂到GaAs的晶体中得到稀磁性半导体材料,如图2。_______ 。
②若GaAs晶体密度为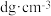 ,设
,设 为阿伏加德罗常数的值,则晶胞中两个As原子间的最小距离为
为阿伏加德罗常数的值,则晶胞中两个As原子间的最小距离为_______ cm(列出计算式即可)。
③稀磁性半导体材料中Mn、As的原子个数比为_______ 。
(1)我国现已能够拉制出直径为300mm、重达81kg的大直径硅单晶,晶体硅材料被大量用于电子产业。
①某同学画出基态Si原子的价层电子排布图: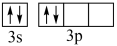 ,该电子排布图违背
,该电子排布图违背
 反应生成
反应生成 ,判断
,判断 的沸点比
的沸点比 的
的(2)超高导热绝缘耐高温纳米氮化铝,是制造5G芯片的重要绝缘材料。氮化铝晶体与金刚石类似,每个铝原子与
(3)“遥遥领先”的华为芯片制造过程用了蚀刻技术。利用
 进行硅芯片蚀刻时的产物均为气体,在蚀刻物表面不留任何残留物。
进行硅芯片蚀刻时的产物均为气体,在蚀刻物表面不留任何残留物。①
 分子的空间构型为
分子的空间构型为②
 的一种下游产品三聚氟氰(分子式为:
的一种下游产品三聚氟氰(分子式为: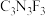 ),分子结构中有类似苯环结构,所有原子均满足8电子结构。写出三聚氟氰的结构式
),分子结构中有类似苯环结构,所有原子均满足8电子结构。写出三聚氟氰的结构式(4)2022年10月宁波南大光电ArF光刻胶生产线正式投产,国内7nm芯片制造材料获得重大突破。一种聚碳酸酯胶的曝光分解原理如下:
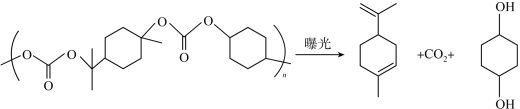
②聚碳酸酯膜曝光后的产物加热可汽化或溶于水,加热汽化或溶于水克服的作用力有
a.配位键 b.离子键 c.范德华力 d.氢键 e.共价键
(5)GaAs是一种制造芯片重要的半导体材料,晶胞结构如图1,将Mn掺杂到GaAs的晶体中得到稀磁性半导体材料,如图2。
②若GaAs晶体密度为
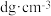 ,设
,设 为阿伏加德罗常数的值,则晶胞中两个As原子间的最小距离为
为阿伏加德罗常数的值,则晶胞中两个As原子间的最小距离为③稀磁性半导体材料中Mn、As的原子个数比为
您最近一年使用:0次
名校
解题方法
4 . CO2的捕获是实现资源利用的重要途径。
(1)烟气中CO2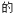 捕集可通过如下所示的物质转化实现。
捕集可通过如下所示的物质转化实现。_______ 。
(2)CO2和H2催化合成CH4。
主要发生反应为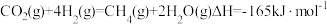 ,一定温度和压强下,将一定比例CO2和H2分别通过装有两种不同催化剂的反应器,反应相同时间,测得CO2转化率随温度变化情况如图1所示。
,一定温度和压强下,将一定比例CO2和H2分别通过装有两种不同催化剂的反应器,反应相同时间,测得CO2转化率随温度变化情况如图1所示。_______ 。
②高于320℃后,用Ni-CeO2作催化剂,CO2转化率略有下降,可能原因是_______ 。
(3)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原CO2的装置示意图如图2所示。控制其他条件相同,将一定量的CO2通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图3所示。_______ 。
②b电极生成HCOOH的电极反应式为_______ 。
③科研小组利用13CO2代替原有的CO2进行研究,其目的是_______ 。
④控制电压为0.8V,电解时转移电子的物质的量为_______ mol。
(1)烟气中CO2
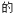 捕集可通过如下所示的物质转化实现。
捕集可通过如下所示的物质转化实现。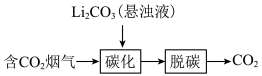
(2)CO2和H2催化合成CH4。
主要发生反应为
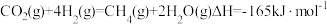 ,一定温度和压强下,将一定比例CO2和H2分别通过装有两种不同催化剂的反应器,反应相同时间,测得CO2转化率随温度变化情况如图1所示。
,一定温度和压强下,将一定比例CO2和H2分别通过装有两种不同催化剂的反应器,反应相同时间,测得CO2转化率随温度变化情况如图1所示。
②高于320℃后,用Ni-CeO2作催化剂,CO2转化率略有下降,可能原因是
(3)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原CO2的装置示意图如图2所示。控制其他条件相同,将一定量的CO2通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图3所示。
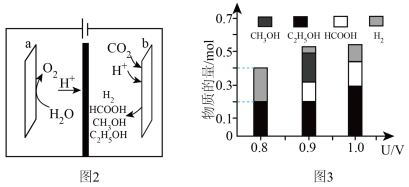
②b电极生成HCOOH的电极反应式为
③科研小组利用13CO2代替原有的CO2进行研究,其目的是
④控制电压为0.8V,电解时转移电子的物质的量为
您最近一年使用:0次
名校
解题方法
5 . 利用含锌废料(主要成分是氧化锌,含有少量铁、铝、铜、锰等金属氧化物或盐)制备氯化锌的一种工艺流程如下:_______ 。(写出任意两点)
(2)为优化工艺流程,盐酸浸取后直接进行高锰酸钾氧化除杂。结合下列图表选择浸取工艺最佳pH范围为_______ ,理由是_______ 。
A.1.5~2.0 B.2.0~3.0 C.3.0~4.0 D.4.5~5.0
(3)滤渣的主要成分有Fe(OH)3、_______ 和MnO2,该工艺中去除锰的离子方程式为_______ 。
(4)最适宜使用的还原剂是_______ 。
(5)氯化锌溶液在蒸发浓缩过程中如操作不当将有碱式盐Zn(OH)Cl生成,该反应方程式为_______ 。
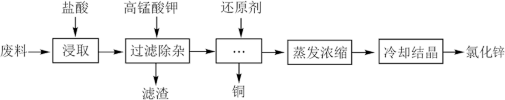
(2)为优化工艺流程,盐酸浸取后直接进行高锰酸钾氧化除杂。结合下列图表选择浸取工艺最佳pH范围为
A.1.5~2.0 B.2.0~3.0 C.3.0~4.0 D.4.5~5.0
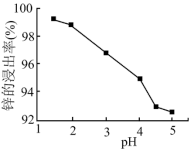
| 金属离子 | Fe2+ | Al3+ | Fe3+ | Cu2+ | Mn2+ | Zn2+ |
| 开始沉淀的pH c=0.01mol·L-1 | 6.8 | 3.7 | 1.8 | 5.2 | 8.6 | 6.7 |
| 沉淀完全的pH c=1.0×10-5mol·L-1 | 8.3 | 4.7 | 2.8 | 6.7 | 10.1 | 8.2 |
(4)最适宜使用的还原剂是
(5)氯化锌溶液在蒸发浓缩过程中如操作不当将有碱式盐Zn(OH)Cl生成,该反应方程式为
您最近一年使用:0次
名校
6 . 下列设计的实验方案不能 达到实验目的是
| 选项 | 实验现象和操作 | 实验目的 |
| A | 向2 mL 0.1mol·L-1 Na2S溶液中滴加0.1 mol·L-1 ZnSO4溶液至不再有沉淀产生,再滴加几滴0.1 mol·L-1 CuSO4溶液,出现黑色沉淀 | 验证Ksp(ZnS)>Ksp(CuS) |
| B | 向装有电石的圆底烧瓶中逐滴加入适量饱和NaCl溶液,将产生的气体通入酸性高锰酸钾溶液中,溶液紫色褪去 | 检验乙炔中含有碳碳三键 |
| C | 以Zn、Fe为电极,以酸化的3% NaCl 溶液作电解质溶液,连接成原电池装置。过一段时间,从Fe电极区域取少量溶液于试管中,再向试管中滴入2滴K3[Fe(CN)6]溶液,观察现象 | 探究金属的牺牲阳极保护法 |
| D | 取5mL0.1 mol·L-1 KI溶液和1mL 0.1mol·L-1 FeCl3溶液充分反应后,加2 mL CCl4振荡、静置后取上层清液滴加少量KSCN溶液,溶液变为红色 | Fe3+与I-的化学反应存在一定限度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
7 . 胍(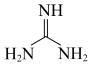 )的盐是病毒核酸保存液的重要成分。下列说法正确的是
)的盐是病毒核酸保存液的重要成分。下列说法正确的是
A.中子数为8的N原子可表示为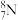 | B.胍中σ键与π键的数目之比为3∶1 |
C.氨基(-NH2)的电子式为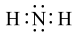 | D.胍分子间能够形成氢键 |
您最近一年使用:0次
名校
解题方法
8 . 下列离子方程式正确的是
A.向Na2SiO3溶液中通入过量CO2: |
B.将等物质的量浓度的 和NH4HSO4溶液以体积比 和NH4HSO4溶液以体积比 混合: 混合: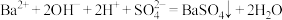 |
C.FeO溶于稀HNO3溶液: |
D.向AlCl3溶液中滴加过量NaOH溶液: |
您最近一年使用:0次
今日更新
|
196次组卷
|
2卷引用:河南省安阳市林州市林州市第一中学2023-2024学年高一下学期6月月考化学试题
名校
解题方法
9 . 可用如图所示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)。请填空:___________ 。
(2)反应的化学方程式:___________ 。
(3)球形干燥管c的作用是___________ 。
(4)饱和Na2CO3溶液,其作用是___________ ,若反应前向饱和Na2CO3溶液中加入几滴石蕊,溶液呈蓝色,反应结束后b中的现象是___________ 。
(5)浓硫酸在该反应中的作用主要有___________ 作用,该作用能使乙酸乙酯的产量增加,从反应速率和平衡的角度解释其原因是___________ 。
(6)已知:CaCl2分别与H2O、NH3、C2H5OH反应生成CaCl2·6H2O、CaCl2·8NH3、CaCl2·6C2H5OH。乙酸乙酯粗产品精制提纯的流程如下。___________ (填序号,下同),试剂X为___________ ,操作2的名称是___________ 。
A.萃取 B.分液 C.过滤 D.蒸馏 E.浓硫酸 F.饱和氯化钙溶液 G.无水硫酸镁 H.无水氯化钙
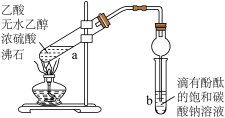
(2)反应的化学方程式:
(3)球形干燥管c的作用是
(4)饱和Na2CO3溶液,其作用是
(5)浓硫酸在该反应中的作用主要有
(6)已知:CaCl2分别与H2O、NH3、C2H5OH反应生成CaCl2·6H2O、CaCl2·8NH3、CaCl2·6C2H5OH。乙酸乙酯粗产品精制提纯的流程如下。
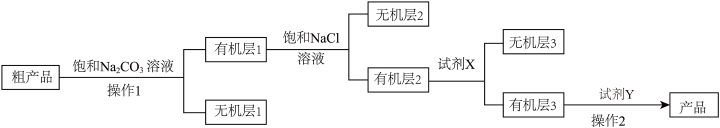
A.萃取 B.分液 C.过滤 D.蒸馏 E.浓硫酸 F.饱和氯化钙溶液 G.无水硫酸镁 H.无水氯化钙
您最近一年使用:0次
名校
10 . 某化学课外小组用如图装置制取溴苯并探究该反应的类型。先向分液漏斗中加入苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中。___________ 。
(2)反应结束后,打开A下端的活塞,让反应液流入B中,充分振荡,目的是___________ 。
(3)C中盛放CCl4的作用是___________ 。
(4)若要证明苯和液溴发生的是取代反应,而不是加成反应,请按要求填写下表。
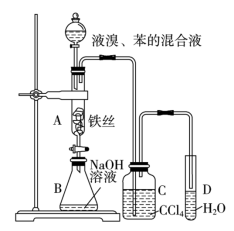
(2)反应结束后,打开A下端的活塞,让反应液流入B中,充分振荡,目的是
(3)C中盛放CCl4的作用是
(4)若要证明苯和液溴发生的是取代反应,而不是加成反应,请按要求填写下表。
| 向试管D中加入的试剂 | |
| 方法一 | |
| 方法二 |
您最近一年使用:0次



