名校
1 . 我国拥有丰富的海洋资源,我们可以从海水中提取食盐,并以此为原料制得具有广泛用途的产品。某制碱工厂以粗盐为原料制纯碱,部分工艺流程如图:

A.流程Ⅰ中为了除去杂质,按顺序依次加入过量 溶液、 溶液、 溶液和 溶液和 溶液,可将粗盐水中的 溶液,可将粗盐水中的 、 、 、 、 转化为沉淀,按流程I所加溶液的顺序除杂,过滤后得到的沉淀含有3种物质 转化为沉淀,按流程I所加溶液的顺序除杂,过滤后得到的沉淀含有3种物质 |
B.流程Ⅲ中将已配制好的 质量分数为 质量分数为 的 的 溶液变成质量分数为 溶液变成质量分数为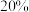 的 的 溶液,需要再加入 溶液,需要再加入 的质量为 的质量为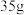 |
C.流程Ⅰ中反应的化学方程式之一是: |
D.流程Ⅱ中生成的沉淀为 |
您最近一年使用:0次
名校
解题方法
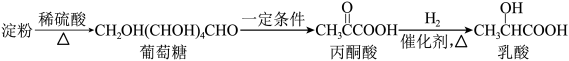
2 . 乳酸在生活中应用广泛,可通过多种途径制得。以淀粉为原料可经过如下转化制得乳酸:________ 。
(2)银氨溶液是实验室常见试剂,以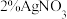 溶液和2%氨水为原料制取银氨溶液的方法是
溶液和2%氨水为原料制取银氨溶液的方法是________ 。
(3)设计检验淀粉与稀硫酸共热后所得水解液中是否含有葡萄糖的实验方案:________ 。
(4)1mol丙酮酸中所含 键的数目为
键的数目为________ 。
(5)乳酸可聚合成易降解的高分子材料,写出该高分子材料分子的结构简式:________ 。
(6)完善以 为原料的物质转化图
为原料的物质转化图______ (燃烧、与酸性 溶液、卤素单质反应除外,同一类型的反应只需写一种,所得有机产物均需写出)
溶液、卤素单质反应除外,同一类型的反应只需写一种,所得有机产物均需写出)
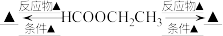
(2)银氨溶液是实验室常见试剂,以
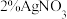 溶液和2%氨水为原料制取银氨溶液的方法是
溶液和2%氨水为原料制取银氨溶液的方法是(3)设计检验淀粉与稀硫酸共热后所得水解液中是否含有葡萄糖的实验方案:
(4)1mol丙酮酸中所含
 键的数目为
键的数目为(5)乳酸可聚合成易降解的高分子材料,写出该高分子材料分子的结构简式:
(6)完善以
 为原料的物质转化图
为原料的物质转化图 溶液、卤素单质反应除外,同一类型的反应只需写一种,所得有机产物均需写出)
溶液、卤素单质反应除外,同一类型的反应只需写一种,所得有机产物均需写出)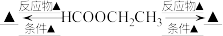
您最近一年使用:0次
7日内更新
|
23次组卷
|
2卷引用:江苏省南京市第九中学2023-2024学年高一下学期教学质量调研(二)化学试题
名校
解题方法
3 .  是重要的食品添加剂。实验室模拟工业制备
是重要的食品添加剂。实验室模拟工业制备 的部分实验流程如下:
的部分实验流程如下: 与
与 混合后放入三颈烧瓶中,加水充分溶解,在90℃下边搅拌边滴加
混合后放入三颈烧瓶中,加水充分溶解,在90℃下边搅拌边滴加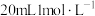 盐酸引发反应,停止滴加盐酸后持续搅拌40min以上,得到热的
盐酸引发反应,停止滴加盐酸后持续搅拌40min以上,得到热的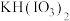 溶液。
溶液。 的浓度;
的浓度;
三颈烧瓶中发生反应:
①用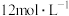 盐酸配制
盐酸配制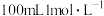 盐酸须使用的玻璃仪器有烧杯、玻璃棒、量筒、
盐酸须使用的玻璃仪器有烧杯、玻璃棒、量筒、________ 。
②反应中 必须过量,若碘不足量,反应过程中会有黄绿色的气体溢出。产生黄绿色气体的原因是
必须过量,若碘不足量,反应过程中会有黄绿色的气体溢出。产生黄绿色气体的原因是________ 。
③能说明反应已经进行完全的标志是________ 。
(2)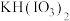 不溶于有机溶剂,除去
不溶于有机溶剂,除去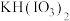 溶液中稍过量
溶液中稍过量 的实验方法是
的实验方法是________ 。
(3)为测定上述流程生产的 样品的纯度,进行如下操作:准确称取
样品的纯度,进行如下操作:准确称取 样品配成250mL溶液,取25mL用硫酸酸化,再加入过量的KI和少量的淀粉溶液,逐滴滴加
样品配成250mL溶液,取25mL用硫酸酸化,再加入过量的KI和少量的淀粉溶液,逐滴滴加 溶液,恰好完全反应时共消耗
溶液,恰好完全反应时共消耗 溶液。通过计算确定样品中
溶液。通过计算确定样品中 的纯度,并写出计算过程
的纯度,并写出计算过程________ 。
已知: ,
,
 是重要的食品添加剂。实验室模拟工业制备
是重要的食品添加剂。实验室模拟工业制备 的部分实验流程如下:
的部分实验流程如下: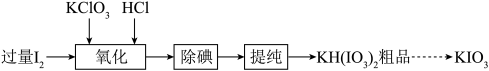
 与
与 混合后放入三颈烧瓶中,加水充分溶解,在90℃下边搅拌边滴加
混合后放入三颈烧瓶中,加水充分溶解,在90℃下边搅拌边滴加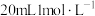 盐酸引发反应,停止滴加盐酸后持续搅拌40min以上,得到热的
盐酸引发反应,停止滴加盐酸后持续搅拌40min以上,得到热的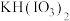 溶液。
溶液。
 的浓度;
的浓度;三颈烧瓶中发生反应:

①用
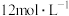 盐酸配制
盐酸配制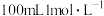 盐酸须使用的玻璃仪器有烧杯、玻璃棒、量筒、
盐酸须使用的玻璃仪器有烧杯、玻璃棒、量筒、②反应中
 必须过量,若碘不足量,反应过程中会有黄绿色的气体溢出。产生黄绿色气体的原因是
必须过量,若碘不足量,反应过程中会有黄绿色的气体溢出。产生黄绿色气体的原因是③能说明反应已经进行完全的标志是
(2)
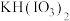 不溶于有机溶剂,除去
不溶于有机溶剂,除去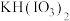 溶液中稍过量
溶液中稍过量 的实验方法是
的实验方法是(3)为测定上述流程生产的
 样品的纯度,进行如下操作:准确称取
样品的纯度,进行如下操作:准确称取 样品配成250mL溶液,取25mL用硫酸酸化,再加入过量的KI和少量的淀粉溶液,逐滴滴加
样品配成250mL溶液,取25mL用硫酸酸化,再加入过量的KI和少量的淀粉溶液,逐滴滴加 溶液,恰好完全反应时共消耗
溶液,恰好完全反应时共消耗 溶液。通过计算确定样品中
溶液。通过计算确定样品中 的纯度,并写出计算过程
的纯度,并写出计算过程已知:
 ,
,
您最近一年使用:0次
7日内更新
|
28次组卷
|
2卷引用:江苏省南京市第九中学2023-2024学年高一下学期教学质量调研(二)化学试题
4 . 室温下,下列实验探究方案能够达到探究目的的是
选项 | 探究方案 | 探究目的 |
A | 向氯水中通入 ,再滴加 ,再滴加 溶液,观察现象 溶液,观察现象 | 氯水中的 能将 能将 氧化 氧化 |
B | 向 溶液中滴加NaOH溶液至过量,观察现象 溶液中滴加NaOH溶液至过量,观察现象 |  具有碱性 具有碱性 |
C | 将1-溴丁烷与NaOH的乙醇溶液混合后加热,产生的气体通入 的 的 溶液中,观察现象 溶液中,观察现象 | 1-溴丁烷能否发生消去反应生成烯烃 |
D | 将灼热的、表面含有CuO的铜丝插入无水乙醇中,观察现象 | 乙醇能否还原CuO |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
7日内更新
|
24次组卷
|
2卷引用:江苏省南京市第九中学2023-2024学年高一下学期教学质量调研(二)化学试题
名校
5 . 化合物Z是合成抗多发性骨髓瘤药物帕比司他的重要中间体,可由下列反应制得。

A.1molX最多能与 发生加成反应 发生加成反应 |
| B.Y中所有碳原子可能在同一平面上 |
| C.Y存在顺反异构 |
D.可用酸性 溶液检验Z中的碳碳双键 溶液检验Z中的碳碳双键 |
您最近一年使用:0次
7日内更新
|
27次组卷
|
2卷引用:江苏省南京市第九中学2023-2024学年高一下学期教学质量调研(二)化学试题
6 .  和亚氯酸钠
和亚氯酸钠 是广泛使用的漂白剂、消毒剂。高浓度
是广泛使用的漂白剂、消毒剂。高浓度 气体易发生爆炸,在生产时需用其他气体稀释。生产
气体易发生爆炸,在生产时需用其他气体稀释。生产 和
和 的工艺流程:
的工艺流程: 发生器中反应为
发生器中反应为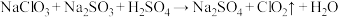 (未配平),下列有关该反应的说法中,不正确的是
(未配平),下列有关该反应的说法中,不正确的是
 和亚氯酸钠
和亚氯酸钠 是广泛使用的漂白剂、消毒剂。高浓度
是广泛使用的漂白剂、消毒剂。高浓度 气体易发生爆炸,在生产时需用其他气体稀释。生产
气体易发生爆炸,在生产时需用其他气体稀释。生产 和
和 的工艺流程:
的工艺流程: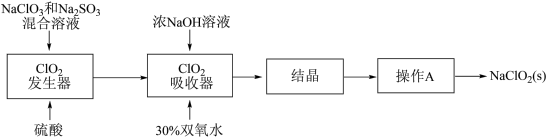
 发生器中反应为
发生器中反应为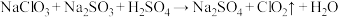 (未配平),下列有关该反应的说法中,不正确的是
(未配平),下列有关该反应的说法中,不正确的是A.反应中 是还原剂 是还原剂 |
B.反应中 是还原产物 是还原产物 |
C.每生成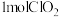 转移 转移 电子 电子 |
D.参加反应的 和 和 的物质的量之比为 的物质的量之比为 |
您最近一年使用:0次
7 . 完成下列问题。
(1)一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸中直接加入纯化后的甲醇(CH3OH),同时向一个电极通入空气。
①此电池的正极发生的电极反应为_______ 。
②电解液中H+向_____ 极移动。
(2)如图所示,该装置通电5 min后,电极5的质量增加2.16 g,回答下列问题:____ 极,A池阴极电极反应:______ ,C池阳极电极反应:_______ 。
②如果B槽中共收集到224 mL气体(标准状况)且溶液体积为200 mL(设电解过程中溶液体积不变),则通电前溶液中Cu2+的物质的量浓度为______ 。
(3)下图各烧杯中盛有海水,铁在其中被腐蚀,腐蚀的速率由大到小的顺序为_____ 。______ 。
(1)一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸中直接加入纯化后的甲醇(CH3OH),同时向一个电极通入空气。
①此电池的正极发生的电极反应为
②电解液中H+向
(2)如图所示,该装置通电5 min后,电极5的质量增加2.16 g,回答下列问题:
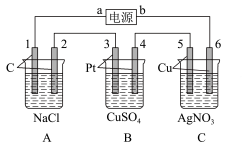
②如果B槽中共收集到224 mL气体(标准状况)且溶液体积为200 mL(设电解过程中溶液体积不变),则通电前溶液中Cu2+的物质的量浓度为
(3)下图各烧杯中盛有海水,铁在其中被腐蚀,腐蚀的速率由大到小的顺序为
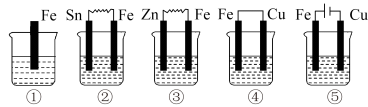
您最近一年使用:0次
解题方法
8 . 在-50 ℃时,液氨的电离跟水的电离相似,存在如下电离平衡:2NH3(l) 
 +
+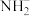 ,
, 的平衡浓度为1×10-15 mol·L-1,下列说法错误的是
的平衡浓度为1×10-15 mol·L-1,下列说法错误的是

 +
+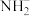 ,
, 的平衡浓度为1×10-15 mol·L-1,下列说法错误的是
的平衡浓度为1×10-15 mol·L-1,下列说法错误的是| A.在液氨中加入NaNH2,可使液氨的离子积变大 |
| B.在液氨中加入NH4Cl,液氨的离子积不变 |
| C.此温度下液氨的离子积K为1×10-30 |
| D.在液氨中加入金属钠可能有NaNH2生成 |
您最近一年使用:0次
9 . 完成下列问题。
(1)已知在25 ℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表所示。
①亚硫酸发生电离的方程式为______ 。
②碳酸和亚硫酸的第一步电离程度大于第二步电离程度的原因:______ 。
③在相同条件下,试比较H2CO3、 和
和 的酸性强弱:
的酸性强弱:____ >____ >____ 。
(2)在一定温度下,冰醋酸加水稀释的过程中,溶液的导电能力变化如图所示,请回答:____ 。
②a、b、c三点溶液的pH由大到小的顺序为____ ,电离程度最大的是____ 。
③若使c点溶液中c(CH3COO-)增大,在如下措施中可选择____ (填字母)。
A.加热 B.加很稀的NaOH溶液 C.加固体KOH
D.加水 E.加CH3COONa(s) F.加锌粉
(3)向氨水中加入醋酸溶液,其导电能力(I)与加入醋酸溶液的体积(V)关系正确的是______。
(1)已知在25 ℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表所示。
| 酸 | 电离平衡常数 |
| 醋酸 | Ka=1.75×10-5 |
| 碳酸 | Ka1=4.30×10-7 Ka2=5.61×10-11 |
| 亚硫酸 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
②碳酸和亚硫酸的第一步电离程度大于第二步电离程度的原因:
③在相同条件下,试比较H2CO3、
 和
和 的酸性强弱:
的酸性强弱:(2)在一定温度下,冰醋酸加水稀释的过程中,溶液的导电能力变化如图所示,请回答:
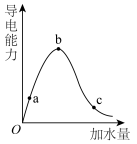
②a、b、c三点溶液的pH由大到小的顺序为
③若使c点溶液中c(CH3COO-)增大,在如下措施中可选择
A.加热 B.加很稀的NaOH溶液 C.加固体KOH
D.加水 E.加CH3COONa(s) F.加锌粉
(3)向氨水中加入醋酸溶液,其导电能力(I)与加入醋酸溶液的体积(V)关系正确的是______。
A.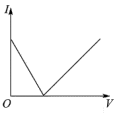 | B.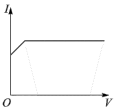 | C.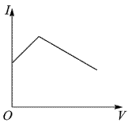 | D. |
您最近一年使用:0次
10 . 某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的是
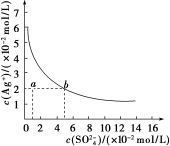
A.含有大量 的溶液中肯定不存在Ag+ 的溶液中肯定不存在Ag+ |
| B.0.02 mol/L的AgNO3溶液与0.2 mol/L的Na2SO4溶液等体积混合不会生成沉淀 |
| C.Ag2SO4的溶度积常数(Ksp)为1×10-5 |
| D.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 |
您最近一年使用:0次



