1 . 某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2液中需加入少量铁屑,其目的是________ 。
(2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______ 。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是______ 。
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
① 第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
② 第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③ 第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是_____ (填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有______ (填离子符号),由此可以证明该氧化还原反应为______ 。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液·变成棕黄色,发生反应的离子方程式为________ ;一段时间后.溶液中有气泡出现,并放热.随后有红褐色沉淀生成。产生气泡的原因是______ ;生成沉淀的原因是______ (用平衡移动原理解释)。
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2液中需加入少量铁屑,其目的是
(2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
① 第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
② 第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③ 第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液·变成棕黄色,发生反应的离子方程式为
您最近一年使用:0次
2019-01-30更新
|
5626次组卷
|
40卷引用:黑龙江省大庆实验中学2018届高三上学期第一次月考理科综合化学试题
黑龙江省大庆实验中学2018届高三上学期第一次月考理科综合化学试题黑龙江省哈尔滨市第九中学2017-2018学年高一上学期期末考试化学试题黑龙江省牡丹江市第一高级中学2021届高三上学期开学考试化学试题2016年全国普通高等学校招生统一考试化学(新课标2卷精编版)2017届湖北省应城一中高三上学期调研测试化学试卷2017届四川省双流中学高三上学期10月月考化学试卷2017届广西桂林十八中高三上10月月考化学试卷2017届海南省海南中学高三上学期月考三化学试卷2016-2017学年广东省清远三中高二上第二次月考化学卷2017届四川省泸州市泸化中学高三上10月月考化学卷2016-2017学年北京五十六中九高三上学期期中考试化学试卷天津市南开区2017届高三高考二模化学试卷内蒙古巴彦淖尔市第一中学2018届高三上学期期中考试理科综合化学试题甘肃省会宁县第一中学2018届高三上学期第三次月考理科综合化学试题青海省西宁二十一中2018届高三上学期12月月考化学试卷(已下线)解密05 金属及其化合物(教师版)——备战2018年高考化学之高频考点解密【校级联考】安徽省江南片2019届高三上学期入学摸底考试化学试题陕西安康市紫阳县紫阳中学2019届高三上学期入学调研考试化学试题福建省泉州第五中学2019届高三入学调研考试化学试题【校级联考】福建省龙岩市非一级达标校2018-2019学年高二上学期期末教学质量检查化学试题2016年全国普通高等学校招生统一考试化学(全国2卷参考版)内蒙古包头稀土高新区二中2020届高三10月月考理综化学试题吉林省长春市东北师大附中2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分(已下线)专题3.3 铁及其重要化合物(讲)——2020年高考化学一轮复习讲练测广东省韶关市2019-2020学年高二下学期期末考试化学试题(已下线)第11讲 铁及其重要化合物(精讲)——2021年高考化学一轮复习讲练测(已下线)专题讲座(三)“铁三角”综合实验题解题策略(精练)——2021年高考化学一轮复习讲练测(已下线)专题讲座(九) 热点实验综合探究 (精练)-2021年高考化学一轮复习讲练测(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)四川省邻水实验学校2022届高三上学期入学考试理综化学试题(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)【教材实验热点】04 Fe(OH)2与Fe(OH)3胶体的制备(已下线)考点14 铁及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)第三章 金属及其化合物 第13讲 铁及其重要化合物(已下线)题型31 Fe2+、Fe3+的检验与性质探究(已下线)第一部分 化学综合实验 热点6 物质性质探究实验
解题方法
2 . 短周期主族元素A,B,C,D,E,F的原子序数依次增大,它们的原子核外电子层数之和为13。B的化合物种类繁多,数目庞大;C,D是空气中含量最多的两种元素,D,E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(一)(1)D在周期表中的位置是_______ ,写出实验室制备单质F的离子方程式__________ 。
(2)化学组成为BDF2的电子式为:______ ,A、C、F三种元素形成的化合物CA4F为________ 化合物(填 “离子”或“共价”)。
(3)化合物甲、乙由A,B,D,E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为:______________________________ 。
(4)由C,D,E,F形成的简单离子的离子半径由大到小的顺序是_________ (用元素离子符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性________ 于F(填“强”或“弱”),并用化学方程式证明上述结论___________________________________________________ 。
(二)以CA3代替氢气研发氨燃料电池是当前科研的一个热点。
(1)CA3燃料电池使用的电解质溶液是2mol•L﹣1的KOH溶液,电池反应为:4 CA3+3O2=2C2+6H2O.该电池负极的电极反应式为________ ;每消耗3.4g CA3转移的电子数目为______ 。
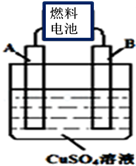
(2)用CA3燃料电池电解CuSO4溶液,如图所示,A、B均为铂电极,通电一段时间后,在A电极上有红色固体析出,则B电极上发生的电极反应式为______ ;此时向所得溶液中加入8gCuO固体后恰好可使溶液恢复到电解前的浓度,则电解过程中收集到的气体在标准状况下体积为________ L。
(3)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。

图1 图2
0~t1时,原电池的负极是Al片,此时,正极的电极反应式是____ ,溶液中的H+向_____ 极移动(填“正”或“负”),t1时,原电池中电子流动方向发生改变,其原因是___________ 。
(一)(1)D在周期表中的位置是
(2)化学组成为BDF2的电子式为:
(3)化合物甲、乙由A,B,D,E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为:
(4)由C,D,E,F形成的简单离子的离子半径由大到小的顺序是
(5)元素B和F的非金属性强弱,B的非金属性
(二)以CA3代替氢气研发氨燃料电池是当前科研的一个热点。
(1)CA3燃料电池使用的电解质溶液是2mol•L﹣1的KOH溶液,电池反应为:4 CA3+3O2=2C2+6H2O.该电池负极的电极反应式为
(2)用CA3燃料电池电解CuSO4溶液,如图所示,A、B均为铂电极,通电一段时间后,在A电极上有红色固体析出,则B电极上发生的电极反应式为

(3)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。

图1 图2
0~t1时,原电池的负极是Al片,此时,正极的电极反应式是
您最近一年使用:0次
3 . 下表是元素周期表的一部分,回答下列有关问题:

(1)写出下列元素符号:①_______ ,⑥_______ ,⑦______ 。
(2)在①-⑿元素中,金属性最强的元素是_______ ,非金属性最强的元素是_______ ,最不活泼的元素是_______ 。(均填元素符号)
(3)元素⑦与元素⑧相比,非金属性较强的是_______ (用元素符号表示),下列表述中能证明这一事实的是_______ 。

(1)写出下列元素符号:①
(2)在①-⑿元素中,金属性最强的元素是
(3)元素⑦与元素⑧相比,非金属性较强的是
| A.常温下⑦的单质和⑧的单质状态不同 |
| B.⑧的氢化物比⑦的氢化物稳定 |
| C.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应 |
| D.⑧的最高价氧化物的水化物的酸性比⑦的最高价氧化物的水化物的酸性强 |
您最近一年使用:0次
名校
解题方法
4 . 框图中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。
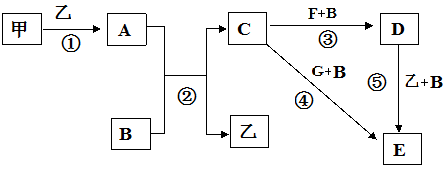
请问答下列问题:
(1)反应①-⑤中,既属于氧化还原反应又属于化合反应的是______________ (填序号)。
(2)反应⑤的化学方程式为____________________________ 。
(3)甲与B反应的离子方程式_______________________________ 。
(4)在实验室将C溶液滴入F溶液中,观察到的现象是______________________ 。
(5)在F溶液中加入等物质的量的A,发生反应的总的离子方程式为:__________________ 。
(6)已知:酚酞在c(OH-)为1.0×10-4mol/L~2.5mol/L时呈红色,且半分钟内不褪色。向3.9g A和50g B混合后的溶液中滴入2滴酚酞试液,溶液变红色,片刻红色褪去(假设过程中液体体积不变)。
①甲同学认为“红色迅速褪去”是由于溶液中c(OH-)过大造成的,上述观点是否正确___________ 。
②乙同学认为“红色迅速褪去”是由于A + B = 碱 + H2O2 ,H2O2具有氧化性和漂白性导致的,设计实验证明烧瓶内溶液中含H2O2,简述实验方法_____________________ 。

请问答下列问题:
(1)反应①-⑤中,既属于氧化还原反应又属于化合反应的是
(2)反应⑤的化学方程式为
(3)甲与B反应的离子方程式
(4)在实验室将C溶液滴入F溶液中,观察到的现象是
(5)在F溶液中加入等物质的量的A,发生反应的总的离子方程式为:
(6)已知:酚酞在c(OH-)为1.0×10-4mol/L~2.5mol/L时呈红色,且半分钟内不褪色。向3.9g A和50g B混合后的溶液中滴入2滴酚酞试液,溶液变红色,片刻红色褪去(假设过程中液体体积不变)。
①甲同学认为“红色迅速褪去”是由于溶液中c(OH-)过大造成的,上述观点是否正确
②乙同学认为“红色迅速褪去”是由于A + B = 碱 + H2O2 ,H2O2具有氧化性和漂白性导致的,设计实验证明烧瓶内溶液中含H2O2,简述实验方法
您最近一年使用:0次
2016-12-09更新
|
989次组卷
|
2卷引用:2017届黑龙江大庆实验中学高三上期中化学卷
5 . 碳酸镍可用于电镀、陶瓷器着色等。镍矿渣中镍元素的主要存在形式是Ni(OH)2和NiS(含有Fe、Cu、Ca、Mg、Zn等元素杂质),从镍矿渣出发制备碳酸镍的流程如下:

已知:常温下,溶度积常数
(1)浸取出Ni2+时反应的离子方程式有①________________ ,②NiS + ClO3- + H+ — Ni2+ + S + Cl- + H2O(未配平),此反应中还原产物与氧化产物的物质的量比为____________ 。
(2)经实验检验,含Ni2+浸出液中铁元素的存在形式只有Fe3+,证明该溶液中无Fe2+可选用的试剂是_____________ ,现象为________________ 。
(3)加入Na2CO3溶液沉铁时生成难溶于水的黄钠铁矾[NaFe3(SO4)2(OH)6]和一种无色气体。写出此反应的离子方程式:___________________________ 。
(4)加入NiS的作用是除去溶液中的Cu2+,原理是NiS(s) + Cu2+(aq) CuS(s) + Ni2+(aq),过滤后,溶液中c(Ni2+) =" 0.107" mol·L-1对,溶液中残留c(Cu2+)为
CuS(s) + Ni2+(aq),过滤后,溶液中c(Ni2+) =" 0.107" mol·L-1对,溶液中残留c(Cu2+)为__________ mol·L-1。
(5)加入NaF的作用是___________________________ 。
(6)加入Na2CO3溶液沉镍,检验Ni2+是否沉淀完全的方法是____________________ 。

已知:常温下,溶度积常数
| 难溶物 | NiS | ZnS | CuS | CaF2 | MgF2 |
| 溶度积常数 | 1.07 × 10-21 | 2.93 × 10-25 | 1.27 × 10-36 | 1.46 × 10-10 | 7.42 × 10-11 |
(2)经实验检验,含Ni2+浸出液中铁元素的存在形式只有Fe3+,证明该溶液中无Fe2+可选用的试剂是
(3)加入Na2CO3溶液沉铁时生成难溶于水的黄钠铁矾[NaFe3(SO4)2(OH)6]和一种无色气体。写出此反应的离子方程式:
(4)加入NiS的作用是除去溶液中的Cu2+,原理是NiS(s) + Cu2+(aq)
 CuS(s) + Ni2+(aq),过滤后,溶液中c(Ni2+) =" 0.107" mol·L-1对,溶液中残留c(Cu2+)为
CuS(s) + Ni2+(aq),过滤后,溶液中c(Ni2+) =" 0.107" mol·L-1对,溶液中残留c(Cu2+)为(5)加入NaF的作用是
(6)加入Na2CO3溶液沉镍,检验Ni2+是否沉淀完全的方法是
您最近一年使用:0次
6 . 三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4, Cu2O在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是_________ 。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?___________ 。
(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是________ ,写出发生反应的离子方程式________ 。
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为________________ 。
(5)欲利用红色粉末Fe2O3和Cu2O的混合物制取较纯净的胆矾(CuSO4∙5H2O),经查阅资料得知,在溶液中调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH
实验室有下列试剂可供选择:
A.氯水
B.H2O2
C.硝酸
D.NaOH
E.氨水
F.Cu2(OH)2CO3
实验小组设计如下实验方案:
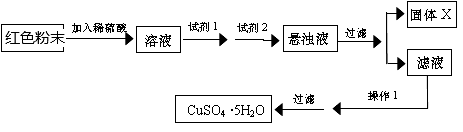
试回答:①试剂I为____________ ,试剂II为_____________ (填字母)。
②固体X的化学式为_______________ 。
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4, Cu2O在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?
(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为
(5)欲利用红色粉末Fe2O3和Cu2O的混合物制取较纯净的胆矾(CuSO4∙5H2O),经查阅资料得知,在溶液中调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH[来: | 13 | 14 | 3.7 |
A.氯水
B.H2O2
C.硝酸
D.NaOH
E.氨水
F.Cu2(OH)2CO3
实验小组设计如下实验方案:
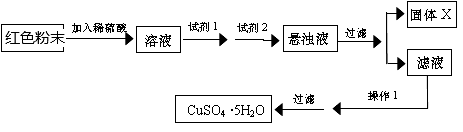
试回答:①试剂I为
②固体X的化学式为
您最近一年使用:0次
名校
7 . 某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
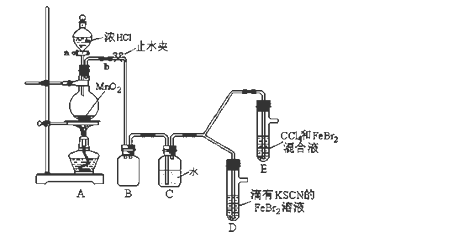
(1)①装置A中发生反应的离子方程式是_____________________ 。
②整套实验装置存在一处明显的不足,请指出_______________________ 。
(2)用改正后的装置进行实验,实验过程如下:
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化 。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________________________________________ ,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加______________ 溶液,若溶液颜色________ ,则上述解释是合理的。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式 (离子或化学方程式不限定)解释产生白色沉淀原因__________________ 、_______________________

(1)①装置A中发生反应的离子方程式是
②整套实验装置存在一处明显的不足,请指出
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由 |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN- Fe(SCN)3 是一个可逆反应。 Fe(SCN)3 是一个可逆反应。ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2 。 ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。 ⅳ.AgClO、AgBrO均可溶于水。 |
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用
您最近一年使用:0次
2016-12-09更新
|
1549次组卷
|
5卷引用:【百强校】黑龙江省牡丹江市第一高级中学2019届高三上学期期末考试化学试题
8 . 绿矾(FeSO4·7H2O)可作还原剂、着色剂、制药等,在不同温度下易分解得各种铁的氧化物和硫的氧化物。已知SO3是一种无色晶体,熔点16.8℃,沸点44.8℃,氧化性及脱水性较浓硫酸强,能漂白某些有机染料,如品红等。回答下列问题:

(1)甲组同学按照上图所示的装置,通过实验检验绿矾的分解产物。装置B中可观察到的现象是__________ ,甲组由此得出绿矾的分解产物中含有SO2。装置C的作用是______________ 。
(2)乙组同学认为甲组同学的实验结论不严谨,认为需要补做实验。乙对甲组同学做完实验的B装置的试管加热,发现褪色的品红溶液未恢复红色,则可证明绿矾分解的产物中___________ 。(填字母)
A.不含SO2B.可能含SO2C.一定含有SO3
(3)丙组同学查阅资料发现绿矾受热分解还可能有O2放出,为此,丙组同学选用甲组同学的部分装置和下图部分装置设计出了一套检验绿矾分解气态产物的装置:
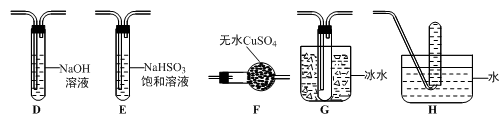
①丙组同学的实验装置中,依次连接的合理顺序为______________________ 。
②能证明绿矾分解产物中有O2的实验操作及现象是_______________________ 。
(4)为证明绿矾分解产物中含有三价铁,选用的实验仪器有试管、胶头滴管、_____________ ;选用的试剂为_____________ 。

(1)甲组同学按照上图所示的装置,通过实验检验绿矾的分解产物。装置B中可观察到的现象是
(2)乙组同学认为甲组同学的实验结论不严谨,认为需要补做实验。乙对甲组同学做完实验的B装置的试管加热,发现褪色的品红溶液未恢复红色,则可证明绿矾分解的产物中
A.不含SO2B.可能含SO2C.一定含有SO3
(3)丙组同学查阅资料发现绿矾受热分解还可能有O2放出,为此,丙组同学选用甲组同学的部分装置和下图部分装置设计出了一套检验绿矾分解气态产物的装置:

①丙组同学的实验装置中,依次连接的合理顺序为
②能证明绿矾分解产物中有O2的实验操作及现象是
(4)为证明绿矾分解产物中含有三价铁,选用的实验仪器有试管、胶头滴管、
您最近一年使用:0次
2017-02-17更新
|
2440次组卷
|
9卷引用:黑龙江省双鸭山市第一中学2021届高三上学期第一次月考化学试题
9 . 某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验,请回答下列问题:

(1)装置甲中盛放浓硝酸的仪器A的名称是 ,仪器B中发生反应的化学方程式为
(2)完成下面表格中的空白
(3)取下装置丙中的试管C,向其中滴加足量的Na2SO3溶液,溶液颜色褪去,该过程中发生反应的离子方程式为 。
反应后的溶液中主要含有SO32—、SO42—、I—等阴离子,请填写鉴定SO32—、SO42—和I—的实验报告。
限选试剂:2mol/LHCl、1mol/LH2SO4、1mol/LBaCl2、1mol/LBa(NO3)2、CCl4、新制饱和溴水、新制饱和氯水。

(1)装置甲中盛放浓硝酸的仪器A的名称是 ,仪器B中发生反应的化学方程式为
(2)完成下面表格中的空白
| 装置编号 | 实验现象 | 反应的化学方程式 | NO2表现的化学性质 |
| 乙 | 淡黄色固体变白色 | Na2O2+2NO2=2NaNO3 | |
| 丙 | | 氧化性 |
反应后的溶液中主要含有SO32—、SO42—、I—等阴离子,请填写鉴定SO32—、SO42—和I—的实验报告。
限选试剂:2mol/LHCl、1mol/LH2SO4、1mol/LBaCl2、1mol/LBa(NO3)2、CCl4、新制饱和溴水、新制饱和氯水。
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤1 | 取少量待测液于试管A中,加入几滴新制得饱和溴水,振荡 | ,证明待测液中含有SO32— |
| 步骤2 | | |
| 步骤3 | 另取少量待测液于试管C中,加入足量氯水,再加入四氯化碳,振荡、静置后观察颜色 | ,证明待测液中含有I- |
您最近一年使用:0次
10 . 研究硫元素及其化合物的性质具有重要意义。
Ⅰ.利用下图装置模拟工业生产中SO2催化氧化的反应并研究SO2的性质:(熔点:SO2-76.1℃,SO316.8℃;沸点:SO2-10℃,SO345℃)

(1)甲同学按I、II、III、IV的顺序连接装置,装置II的作用是________________________ ;装置III中溶液逐渐褪色,证明二氧化硫具有_______ 性。
(2)乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置(装置Ⅱ中充分冷却),若装置Ⅳ中有40 mL 3.0mol/L NaOH溶液,反应后增重5.12 g,则装置Ⅳ中发生反应的化学方程式是____________________________ 。
(3)某同学将足量的SO2通入一支装有氯化钡溶液的试管中,未见沉淀生成。向该试管中加入足量_____ (填字母),便能产生沉淀。
Ⅱ.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
称取铁钉(碳素钢)6g放入15mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
(4)甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+应选用________ (选填序号)。
a.KSCN溶液和氯水
b.氢氧化钠溶液
c.酸性KMnO4溶液
d.铁粉和KSCN溶液
(5)乙同学取784 mL(标准状况)气体Y通入足量H2O2水溶液中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积百分数为_________ 。(保留小数点后一位)
(6)分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和CO2气体,产生CO2的理由是_______________________ (用化学方程式表示)。
Ⅰ.利用下图装置模拟工业生产中SO2催化氧化的反应并研究SO2的性质:(熔点:SO2-76.1℃,SO316.8℃;沸点:SO2-10℃,SO345℃)

(1)甲同学按I、II、III、IV的顺序连接装置,装置II的作用是
(2)乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置(装置Ⅱ中充分冷却),若装置Ⅳ中有40 mL 3.0mol/L NaOH溶液,反应后增重5.12 g,则装置Ⅳ中发生反应的化学方程式是
(3)某同学将足量的SO2通入一支装有氯化钡溶液的试管中,未见沉淀生成。向该试管中加入足量
| A.硫化钠溶液 | B.氨水 | C.盐酸 | D.硝酸钾溶液 |
称取铁钉(碳素钢)6g放入15mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
(4)甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+应选用
a.KSCN溶液和氯水
b.氢氧化钠溶液
c.酸性KMnO4溶液
d.铁粉和KSCN溶液
(5)乙同学取784 mL(标准状况)气体Y通入足量H2O2水溶液中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积百分数为
(6)分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和CO2气体,产生CO2的理由是
您最近一年使用:0次



