1 . CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式________________________ 。
(2)写出NaClO3发生反应的主要离子方程式____________________________ ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_____________________
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为__________________ ,加入萃取剂的目的是_____________________________ 。
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是___________________ 。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3 溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是_______________ 。(答一条即可)

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式
(2)写出NaClO3发生反应的主要离子方程式
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3 溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是
您最近一年使用:0次
2016-12-09更新
|
289次组卷
|
3卷引用:2016届黑龙江双鸭山第一中学高三上学期期中测试化学试卷
2 . 肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O)。
CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl
实验一: 制备NaClO溶液(实验装置如图所示)
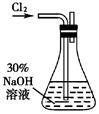
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有___ (填标号)
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)锥形瓶中发生反应化学程式是____________________________ 。
(3)利用中和滴定反应原理测定反应后锥形瓶中混合溶液的NaOH的浓度。取一定量锥形瓶内混合溶液稀释一定倍数后,加入适量的H2O2溶液后,再滴加2-3滴甲基橙试液,用0.100mol/L盐酸滴定。需要加入H2O2除去ClO-的原因是_____________________ 。
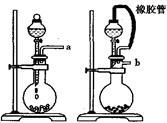
实验二: 制取水合肼。(实验装置如图所示)

控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108-114℃馏分(已知:N2H4·H2O易被NaClO氧化,高温易分解)
(4)分液漏斗中的溶液是___________ (填标号)。
A.CO (NH2) 2溶液 B.NaOH和NaClO混合溶液
选择的理由是__________________________________________ 。
蒸馏时需要减压,原因是________________________________ 。
实验三: 测定馏分中肼含量。
称取馏分5.000g,加入适量NaHCO3固体,加水配成1000mL溶液,移出10.00mL,用0.1000mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。
滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是能与在滴定过程中产生的_____ 反应。
(6)实验测得消耗I2溶液的平均值为16.40mL,馏分中水合肼(N2H4·H2O)的质量分数为___ 。
CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl
实验一: 制备NaClO溶液(实验装置如图所示)

(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)锥形瓶中发生反应化学程式是
(3)利用中和滴定反应原理测定反应后锥形瓶中混合溶液的NaOH的浓度。取一定量锥形瓶内混合溶液稀释一定倍数后,加入适量的H2O2溶液后,再滴加2-3滴甲基橙试液,用0.100mol/L盐酸滴定。需要加入H2O2除去ClO-的原因是
实验二: 制取水合肼。(实验装置如图所示)

控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108-114℃馏分(已知:N2H4·H2O易被NaClO氧化,高温易分解)
(4)分液漏斗中的溶液是
A.CO (NH2) 2溶液 B.NaOH和NaClO混合溶液
选择的理由是
蒸馏时需要减压,原因是
实验三: 测定馏分中肼含量。
称取馏分5.000g,加入适量NaHCO3固体,加水配成1000mL溶液,移出10.00mL,用0.1000mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。
滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是能与在滴定过程中产生的
(6)实验测得消耗I2溶液的平均值为16.40mL,馏分中水合肼(N2H4·H2O)的质量分数为
您最近一年使用:0次
3 . 碳酸氢铵是我国主要的氮肥品种之一,在贮存和运输过程中容易挥发损失。为了鉴定其质量和确定田间施用量,必须测定其含氮量。
Ⅰ.某学生设计了一套以测定二氧化碳含量间接测定含氮量的方法。将样品放入圆底烧瓶中:
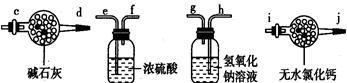
(1)请选择必要地装置,按气流方向连接顺序为___________ 。
(2)分液漏斗中的液体最适合的是___________ 。
A.稀盐酸 B.稀硫酸 C.浓硝酸 D.氢氧化钠
(3)连在最后的装置起到的作用___________ 。
Ⅱ.如果氮肥中成分是(NH4)2SO4,则可以用甲醛法测定含氮量。甲醛法是基于甲醛与一定量的铵盐作用,生成相当量的酸,反应为2(NH4)2SO4+6HCHO→(CH2)6N4 +2H2SO4 + 6H2O,生成的酸再用氢氧化钠标准溶液滴定,从而测定氮的含量。步骤如下:
(1)用差量法称取固体(NH4)2SO4样品0.6g于烧杯中,加入约30mL蒸馏水溶解,最终配成100mL溶液。用___________ (填“酸式”或“碱式”)滴定管准确取出20.00mL的溶液于锥形瓶中,加入18%中性甲醛溶液5mL,放置5min后,加入1~2滴___________ 指示剂(已知滴定终点的pH约为8.8),用浓度为0.08mol/L氢氧化钠标准溶液滴定,读数如下表:
达滴定终点时的现象为___________ ,由此可计算出该样品中的氮的质量分数为___________ 。
(2)在滴定实验结束后发现滴定用的碱式滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,则此实验测定的含氮量比实际值___________ (填“偏大”“偏小”或“无影响”)。
Ⅲ.如果测定碳酸氢铵中的含氮量时,使用甲醛法是否合理___________ (填“是”或“否”),理由是___________ 。
Ⅰ.某学生设计了一套以测定二氧化碳含量间接测定含氮量的方法。将样品放入圆底烧瓶中:


(1)请选择必要地装置,按气流方向连接顺序为
(2)分液漏斗中的液体最适合的是
A.稀盐酸 B.稀硫酸 C.浓硝酸 D.氢氧化钠
(3)连在最后的装置起到的作用
Ⅱ.如果氮肥中成分是(NH4)2SO4,则可以用甲醛法测定含氮量。甲醛法是基于甲醛与一定量的铵盐作用,生成相当量的酸,反应为2(NH4)2SO4+6HCHO→(CH2)6N4 +2H2SO4 + 6H2O,生成的酸再用氢氧化钠标准溶液滴定,从而测定氮的含量。步骤如下:
(1)用差量法称取固体(NH4)2SO4样品0.6g于烧杯中,加入约30mL蒸馏水溶解,最终配成100mL溶液。用
| 滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 1.20 | 16.21 |
| 2 | 3.00 | 18.90 |
| 3 | 4.50 | 19.49 |
达滴定终点时的现象为
(2)在滴定实验结束后发现滴定用的碱式滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,则此实验测定的含氮量比实际值
Ⅲ.如果测定碳酸氢铵中的含氮量时,使用甲醛法是否合理
您最近一年使用:0次
4 . 废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:
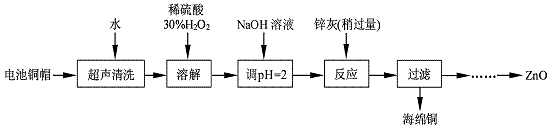
(1)写出铜帽溶解时铜与加入的稀硫酸、30%H2O2反应的离子反应方程式:_________________ ;铜帽溶解完全后,需加热(至沸)将溶液中过量的H2O2除去。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①滴定选用的指示剂为___________ ,滴定终点观察到的现象为_______________ ;
②某同学称取1.0g电池铜帽进行实验,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.1000mol/L Na2S2O3标准溶液滴定至终点。再重复操作实验3次,记录数据如下:
计算电池铜帽中Cu的质量分数为__________ ,(结果保留四位有效数字)若滴定前溶液中的H2O2没有除尽,则所测定c (Cu2+)将会___________ (填“偏高”、“偏低”或“无影响”);
(3)常温下,若向50mL 0.0001mol/L CuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成了沉淀。已知KSP[Cu (OH)2] =2.0×10-20(mol/L)3,计算沉淀生成后溶液中c(Cu2+)=_____ mol/L;
(4)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0 mol·L-1计算)。
实验中可选用的试剂:30%H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1NaOH。由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入适量30% H2O2,使其充分反应;
②_______________________ ;③过滤;
④______________________ ;⑤过滤、洗涤、干燥;⑥900℃煅烧。

(1)写出铜帽溶解时铜与加入的稀硫酸、30%H2O2反应的离子反应方程式:
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①滴定选用的指示剂为
②某同学称取1.0g电池铜帽进行实验,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.1000mol/L Na2S2O3标准溶液滴定至终点。再重复操作实验3次,记录数据如下:
| 实验编号 | 1 | 2 | 3 | 4 |
| V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
计算电池铜帽中Cu的质量分数为
(3)常温下,若向50mL 0.0001mol/L CuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成了沉淀。已知KSP[Cu (OH)2] =2.0×10-20(mol/L)3,计算沉淀生成后溶液中c(Cu2+)=
(4)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0 mol·L-1计算)。
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1NaOH。由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入适量30% H2O2,使其充分反应;
②
④
您最近一年使用:0次
2016-01-25更新
|
258次组卷
|
3卷引用:2016届黑龙江省实验中学高三上学期期末理综化学试卷
名校
解题方法
5 . 钠是一种非常活泼、具有广泛应用的金属。请回答:
(1)将一小块金属钠投入水中,发生反应的离子方程式是_______ ;可观察到的实验现象是_______ (填字母序号)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动 d.有嘶嘶声
(2)钠在空气中的燃烧产物Na2O2可用于呼吸面具或潜水艇中氧气的来源,11.6gCO2和H2O的混合物与足量Na2O2充分反应后,固体质量增加了3.6 g,则生成标准状况下O2的体积_______ L;原混合气体的中CO2和H2O的分子数比为_______ 。
(3)下列实验方案中,不能测定Na2CO3和NaHCO3的混合物中Na2CO3质量分数的是_______
(1)将一小块金属钠投入水中,发生反应的离子方程式是
a.钠沉到水底 b.钠熔成小球 c.小球四处游动 d.有嘶嘶声
(2)钠在空气中的燃烧产物Na2O2可用于呼吸面具或潜水艇中氧气的来源,11.6gCO2和H2O的混合物与足量Na2O2充分反应后,固体质量增加了3.6 g,则生成标准状况下O2的体积
(3)下列实验方案中,不能测定Na2CO3和NaHCO3的混合物中Na2CO3质量分数的是_______
| A.取a g混合物充分加热,质量减少b g |
| B.取a g混合物与足量NaOH溶液充分反应,得到b g溶液 |
| C.取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到b g固体 |
| D.取a g混合物与足量稀硫酸反应,逸出气体经干燥后用碱石灰吸收,质量增加b g |
您最近一年使用:0次
2022-11-29更新
|
538次组卷
|
2卷引用:黑龙江省哈尔滨师范大学附属中学2022-2023学年高一上学期期中考试化学试题
名校
6 . 葡萄糖酸钙是一种有机钙盐,外观为白色结晶性或颗粒性粉末,无臭,无味,易溶于沸水,微溶于冷水,不溶于乙醇或乙醚等有机溶剂。葡萄糖酸钙临床上用于治疗骨质疏松症。实验室制备葡萄糖酸钙主要步骤如下:
I.葡萄糖酸溶液的制备
称取适量的葡萄糖[CH2OH(CHOH)4CHO],置于三颈烧瓶中,加入足量的溴水,在磁力搅拌器中沸水浴加热、搅拌得到无色透明的葡萄糖酸溶液。当氧化率达 80%以上时(60min),停止反应,把反应液冷却至 60-70℃待用。
Ⅱ.葡萄糖酸钙的制备
在搅拌下,分批加入足量的碳酸钙至葡萄糖酸溶液中。反应完全后,趁热用下图装置抽滤,得到澄清透明的葡萄糖酸钙溶液。将葡萄糖酸钙溶液转入 100ml 烧杯中冷却至室温,向烧杯中添加适量的无水乙醇,静置 10min 得到悬浊液,抽滤、洗涤、干燥得到白色的葡萄糖酸钙固体。
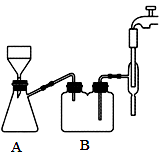
回答下列问题:
(1)步骤Ⅰ中,滴入溴水后,反应的化学方程式为_______ 。
(2)步骤 Ⅱ 中,判断碳酸钙已经足量的实验现象是_______ 。
(3)步骤Ⅱ抽滤时自来水流的作用是使瓶内与大气形成压强差,与普通过滤操作相比,抽滤的优点是_______ ;装置 B 的作用是_______ 。
(4)洗涤操作洗涤剂最合适的是_______ _(填序号),理由是_______ 。
A.冷水 B. 热水 C.乙醇
Ⅲ.葡萄糖酸钙中钙质量分数的测定
测定步骤:
(i)准确称取葡萄糖酸钙 m g,加入去离子水溶解,定容,配成 250mL 溶液。
(ii)用 c mol/L EDTA(H2Y2-)标准溶液润洗滴定管后,装入 EDTA 标准液,调至零刻度。
(iii)向 250mL 锥形瓶中加入 10mL 水、10mL NH3-NH4Cl 缓冲溶液和 5 mL 硫酸镁溶液。滴加 4 滴铬黑 T(HIn2-)指示剂,摇匀。用 EDTA 标准液滴定至终点。记录消耗的 EDTA 标准液的体积。
滴定过程中发生的反应如下:
Mg2+ + HIn2-(蓝色) MgIn-(酒红色)+ H+
MgIn-(酒红色)+ H+
Mg2+ + H2Y2- MgY2- + 2H+
MgY2- + 2H+
MgIn-(酒红色)+ H2Y2- MgY2- + H+ + HIn2-(蓝色)
MgY2- + H+ + HIn2-(蓝色)
(iv)向上述锥形瓶中加入 25.00 mL 葡萄糖酸钙溶液,摇匀,继续用 EDTA 标准液滴定至终点,记录消耗的 EDTA 标准液的总体积。平行滴定三次,测得步骤 iii 中消耗 EDTA 标准液的平均体积为 V1 L,步骤 iv 中 EDTA 标准液的平均总体积为 V2 L。
已知:配合物的稳定常数类似于化学平衡常数,如反应 Fe3+ + 3SCN- Fe(SCN)3 的平衡常数可以看做是 Fe(SCN)3 的稳定常数 K稳,一般情况下,配合物的稳定常数越大,配合物越稳定,两种离子更容易结合。已知下列化合物稳定常数的大小顺序为 CaY2- > MgY2- > MgIn- > CaIn-,其中CaIn-的稳定常数很小,CaIn-不稳定,易导致滴定终点提前。
Fe(SCN)3 的平衡常数可以看做是 Fe(SCN)3 的稳定常数 K稳,一般情况下,配合物的稳定常数越大,配合物越稳定,两种离子更容易结合。已知下列化合物稳定常数的大小顺序为 CaY2- > MgY2- > MgIn- > CaIn-,其中CaIn-的稳定常数很小,CaIn-不稳定,易导致滴定终点提前。
回答下列问题:
(5)步骤 iii 中加入硫酸镁的作用是_______ 。
(6)滴定终点的颜色变化为_______ 。
(7)步骤 iv 中,加入葡萄糖酸钙后发生反应的离子方程式为_______ ,_______ 。
(8)葡萄糖酸钙中钙的质量分数为_______ 。(用 V1、V2、m、c 的代数式表示)
I.葡萄糖酸溶液的制备
称取适量的葡萄糖[CH2OH(CHOH)4CHO],置于三颈烧瓶中,加入足量的溴水,在磁力搅拌器中沸水浴加热、搅拌得到无色透明的葡萄糖酸溶液。当氧化率达 80%以上时(60min),停止反应,把反应液冷却至 60-70℃待用。
Ⅱ.葡萄糖酸钙的制备
在搅拌下,分批加入足量的碳酸钙至葡萄糖酸溶液中。反应完全后,趁热用下图装置抽滤,得到澄清透明的葡萄糖酸钙溶液。将葡萄糖酸钙溶液转入 100ml 烧杯中冷却至室温,向烧杯中添加适量的无水乙醇,静置 10min 得到悬浊液,抽滤、洗涤、干燥得到白色的葡萄糖酸钙固体。

回答下列问题:
(1)步骤Ⅰ中,滴入溴水后,反应的化学方程式为
(2)步骤 Ⅱ 中,判断碳酸钙已经足量的实验现象是
(3)步骤Ⅱ抽滤时自来水流的作用是使瓶内与大气形成压强差,与普通过滤操作相比,抽滤的优点是
(4)洗涤操作洗涤剂最合适的是
A.冷水 B. 热水 C.乙醇
Ⅲ.葡萄糖酸钙中钙质量分数的测定
测定步骤:
(i)准确称取葡萄糖酸钙 m g,加入去离子水溶解,定容,配成 250mL 溶液。
(ii)用 c mol/L EDTA(H2Y2-)标准溶液润洗滴定管后,装入 EDTA 标准液,调至零刻度。
(iii)向 250mL 锥形瓶中加入 10mL 水、10mL NH3-NH4Cl 缓冲溶液和 5 mL 硫酸镁溶液。滴加 4 滴铬黑 T(HIn2-)指示剂,摇匀。用 EDTA 标准液滴定至终点。记录消耗的 EDTA 标准液的体积。
滴定过程中发生的反应如下:
Mg2+ + HIn2-(蓝色)
 MgIn-(酒红色)+ H+
MgIn-(酒红色)+ H+ Mg2+ + H2Y2-
 MgY2- + 2H+
MgY2- + 2H+ MgIn-(酒红色)+ H2Y2-
 MgY2- + H+ + HIn2-(蓝色)
MgY2- + H+ + HIn2-(蓝色) (iv)向上述锥形瓶中加入 25.00 mL 葡萄糖酸钙溶液,摇匀,继续用 EDTA 标准液滴定至终点,记录消耗的 EDTA 标准液的总体积。平行滴定三次,测得步骤 iii 中消耗 EDTA 标准液的平均体积为 V1 L,步骤 iv 中 EDTA 标准液的平均总体积为 V2 L。
已知:配合物的稳定常数类似于化学平衡常数,如反应 Fe3+ + 3SCN-
 Fe(SCN)3 的平衡常数可以看做是 Fe(SCN)3 的稳定常数 K稳,一般情况下,配合物的稳定常数越大,配合物越稳定,两种离子更容易结合。已知下列化合物稳定常数的大小顺序为 CaY2- > MgY2- > MgIn- > CaIn-,其中CaIn-的稳定常数很小,CaIn-不稳定,易导致滴定终点提前。
Fe(SCN)3 的平衡常数可以看做是 Fe(SCN)3 的稳定常数 K稳,一般情况下,配合物的稳定常数越大,配合物越稳定,两种离子更容易结合。已知下列化合物稳定常数的大小顺序为 CaY2- > MgY2- > MgIn- > CaIn-,其中CaIn-的稳定常数很小,CaIn-不稳定,易导致滴定终点提前。回答下列问题:
(5)步骤 iii 中加入硫酸镁的作用是
(6)滴定终点的颜色变化为
(7)步骤 iv 中,加入葡萄糖酸钙后发生反应的离子方程式为
(8)葡萄糖酸钙中钙的质量分数为
您最近一年使用:0次
名校
解题方法
7 . 我国提出2060年前实现碳中和,降低大气中CO2含量是当今世界重要科研课题之一,以CO2为原料制备甲烷、戊烷、甲醇等能源物质具有较好的发展前景。回答下列问题:
(1)CO2在固体催化剂表面加氢合成甲烷过程中发生以下两个反应:
主反应:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH1=-156.9kJ·mol-l
CH4(g)+2H2O(g) ΔH1=-156.9kJ·mol-l
副反应:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.1kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.1kJ·mol-1
①已知:2H2(g)+O2(g)=2H2O(g) ΔH3=-395.6kJ·mol-1,
则CH4燃烧的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=_______ 。
②500°C时,向1L恒容密闭容器中充入4mol CO2和12mol H2,初始压强为p,20min时主、3副反应都达到平衡状态,测得c(H2O)=5mol·L-1,体系压强为 p,则0~20min内v(CH4)=
p,则0~20min内v(CH4)=_______ ,平衡时CH4选择性=_______ (CH4选择性=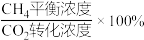 ,计算保留三位有效数字)。
,计算保留三位有效数字)。
(2)我国科研人员将CO2和H2在Na-Fe3O4/HZSM-5催化下转变为汽油(C5~C11的烃),反应过程如下图所示。
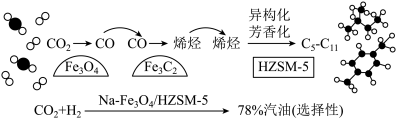
①若CO2在该条件下转化为戊烷(C5H12),则该反应的化学方程式为_______ 。
②催化剂中的Fe3O4可用电解法制备。电解时以Fe电极作电解池的_______ 极,电解质溶液为稀硫酸,铁电极的反应式为_______ 。
(3)甲醇催化制取乙烯的过程中发生如下反应:
反应1:3CH3OH(g) C3H6(g)+3H2O(g);
C3H6(g)+3H2O(g);
反应2:2CH3OH(g) C2H4(g)+2H2O(g)
C2H4(g)+2H2O(g)
反应1的Arthenius经验公式的实验数据如图中曲线a所示,已知Arhenius经验公式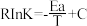 (Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea=
(Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea=_______ kJ·mol-1.当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是_______ 。

(1)CO2在固体催化剂表面加氢合成甲烷过程中发生以下两个反应:
主反应:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH1=-156.9kJ·mol-l
CH4(g)+2H2O(g) ΔH1=-156.9kJ·mol-l副反应:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.1kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.1kJ·mol-1①已知:2H2(g)+O2(g)=2H2O(g) ΔH3=-395.6kJ·mol-1,
则CH4燃烧的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=
②500°C时,向1L恒容密闭容器中充入4mol CO2和12mol H2,初始压强为p,20min时主、3副反应都达到平衡状态,测得c(H2O)=5mol·L-1,体系压强为
 p,则0~20min内v(CH4)=
p,则0~20min内v(CH4)=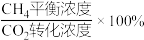 ,计算保留三位有效数字)。
,计算保留三位有效数字)。(2)我国科研人员将CO2和H2在Na-Fe3O4/HZSM-5催化下转变为汽油(C5~C11的烃),反应过程如下图所示。

①若CO2在该条件下转化为戊烷(C5H12),则该反应的化学方程式为
②催化剂中的Fe3O4可用电解法制备。电解时以Fe电极作电解池的
(3)甲醇催化制取乙烯的过程中发生如下反应:
反应1:3CH3OH(g)
 C3H6(g)+3H2O(g);
C3H6(g)+3H2O(g);反应2:2CH3OH(g)
 C2H4(g)+2H2O(g)
C2H4(g)+2H2O(g)反应1的Arthenius经验公式的实验数据如图中曲线a所示,已知Arhenius经验公式
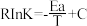 (Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea=
(Ea为活化能,k为速率常数,R和C为常数)。则该反应的活化能Ea=
您最近一年使用:0次
2022-08-20更新
|
919次组卷
|
3卷引用:黑龙江省哈尔滨师范大学附属中学2023-2024学年高三上学期11月期中化学试题
19-20高一·浙江·期中
名校
8 . 下列说法不正确的是
| A.某硝酸密度为1.42g·cm-3,质量分数为63%,此硝酸物质的量浓度为14.2 mol·L-1 |
| B.100 g浓度为c mol·L-1 的硫酸中加入一定的水稀释成0.5c mol·L-1, 则加入水的体积大于100 mL(已知硫酸的浓度越大,其密度越大) |
| C.将a%的氨水和(100-a)%的氨水等体积混合后,所得溶液的质量分数可能为小于或等于50%(已知氨水的浓度越大,其密度越小) |
D.VLAl2(SO4)3溶液中含Al3+mg,则溶液中 的物质的量浓度为 的物质的量浓度为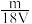 mol·L-1 mol·L-1 |
您最近一年使用:0次
2020-12-16更新
|
2361次组卷
|
4卷引用:黑龙江省哈尔滨市第七十三中学校2022-2023学年高三上学期第一次月考化学试题
名校
解题方法
9 . 丙烷与溴原子能发生以下两种反应:
① CH3CH2CH3(g) + Br·(g) → CH3CH2CH2·(g) + HBr(g)
② CH3CH2CH3(g) + Br·(g) → CH3CH·CH3 (g) + HBr(g)
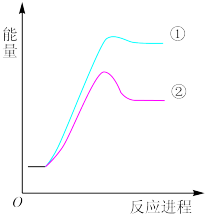
反应过程的能量变化如图所示。下列说法正确的是
① CH3CH2CH3(g) + Br·(g) → CH3CH2CH2·(g) + HBr(g)
② CH3CH2CH3(g) + Br·(g) → CH3CH·CH3 (g) + HBr(g)
反应过程的能量变化如图所示。下列说法正确的是

| A.反应①是放热反应 |
| B.反应②使用了催化剂 |
| C.产物中 CH3CH2CH2·(g)含量比 CH3CH·CH3(g)低 |
| D.CH3CH2CH2·(g)转变为 CH3CH·CH3(g)时需要吸热 |
您最近一年使用:0次
2020-12-23更新
|
2371次组卷
|
9卷引用:黑龙江省大庆市实验中学2021-2022学年高三上学期开学考试化学试题
黑龙江省大庆市实验中学2021-2022学年高三上学期开学考试化学试题上海市闵行区2021届高三一模化学试题(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)2021年辽宁高考化学试题变式题11-19上海市徐汇区2023届高三一模化学试题(已下线)专题12 反应机理和能量变化
10 . [化学-选修2:化学与技术]
双氧水是一种重要的氧化剂、漂白剂和消毒剂。生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:

A.氢化釜 B.过滤器 C.氧化塔 D.萃取塔 E.净化塔 F.工作液再生装置 G.工作液配制装置
生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定的温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水。回答下列问题:
(1)蒽醌法制备双氧水理论上消耗的原料是_______ ,循环使用的|原料是______ ,配制工作液时采用有机溶剂而不采用水的原因是______ 。
(2)氢化釜A中反应的化学方程式为_______ ,进入氧化塔C的反应混合液中的主要溶质为_______ 。
(3)萃取塔D中的萃取剂是____ ,选择其作萃取剂的原因是______ 。
(4)工作液再生装置F中要除净残留的H2O2,原因是______ 。
(5)双氧水浓度可在酸性条件下用KMnO4溶液测定,该反应的离子方程式为_______ 。一种双氧水的质量分数为27.5%,(密度为1.10g·cm3),其浓度为______ mol/L。
双氧水是一种重要的氧化剂、漂白剂和消毒剂。生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:

A.氢化釜 B.过滤器 C.氧化塔 D.萃取塔 E.净化塔 F.工作液再生装置 G.工作液配制装置
生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定的温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水。回答下列问题:
(1)蒽醌法制备双氧水理论上消耗的原料是
(2)氢化釜A中反应的化学方程式为
(3)萃取塔D中的萃取剂是
(4)工作液再生装置F中要除净残留的H2O2,原因是
(5)双氧水浓度可在酸性条件下用KMnO4溶液测定,该反应的离子方程式为
您最近一年使用:0次
2019-01-30更新
|
2862次组卷
|
5卷引用:2017届黑龙江省双鸭山市宝清高级中学高三月考二化学试卷



