名校
解题方法
1 . 一定条件下向某密闭容器中加入 、
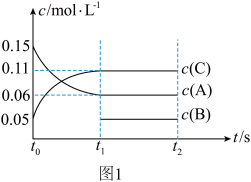
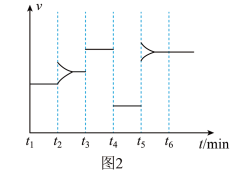
、 和一定量的B三种气体,图1表示各物质浓度随时间的变化关系,图2表示速率随时间的变化关系,
和一定量的B三种气体,图1表示各物质浓度随时间的变化关系,图2表示速率随时间的变化关系, 时刻各改变一种条件,且改变的条件均不同。若
时刻各改变一种条件,且改变的条件均不同。若 时刻改变的条件是压强,则下列说法错误的是
时刻改变的条件是压强,则下列说法错误的是
 、
、 和一定量的B三种气体,图1表示各物质浓度随时间的变化关系,图2表示速率随时间的变化关系,
和一定量的B三种气体,图1表示各物质浓度随时间的变化关系,图2表示速率随时间的变化关系, 时刻各改变一种条件,且改变的条件均不同。若
时刻各改变一种条件,且改变的条件均不同。若 时刻改变的条件是压强,则下列说法错误的是
时刻改变的条件是压强,则下列说法错误的是

A.若 ,则前 ,则前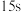 的平均反应速率 的平均反应速率 |
B.该反应的化学方程式为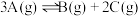 |
C.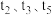 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度 |
D.B的起始物质的量为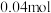 |
您最近一年使用:0次
2023-01-17更新
|
849次组卷
|
21卷引用:第二章 化学反应速率与化学平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版2019选择性必修一)
(已下线)第二章 化学反应速率与化学平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版2019选择性必修一)山西省实验中学2018届高三上学期学业质量监测化学试题天津市六校(静海一中,杨村中学,宝坻一中,大港一中等)2019-2020学年高二上学期期中联考化学试题天津市七校2019-2020学年高二上学期期中联考化学试题2020届高三化学二轮冲刺新题专练——化学反应速率的图像分析(提升练)(已下线)第17讲 化学平衡计算与图像-2021年高考化学一轮复习名师精讲练鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2节 化学反应的限度 课时2 反应条件对化学平衡的影响高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时3 影响化学平衡的因素山西省运城市景胜中学2020-2021学年高二10月月考化学试题河南省许昌市第三中学2020-2021学年高二3月月考化学试题选择性必修1 专题2 第三单元 课时1 影响化学平衡的因素(已下线)6.2.2 化学平衡(第2课时 化学平衡移动)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)河南省商丘市回民中学2022-2023学年高三上学期期末考试(线上)化学试题黑龙江省牡丹江市第三高级中学2023-2024学年高二上学期期中考试化学试题四川省广安市华蓥中学2023-2024学年高二上学期12月月考化学试题黑龙江省大庆市铁人中学2018-2019学年高一下学期期末化学试题江西省吉安市遂川中学2019—2020学年高二上学期第一次月考化学试题(A)黑龙江省大庆实验中学2019-2020学年高二上学期第一次月考化学试题甘肃省天水市天水一中2019-2020学年高二(普通班)上学期第一次月考化学(理)试题广东省揭阳市惠来县第一中学2019-2020学年高二上学期期中考试化学试题黑龙江省鹤岗市第一中学2019-2020学年高一下学期期末考试化学试题
2 . 聚乳酸(PLA)是最具潜力的可降解高分子材料之一,对其进行基团修饰可进行材料的改性,从而拓展PLA的应用范围。PLA和某改性的PLA的合成路线如图。
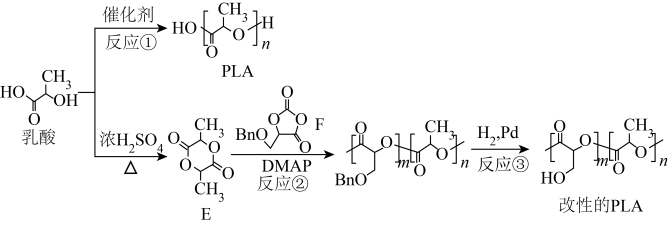
注:Bn是苯甲基(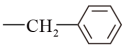 )
)
下列说法正确 的有几个
(1)反应①是缩聚反应
(2)在合成中Bn的作用是保护羟基,防止羟基参与聚合反应
(3)改性的PLA中,m∶n越大,其在水中的溶解性越好
(4)反应②中,参与聚合的F和E的物质的量之比是m∶n

注:Bn是苯甲基(
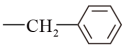 )
)下列说法
(1)反应①是缩聚反应
(2)在合成中Bn的作用是保护羟基,防止羟基参与聚合反应
(3)改性的PLA中,m∶n越大,其在水中的溶解性越好
(4)反应②中,参与聚合的F和E的物质的量之比是m∶n
| A.4个 | B.3个 | C.2个 | D.1个 |
您最近一年使用:0次
2022-05-08更新
|
1036次组卷
|
3卷引用:第五章 合成高分子(B卷)
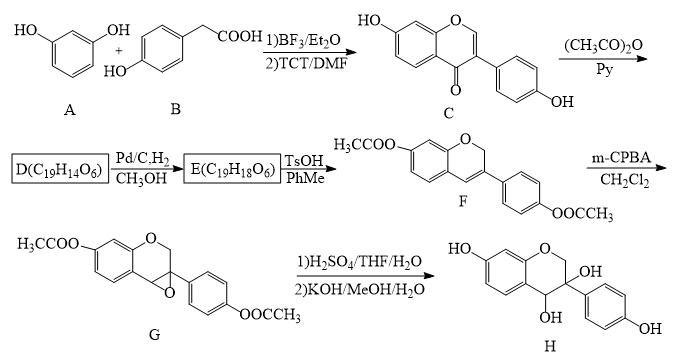
3 . 近年来,以大豆素(化合物C)为主要成分的大豆异黄酮及其衍生物,因其具有优良的生理活性而备受关注。大豆素的合成及其衍生化的一种工艺路线如下:
(1)A的化学名称为_______ 。
(2)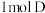 反应生成E至少需要
反应生成E至少需要_______  氢气。
氢气。
(3)写出E中任意两种含氧官能团的名称_______ 。
(4)由E生成F的化学方程式为_______ 。
(5)由G生成H分两步进行:反应1)是在酸催化下水与环氧化合物的加成反应,则反应2)的反应类型为_______ 。
(6)化合物B的同分异构体中能同时满足下列条件的有_______ (填标号)。
a.含苯环的醛、酮
b.不含过氧键( )
)
c.核磁共振氢谱显示四组峰,且峰面积比为3∶2∶2∶1
A.2个 B.3个 C.4个 D.5个
(7)根据上述路线中的相关知识,以丙烯为主要原料用不超过三步的反应设计合成下图有机物,写出合成路线_______ 。
(1)A的化学名称为
(2)
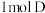 反应生成E至少需要
反应生成E至少需要 氢气。
氢气。(3)写出E中任意两种含氧官能团的名称
(4)由E生成F的化学方程式为
(5)由G生成H分两步进行:反应1)是在酸催化下水与环氧化合物的加成反应,则反应2)的反应类型为
(6)化合物B的同分异构体中能同时满足下列条件的有
a.含苯环的醛、酮
b.不含过氧键(
 )
)c.核磁共振氢谱显示四组峰,且峰面积比为3∶2∶2∶1
A.2个 B.3个 C.4个 D.5个
(7)根据上述路线中的相关知识,以丙烯为主要原料用不超过三步的反应设计合成下图有机物,写出合成路线
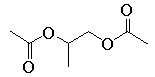
您最近一年使用:0次
2021-06-11更新
|
21831次组卷
|
24卷引用:专题4 生活中常用的有机物——烃的含氧衍生物 第一~二单元综合拔高练
专题4 生活中常用的有机物——烃的含氧衍生物 第一~二单元综合拔高练2021年高考全国甲卷化学真题(已下线)考点40 有机合成高分子-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)2021年高考全国甲卷化学试题变式题(已下线)专题15 有机化学基础-备战2022年高考化学学霸纠错(全国通用)(已下线)解密12 有机化学基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题20 有机化学基础-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题14 有机化学基础—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)回归教材重难点12 有机化学基础(选考)-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)押全国卷理综第36题 有机化学基础-备战2022年高考化学临考题号押题(课标全国卷)(已下线)专题19有机化学基础(选修)-五年(2018~2022)高考真题汇编(全国卷)第三~五节综合拔高练(已下线)微专题48 限定条件下的同分异构体的书写判断-备战2023年高考化学一轮复习考点微专题(已下线)专题04 有机化学专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)江苏省南京师范大学附属中学江宁分校2022-2023学年高二下学期期中考试化学试题(已下线)专题21 有机推断题(已下线)专题21 有机推断题(已下线)专题17 有机化学基础综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点40 有机合成(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第37讲有机合成及推断(已下线)考点5 有机合成及推断(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)山东省新泰中学2020-2021学年高二下学期第二次阶段性考试化学试题(已下线)考点41 合成高分子 有机合成-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)解密12 有机化学基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)
4 . 体积均为1.0L的甲、乙两个恒容密闭容器,向甲中加入0.1molCO2和0.3mol碳粉,向乙中加入0.4molCO,在不同温度下发生反应:CO2(g)+C(s) 2CO(g)。达到平衡时CO的物质的量浓度随温度的变化如图所示。下列说法正确的是
2CO(g)。达到平衡时CO的物质的量浓度随温度的变化如图所示。下列说法正确的是
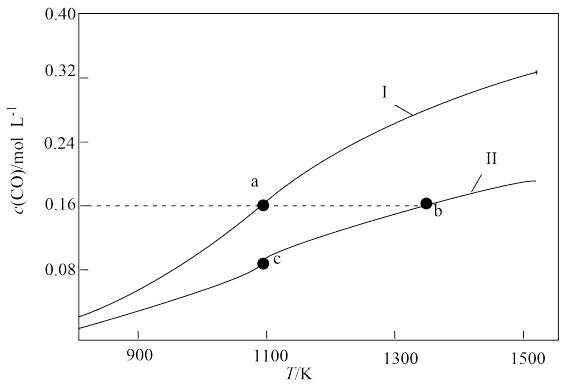
 2CO(g)。达到平衡时CO的物质的量浓度随温度的变化如图所示。下列说法正确的是
2CO(g)。达到平衡时CO的物质的量浓度随温度的变化如图所示。下列说法正确的是
| A.曲线II对应的是乙容器 |
| B.a、b两点对应平衡体系中的压强之比:pa:pb<14:9 |
C.b点对应的平衡体系中,CO的体积分数小于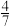 |
| D.900K时,起始时向容器乙中加入CO、CO2、碳粉各1mol,此时v正﹥v逆 |
您最近一年使用:0次
2020-12-23更新
|
1875次组卷
|
3卷引用:选择性必修1 化学反应原理综合训练
名校
解题方法
5 . 某烃的结构简式为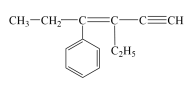 ,若分子中共线碳原子数为a,可能共面的碳原子数最多为b,含四面体结构的碳原子数为c,则a、b、c分别是( )
,若分子中共线碳原子数为a,可能共面的碳原子数最多为b,含四面体结构的碳原子数为c,则a、b、c分别是( )
 ,若分子中共线碳原子数为a,可能共面的碳原子数最多为b,含四面体结构的碳原子数为c,则a、b、c分别是( )
,若分子中共线碳原子数为a,可能共面的碳原子数最多为b,含四面体结构的碳原子数为c,则a、b、c分别是( )| A.3、4、5 | B.3、10、4 |
| C.3、14、4 | D.4、10、4 |
您最近一年使用:0次
2020-05-14更新
|
6291次组卷
|
40卷引用:第二章 烃(A卷·知识通关练)-2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修3)
第二章 烃(A卷·知识通关练)-2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修3)2016-2017学年内蒙古赤峰二中高二上月考二化学卷【全国百强校】陕西省西安市长安区第一中学2017-2018学年高一下学期期末考试(理)化学试题【全国百强校】内蒙古自治区赤峰市第二中学2018-2019学年高二上学期第二次月考化学试题【全国百强校】江西省南昌市第十中学2018-2019学年高二下学期3月月考化学试题(已下线)2019年6月8日 《每日一题》选修5-周末培优内蒙古呼和浩特开来中学2018-2019学年高二5月期中考试化学试题河北省鸡泽县第一中学2019-2020学年高二10月月考化学试题有机物分子中原子共线共面问题和芳香烃的同分异构专题-【百强校】河南省洛阳市第一高级中学高三化学复习练习广西壮族自治区崇左市大新县大新中学2019-2020学年高二上学期期末考试化学试题广西壮族自治区崇左市宁明中学2019-2020学年高二上学期期末考试化学试题山西省长治市2019-2020学年高二下学期第一次在线月考化学试题广西隆林县第二中学2019-2020学年高二上学期期末考试化学试题河北省张家口市涿鹿县涿鹿中学2019-2020学年高二下学期3月月考化学试题高二选择性必修3(人教版2019)第二章 烃 专题2 有机化合物共线 共面问题的判断河北省唐山市曹妃甸第一中学2020-2021学年高一下学期6月月考化学试题(已下线)专题讲座(十) 有机物分子中原子共线、共面的判断(精练)-2022年高考化学一轮复习讲练测黑龙江省哈尔滨工业大学附属中学校2021-2022学年高二上学期期末考试化学试题(已下线)第11讲 烃的燃烧、共面问题(word讲义)-【帮课堂】2021-2022学年高二化学同步精品讲义(人教2019选择性必修3)辽宁省建平县实验中学2021-2022学年高二下学期第三次月考化学试题黑龙江省哈尔滨市德强高中2021-2022学年高二下学期期中考试化学试题上海市宝山区2022届高三模拟考试化学试题辽宁省部分中学2019-2020高一下学期期末考试化学试题河南省安阳市第一中学2023届高三第四次全真模拟化学试题(已下线)烃——课时7烃的燃烧与共面山西省晋城市第一中学校2022-2023学年高二下学期5月月考化学试题湖北省武汉外国语学校2022-2023学年高一下学期期末考试化学试题7.2.2 烃、有机高分子材料 随堂练习天津市崇化中学2023-2024学年高二下学期期中阶段质量监测化学试卷广西壮族自治区贵港市覃塘高级中学2018-2019学年高二上学期9月月考化学试题云南省丘北二中2018-2019学年高二下学期期末考试化学试题江西省宜春市宜丰中学2019-2020学年高二上学期第三次月考化学试题云南省陆良县联办高级中学2019-2020学年高二上学期期末考试化学试题吉林省白城市第四中学2019-2020学年高二下学期网上阶段检测化学试题福建省莆田市荔城区第二十四中学2019-2020学年高二下学期期中化学试题甘肃省张掖市临泽县第一中学2019-2020学年高二下学期期中考试化学试题江西省新余市2020-2021学年高一下学期期末质量检测化学试题山东省青岛市2022届高三下学期五月模拟考试化学试题安徽省芜湖市第一中学2022-2023学年高二上学期12月份教学质量检测化学试题湖南省邵阳市第二中学2023-2024学年高二上学期基础知识竞赛化学试题
名校
6 . 某化学研究性学习小组模拟工业上从浓缩的海水中提取液溴的过程,设计了如下实验装置(夹持装置略去)和操作流程。已知: 的沸点为59℃,微溶于水,有毒。
的沸点为59℃,微溶于水,有毒。

①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入 至反应完全;
至反应完全;
②关闭活塞a、c,打开活塞b、d,向A中鼓入足量热空气;
③进行步骤②的同时,向B中通入足量 ;
;
④关闭活塞b,打开活塞a,再通过A向B中缓慢通入足量 ;
;
⑤将B中所得液体进行萃取、分液、蒸馏并收集液溴。
请回答下列问题:
(1)实验室中制备氯气的化学方程式为________________________________________________ 。
(2)步骤②中鼓入热空气的作用是_______________________________________ 。
(3)步骤③中发生的主要反应的离子方程式为_______________________________________ 。
(4)进行步骤③时,B中尾气可用_____ (填序号)吸收处理。
a.水b.浓硫酸c. 溶液d.饱和
溶液d.饱和 溶液
溶液
(5)步骤⑤中,用下图所示装置进行蒸馏,收集液溴,将装置图中缺少的主要仪器补画出来___________ 。

(6)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中滴加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,C中反应生成了 等物质,该反应的化学方程式为
等物质,该反应的化学方程式为_______________ 。
(7)与B装置相比,采用C装置的优点为______________________________________ 。
 的沸点为59℃,微溶于水,有毒。
的沸点为59℃,微溶于水,有毒。
①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入
 至反应完全;
至反应完全;②关闭活塞a、c,打开活塞b、d,向A中鼓入足量热空气;
③进行步骤②的同时,向B中通入足量
 ;
;④关闭活塞b,打开活塞a,再通过A向B中缓慢通入足量
 ;
;⑤将B中所得液体进行萃取、分液、蒸馏并收集液溴。
请回答下列问题:
(1)实验室中制备氯气的化学方程式为
(2)步骤②中鼓入热空气的作用是
(3)步骤③中发生的主要反应的离子方程式为
(4)进行步骤③时,B中尾气可用
a.水b.浓硫酸c.
 溶液d.饱和
溶液d.饱和 溶液
溶液(5)步骤⑤中,用下图所示装置进行蒸馏,收集液溴,将装置图中缺少的主要仪器补画出来

(6)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中滴加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,C中反应生成了
 等物质,该反应的化学方程式为
等物质,该反应的化学方程式为(7)与B装置相比,采用C装置的优点为
您最近一年使用:0次
2020-04-10更新
|
1354次组卷
|
7卷引用:第八章 化学与可持续发展 综合拓展——B拓展区 夯实基础(人教版(2019)第二册)
名校
7 . 某气态烷烃和某气态单烯烃(只含一个碳碳双键)组成的混合气体在同温、同压下是氢气密度的13倍,取标准状况下此混合气体4.48L,通入足量溴水中,溴水质量增加2.8g,则此混合气体可能是( )
| A.甲烷和丙烯 | B.乙烷和丙烯 |
| C.甲烷和2-甲基丙烯 | D.乙烷和1-丁烯 |
您最近一年使用:0次
2020-03-05更新
|
2083次组卷
|
5卷引用:第二章 烃
8 . 钛是一种活泼金属。从高钛渣(主要为TiO2)提炼海绵钛流程如下:

氯化后的粗TiCl4中含有FeCl3、SiCl4、AlCl3等杂质,相关物质的沸点如下表:
下列说法不正确 的是

氯化后的粗TiCl4中含有FeCl3、SiCl4、AlCl3等杂质,相关物质的沸点如下表:
化合物 | TiCl4 | FeCl3 | SiCl4 | AlCl3 |
沸点/℃ | 136 | 310 | 56.5 | 180 |
| A.“氯化”反应的尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是H2O、FeCl2溶液、NaOH溶液 |
| B.“分馏”得到的低沸点物为SiCl4,高沸点物为FeCl3 |
| C.已知“除铝”的方法是用水湿润的活性炭加入到粗TiCl4,目的是将AlCl3转化为Al(OH)3而除去 |
| D.“还原”过程中还原剂可以选择金属钠,气氛可以选择N2 |
您最近一年使用:0次
2019-12-28更新
|
954次组卷
|
3卷引用:第三单元 物质的性质与转化(能力提升)-2020-2021学年高一化学必修第一册单元测试定心卷 (鲁科版2019)
(已下线)第三单元 物质的性质与转化(能力提升)-2020-2021学年高一化学必修第一册单元测试定心卷 (鲁科版2019)浙江省慈溪市2020届高三12月适应性考试化学试题江西省赣州市部分重点中学2021届高三上学期期中考试化学试题
9 . 合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1) 氨气分解反应的热化学方程式如下:2NH3(g) N2(g)+3H2(g) ΔH
N2(g)+3H2(g) ΔH
若:N≡N键、H-H键和N-H键的键能分别记作a、b和c(单位:kJ·mol−1)则上述反应的ΔH=________ kJ·mol−1。
(2) 研究表明金属催化剂可加速氨气的分解。下表为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率(mmol·min−1)。
①不同催化剂存在下,氨气分解反应活化能最大的是________ (填写催化剂的化学式)。
②温度为T,在一体积固定的密闭容器中加入2 mol NH3,此时压强为P0,用Ru催化氨气分解,若平衡时氨气分解的转化率为50%,则该温度下反应2NH3(g) N2(g)+3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=
N2(g)+3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=________ 。[已知:气体分压(p分)=气体总压(p总)×体积分数]
(3) 关于合成氨工艺的理解,下列正确的是________ 。
A.合成氨工业常采用的反应温度为500℃左右,可用勒夏特列原理解释
B.使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产量苇
C.合成氨工业采用10 MPa~30 MPa,是因常压下N2和H2的转化率不高
D.采用冷水降温的方法可将合成后混合气体中的氨液化
(4) 在1 L 1 mol·L−1的盐酸中缓缓通入2 mol氨气,请在图中画出溶液中水电离出的OH−浓度随氨气通入变化的趋势图。______________________________

(5) 电化学法也可合成氨。下图是用低温固体质子导体作为电解质,用Pt−C3N4作阴极催化剂电解H2(g)和N2(g)合成NH3的原理示意图:

①Pt−C3N4电极反应产生NH3的电极反应式________ 。
②实验研究表明,当外加电压超过一定值以后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因________ 。
(1) 氨气分解反应的热化学方程式如下:2NH3(g)
 N2(g)+3H2(g) ΔH
N2(g)+3H2(g) ΔH若:N≡N键、H-H键和N-H键的键能分别记作a、b和c(单位:kJ·mol−1)则上述反应的ΔH=
(2) 研究表明金属催化剂可加速氨气的分解。下表为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率(mmol·min−1)。
| 催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
| 初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
①不同催化剂存在下,氨气分解反应活化能最大的是
②温度为T,在一体积固定的密闭容器中加入2 mol NH3,此时压强为P0,用Ru催化氨气分解,若平衡时氨气分解的转化率为50%,则该温度下反应2NH3(g)
 N2(g)+3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=
N2(g)+3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=(3) 关于合成氨工艺的理解,下列正确的是
A.合成氨工业常采用的反应温度为500℃左右,可用勒夏特列原理解释
B.使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产量苇
C.合成氨工业采用10 MPa~30 MPa,是因常压下N2和H2的转化率不高
D.采用冷水降温的方法可将合成后混合气体中的氨液化
(4) 在1 L 1 mol·L−1的盐酸中缓缓通入2 mol氨气,请在图中画出溶液中水电离出的OH−浓度随氨气通入变化的趋势图。

(5) 电化学法也可合成氨。下图是用低温固体质子导体作为电解质,用Pt−C3N4作阴极催化剂电解H2(g)和N2(g)合成NH3的原理示意图:

①Pt−C3N4电极反应产生NH3的电极反应式
②实验研究表明,当外加电压超过一定值以后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因
您最近一年使用:0次
2019-11-18更新
|
1196次组卷
|
4卷引用:本册综合检测(二)——2020-2021学年高二化学选修四同步单元AB卷(人教版)
(已下线)本册综合检测(二)——2020-2021学年高二化学选修四同步单元AB卷(人教版)浙江省宁波市2020年新高考选考适应性考试化学试题(已下线)【新东方】2020-23浙江省温州市环大罗山联盟2020-2021学年高二上学期期中考试化学试题
10 . 如图为实验室制备乙炔并进行性质验证的装置(夹持仪器已略去)。
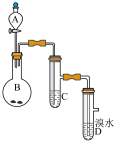
(1)实验开始前,首先进行的操作是___ ;
(2)实验室制备乙炔的方程式为___ ;
(3)仪器A在安装前必须进行的操作是___ ,为防止气体生成的速率过快,由A滴入B的试剂为___ 。
(4)装置C可选用的试剂为___ (写出一种即可),其作用为___ ;
(5)反应开始后,D中的现象为___ ,所发生反应的反应类型为___ ;
(6)D中验证实验结束后。B中反应仍在继续。此时可撤去装置D,在装置C之后连接收集装置,以下装置中最适合用于收集乙炔的是___ 。
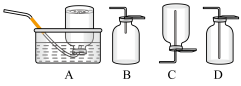

(1)实验开始前,首先进行的操作是
(2)实验室制备乙炔的方程式为
(3)仪器A在安装前必须进行的操作是
(4)装置C可选用的试剂为
(5)反应开始后,D中的现象为
(6)D中验证实验结束后。B中反应仍在继续。此时可撤去装置D,在装置C之后连接收集装置,以下装置中最适合用于收集乙炔的是

您最近一年使用:0次
2019-11-13更新
|
870次组卷
|
4卷引用:第二章 烃
第二章 烃(已下线)2.2.2 炔烃-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修3)安徽省合肥市第八中学2021-2022学年高二下学期实验班开学考化学试题云南省云天化中学2019-2020学年高二上学期期中考试化学试题



