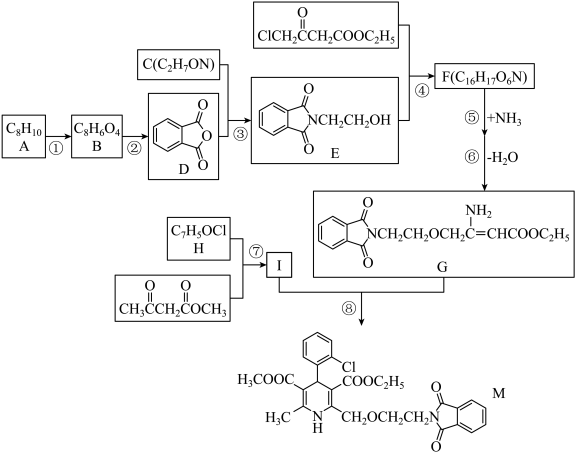
1 . 药物中间体M的合成路线流程图
已知信息:
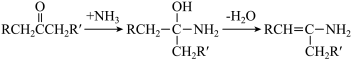
RCHO+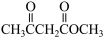 →
→ +H2O
+H2O
请回答下列问题:
 下列说法中正确的是
下列说法中正确的是__________ 。
A.化合物A只有1种结构可以证明苯环不是单双键交替的结构
B.可利用酸性 溶液实现
溶液实现 的转换
的转换
C.步骤 、
、 、
、 所属的有机反应类型各不相同
所属的有机反应类型各不相同
D.化合物C具有弱碱性
 化合物F的结构简式是
化合物F的结构简式是__________ 。
 步骤
步骤 可得到一种与G分子式相同的有机副产物,其结构简式是
可得到一种与G分子式相同的有机副产物,其结构简式是__________ 。
 写出
写出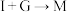 的化学方程式
的化学方程式__________ 。
 写出
写出 同时符合下列条件的同分异构体的结构简式
同时符合下列条件的同分异构体的结构简式__________ 。
 分子中具有联苯结构,能与
分子中具有联苯结构,能与 溶液发生显色反应,能发生水解反应与银镜反应,且完全水解后只有两种物质的量之比为
溶液发生显色反应,能发生水解反应与银镜反应,且完全水解后只有两种物质的量之比为 的水解产物;
的水解产物; 谱和IR谱检测表明分子中有7种化学环境不同的氢原子,没有
谱和IR谱检测表明分子中有7种化学环境不同的氢原子,没有 键。
键。
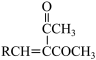
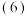 已知:CH3CHO+HCHO
已知:CH3CHO+HCHO H2C=CHCHO,设计以
H2C=CHCHO,设计以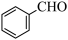 、
、 和
和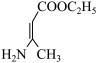 为原料制备
为原料制备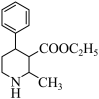 的合成路线流程图
的合成路线流程图________________ (无机试剂任选)。

已知信息:
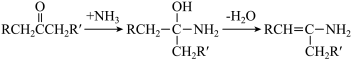
RCHO+
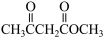 →
→ +H2O
+H2O请回答下列问题:
 下列说法中正确的是
下列说法中正确的是A.化合物A只有1种结构可以证明苯环不是单双键交替的结构
B.可利用酸性
 溶液实现
溶液实现 的转换
的转换 C.步骤
 、
、 、
、 所属的有机反应类型各不相同
所属的有机反应类型各不相同 D.化合物C具有弱碱性
 化合物F的结构简式是
化合物F的结构简式是 步骤
步骤 可得到一种与G分子式相同的有机副产物,其结构简式是
可得到一种与G分子式相同的有机副产物,其结构简式是 写出
写出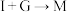 的化学方程式
的化学方程式 写出
写出 同时符合下列条件的同分异构体的结构简式
同时符合下列条件的同分异构体的结构简式 分子中具有联苯结构,能与
分子中具有联苯结构,能与 溶液发生显色反应,能发生水解反应与银镜反应,且完全水解后只有两种物质的量之比为
溶液发生显色反应,能发生水解反应与银镜反应,且完全水解后只有两种物质的量之比为 的水解产物;
的水解产物;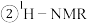 谱和IR谱检测表明分子中有7种化学环境不同的氢原子,没有
谱和IR谱检测表明分子中有7种化学环境不同的氢原子,没有 键。
键。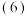 已知:CH3CHO+HCHO
已知:CH3CHO+HCHO H2C=CHCHO,设计以
H2C=CHCHO,设计以 、
、 和
和 为原料制备
为原料制备 的合成路线流程图
的合成路线流程图
您最近一年使用:0次
2 . 空气污染问题日益引起全民关注。工业生产中产生的SO2、NO等为主要污染物。根据你所学化学知识完成下列问题:
Ⅰ.(1)PM2.5是指大气中直径小于或等于2.5μm(1μm=103nm)的颗粒物。下列说法不正确的是_________ (填字母序号)。
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(2)SO2为重要的含硫化合物,是形成酸雨的主要污染物之一。在实验室中,若用70%的硫酸溶液和亚硫酸钠粉末反应制取二氧化硫,并要求方便控制反应速率,可选用如图所示气体发生装置中的_______ (填下列序号字母)。

(3)为研究SO2的性质,如图在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条火准)。
下列有关说法正确的是___________

(4)一定温度下,在密闭容器中SO2与O2反应生成1molSO3气体时,放出akJ热量。
①该温度下SO2与O2反应的热化学方程式为__________________________ 。
②已知:2NO(g)+O2(g)═2NO2(g) △H=" -b" kJ•mol-1(a>b>0)
则反应NO2(g)+SO2(g)═SO3(g)+NO(g) 的△H=________________ 。
Ⅱ.硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需要处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中的二氧化硫的含量,采用以下方案:
实验步骤如下图流程图所示:
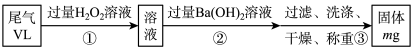
(1)步骤①中反应的离子方程式为____________________________ 。
(2)步骤②中Ba(OH)2是否足量的判断方法是____________________________ 。
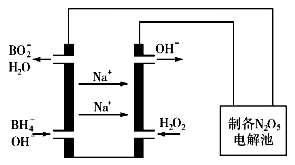
Ⅲ.工业生产中产生的SO2、NO直接排放将对大气造成严重污染。利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素).

请回答下列问题.
(1)装置Ⅱ中的反应在酸性条件下进行,写出NO被氧化为NO2-的离子方程式__________ 。
(2)装置Ⅲ的作用之一是再生Ce4+,其原理如图所示;

图中A为电源的______ (填“正”或“负”)极.右侧反应室中发生的主要电极反应式为__________ 。
(3)已知进入装置Ⅳ的溶液中NO2-的浓度为 0.75mol/L,要使 1m3该溶液中的NO2-完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为_______ L。
Ⅰ.(1)PM2.5是指大气中直径小于或等于2.5μm(1μm=103nm)的颗粒物。下列说法不正确的是
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(2)SO2为重要的含硫化合物,是形成酸雨的主要污染物之一。在实验室中,若用70%的硫酸溶液和亚硫酸钠粉末反应制取二氧化硫,并要求方便控制反应速率,可选用如图所示气体发生装置中的

(3)为研究SO2的性质,如图在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条火准)。
下列有关说法正确的是

| A.蓝色石蕊试纸先变红后褪色 |
| B.湿润的品红试纸、蘸有KMnO4溶液的滤纸均褪色证明SO2具有漂白性 |
| C.湿润的淀粉KI-试纸未变蓝说明SO2的氧化性强于I2 |
| D.NaOH溶液可用于除去实验中多余的SO2 |
①该温度下SO2与O2反应的热化学方程式为
②已知:2NO(g)+O2(g)═2NO2(g) △H=" -b" kJ•mol-1(a>b>0)
则反应NO2(g)+SO2(g)═SO3(g)+NO(g) 的△H=
Ⅱ.硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需要处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中的二氧化硫的含量,采用以下方案:
实验步骤如下图流程图所示:
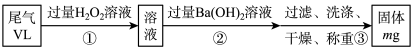
(1)步骤①中反应的离子方程式为
(2)步骤②中Ba(OH)2是否足量的判断方法是
Ⅲ.工业生产中产生的SO2、NO直接排放将对大气造成严重污染。利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素).

请回答下列问题.
(1)装置Ⅱ中的反应在酸性条件下进行,写出NO被氧化为NO2-的离子方程式
(2)装置Ⅲ的作用之一是再生Ce4+,其原理如图所示;

图中A为电源的
(3)已知进入装置Ⅳ的溶液中NO2-的浓度为 0.75mol/L,要使 1m3该溶液中的NO2-完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为
您最近一年使用:0次
3 . 一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:
4NO2(g)+O2(g) 2N2O5(g)
2N2O5(g)
(1)已知平衡常数K350℃<K300℃,则该反应是_________ 反应(填“吸热”或“放热”);常温下,该反应能逆向自发进行,原因是____ 。
(2)下列有关该反应的说法正确的是_____ 。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容下,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容下,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)氮的化合物种类较多,如NH3、NO、NO2、HNO3、硝酸盐等。
①亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是__________ 。
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝酸溶液做导电性实验,灯泡很暗
D.常温下,将pH=3的亚硝酸溶液稀释10倍 ,pH<4
②根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱。按照这个理论,下列微粒属于两性物质的是_____ 。
a.H2O b.NO2- c.H2NCH2COOH d.H2PO4- e.H2S
③氮同主族磷元素形成的Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是___ (用离子方程式表示)。
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表是常温下浓度均为0.01 mol·L-1的X、Y、Z、W溶液的pH。
将X、Y、Z各1mol同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为_____ 。
(5)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则硼氢化钠燃料电池的负极反应式为____ 。
4NO2(g)+O2(g)
 2N2O5(g)
2N2O5(g)(1)已知平衡常数K350℃<K300℃,则该反应是
(2)下列有关该反应的说法正确的是
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容下,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容下,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)氮的化合物种类较多,如NH3、NO、NO2、HNO3、硝酸盐等。
①亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝酸溶液做导电性实验,灯泡很暗
D.常温下,将pH=3的亚硝酸溶液稀释10倍 ,pH<4
②根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱。按照这个理论,下列微粒属于两性物质的是
a.H2O b.NO2- c.H2NCH2COOH d.H2PO4- e.H2S
③氮同主族磷元素形成的Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表是常温下浓度均为0.01 mol·L-1的X、Y、Z、W溶液的pH。
| 0.01mol·L-1的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
将X、Y、Z各1mol同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为
(5)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则硼氢化钠燃料电池的负极反应式为

您最近一年使用:0次
2019-01-30更新
|
648次组卷
|
2卷引用:2015届天津市天津市第一中学高三四月考化学试卷
4 . 氨是一种重要的化工产品,是氮肥工业及制造硝酸的原料。为探究氨气的性质,某研 究性学习小组做了以下实验:

(1)实验室用A图所示实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物来制取氨气。)
①实验室制取氨气的化学方程式为___________________________________ 。
②若用加热碳酸氢铵固体制取纯净的氨气,你认为装置B的作用是_______________ 。
(2)在实验中发现E装置中的固体由黑色变为红色,可推测氨气具有___________ 性。
(3)某同学查阅资料发现Cu2O粉末也呈红色,因此推测上述红色固体中可能还含有Cu2O。
已知:①Cu2O是碱性氧化物,在酸性溶液中Cu+不稳定,易转化为Cu和Cu2+。
②在空气中高温灼烧时:Cu2O稳定、不分解,而CuO将分解生成Cu2O和O2。
现有浓硝酸、稀硫酸、稀硝酸、氢氧化钠溶液及pH试纸,而没有其他试剂,请用最简便的实验方法证明红色固体中是否含有Cu2O。______________________ (简述操作方法、现象和结论)
(4)现有一份一定质量Cu和Cu2O混合物,向其中加入0.4L 3.0mol/L稀硝酸,混合物完全溶解,同时生成4.48L NO(标准状况),向所得溶液中加入一定体积1.0mol/L NaOH溶液恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧可得32.0g固体。
下列有关说法正确的是【已知:3Cu2O + 14HNO3(稀)===6Cu(NO3)2 + 2NO↑+ 7H2O】___________

(1)实验室用A图所示实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物来制取氨气。)
①实验室制取氨气的化学方程式为
②若用加热碳酸氢铵固体制取纯净的氨气,你认为装置B的作用是
(2)在实验中发现E装置中的固体由黑色变为红色,可推测氨气具有
(3)某同学查阅资料发现Cu2O粉末也呈红色,因此推测上述红色固体中可能还含有Cu2O。
已知:①Cu2O是碱性氧化物,在酸性溶液中Cu+不稳定,易转化为Cu和Cu2+。
②在空气中高温灼烧时:Cu2O稳定、不分解,而CuO将分解生成Cu2O和O2。
现有浓硝酸、稀硫酸、稀硝酸、氢氧化钠溶液及pH试纸,而没有其他试剂,请用最简便的实验方法证明红色固体中是否含有Cu2O。
(4)现有一份一定质量Cu和Cu2O混合物,向其中加入0.4L 3.0mol/L稀硝酸,混合物完全溶解,同时生成4.48L NO(标准状况),向所得溶液中加入一定体积1.0mol/L NaOH溶液恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧可得32.0g固体。
下列有关说法正确的是【已知:3Cu2O + 14HNO3(稀)===6Cu(NO3)2 + 2NO↑+ 7H2O】
| A.加入NaOH溶液的体积为1.2L |
| B.Cu和Cu2O混合物质量为27.2g |
| C.混合物完全溶解后溶液中n(H+)=0.3mol |
| D.将等质量混合物完全还原至少需标准状况下H21.12L |
您最近一年使用:0次
5 . 过硫酸钠( Na2S2O8)是一种重要化工原料。某研究小组进行如下实验
实验一 过硫酸钠的制取
采用下图装置制取Na2S2O8。

装置I中:主反应:(NH4)2S2O8+2NaOH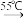 Na2S2O8+2NH3↑+2H2o
Na2S2O8+2NH3↑+2H2o
副反应:①2NH3+3Na2S2O8十 6NaOH===6Na2SO4+6H2o十N2
6NaOH===6Na2SO4+6H2o十N2
②3Na2S2O8+3H2O+3Na2SO4+3H2SO4+O3↑
(1)装置Ⅱ的作用是。
(2)装置I还需补充的实验仪器或装置有_(填序号)。
a.温度计 b.酒精灯 c.水浴 d.洗气瓶
(3)装置I发生反应的同时需要持续通入氮气的目的是
实验二过硫酸钠的性质实验
(4)为研究Na2S2O8溶解度随温度变化情况,实验过程需要测定的数据是。
(5)Na2S2O8溶液与铜反应时先慢后快,除反应放热这一因素外,有人认为还有一种可能是反应生成的Cu2+对后续反应起催化作用,能检验该说法是否正确的实验方案为。
实验三过硫酸钠的应用研究
(6)为检验用Na2S2O8溶液吸收NO的可行性,某同学设计下图所示实验(已知NO不溶于NaOH溶液)。实验步骤如下:
i.检查装置气密性,并按下图加入试剂;

ii.打开a和d,通入足量N2,关闭d;
iii.往装置中通入适量NO,关闭a;
iv.....
①步骤iv中,对分液漏斗的操作是_。
②能证明该方案可行的实验现象是_。
实验一 过硫酸钠的制取
采用下图装置制取Na2S2O8。

装置I中:主反应:(NH4)2S2O8+2NaOH
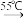 Na2S2O8+2NH3↑+2H2o
Na2S2O8+2NH3↑+2H2o副反应:①2NH3+3Na2S2O8十
 6NaOH===6Na2SO4+6H2o十N2
6NaOH===6Na2SO4+6H2o十N2②3Na2S2O8+3H2O+3Na2SO4+3H2SO4+O3↑
(1)装置Ⅱ的作用是。
(2)装置I还需补充的实验仪器或装置有_(填序号)。
a.温度计 b.酒精灯 c.水浴 d.洗气瓶
(3)装置I发生反应的同时需要持续通入氮气的目的是
实验二过硫酸钠的性质实验
(4)为研究Na2S2O8溶解度随温度变化情况,实验过程需要测定的数据是。
(5)Na2S2O8溶液与铜反应时先慢后快,除反应放热这一因素外,有人认为还有一种可能是反应生成的Cu2+对后续反应起催化作用,能检验该说法是否正确的实验方案为。
实验三过硫酸钠的应用研究
(6)为检验用Na2S2O8溶液吸收NO的可行性,某同学设计下图所示实验(已知NO不溶于NaOH溶液)。实验步骤如下:
i.检查装置气密性,并按下图加入试剂;

ii.打开a和d,通入足量N2,关闭d;
iii.往装置中通入适量NO,关闭a;
iv.....
①步骤iv中,对分液漏斗的操作是_。
②能证明该方案可行的实验现象是_。
您最近一年使用:0次
6 . LiCl和KCl同属NaCl型晶体,其熔点分别为614℃和776℃。Li+、K+和Cl-的半径分别为76pm、113pm和181pm。在电解熔盐LiCl以制取金属锂的生产工艺中,加入适量的KCl晶体,可使电解槽温度下降至400℃,从而使生产条件得以改善。
(1)简要说明加入熔点高的KCl反而使电解温度大大下降的原因:_______ 。
(2)有人认为,LiCl和KCl可形成固溶体(并画出了“固溶体的晶胞”)。但实验表明,液相LiCl和KCl能以任意比例混溶而它们的固相完全不混溶(即不能生成固溶体!)请解释在固相中完全不混溶的主要原因_______ 。
(3)写出计处LiCl和KCl两种晶体密度之比的表达式_______ (须包含离子半径的符号);
(4)在KCl晶体中,K+离子占据由Cl-离子围成的八面体空隙,计算相距最近的八面体空隙中心之间的距离_______ 。
(5)实验证明,即使产生了阳离子空位,KCl晶体在室温下也不导电。请通过计算加以说明_______ 。
(1)简要说明加入熔点高的KCl反而使电解温度大大下降的原因:
(2)有人认为,LiCl和KCl可形成固溶体(并画出了“固溶体的晶胞”)。但实验表明,液相LiCl和KCl能以任意比例混溶而它们的固相完全不混溶(即不能生成固溶体!)请解释在固相中完全不混溶的主要原因
(3)写出计处LiCl和KCl两种晶体密度之比的表达式
(4)在KCl晶体中,K+离子占据由Cl-离子围成的八面体空隙,计算相距最近的八面体空隙中心之间的距离
(5)实验证明,即使产生了阳离子空位,KCl晶体在室温下也不导电。请通过计算加以说明
您最近一年使用:0次
7 . 高温超导材料的研究是21世纪材料领域的热点问题,YBaCuO体系一直是此领域的研究重点之一。将钇(Y)、钡、铜的氧化物按一定的物质的量之比混合(Y为ⅢB族元素),再经高温煅烧可得到复合氧化物YBa2Cu3O6.5+δ,实验证明:该物质具有超导性能,其零电阻温度可达90K,化学式中的δ大小与超导性能密切相关。有一种观点认为δ的产生源于体系中产生了Cu3+。
(1)经测定δ一般不大于0.50,按此推算,Cu3+ 占物质中总铜量的质量分数最大为_______ 。
(2)已知可用间接碘量法测出体系中Cu3+ 的质量分数,该法涉及的化学反应有:4Cu3++2H2O=4Cu2++O2+4H+,2Cu2++4I-=Cu2I2+I2,2S2O +I2=S4O
+I2=S4O +2I-等。现有两份质量都为m的该氧化物,其中一份加过量的KI固体,溶解后用浓度为0.1568mol/L的Na2S2O3 滴定至终点,消耗Na2S2O3 的体积为30.26mL,另一份先完全溶解,再加和第一份等量的KI固体,用同样浓度的Na2S2O3 滴定至终点,消耗的体积为23.89mL,该氧化物中Cu3+ 的质量分数为
+2I-等。现有两份质量都为m的该氧化物,其中一份加过量的KI固体,溶解后用浓度为0.1568mol/L的Na2S2O3 滴定至终点,消耗Na2S2O3 的体积为30.26mL,另一份先完全溶解,再加和第一份等量的KI固体,用同样浓度的Na2S2O3 滴定至终点,消耗的体积为23.89mL,该氧化物中Cu3+ 的质量分数为_______ ,m值为_______ 。
(1)经测定δ一般不大于0.50,按此推算,Cu3+ 占物质中总铜量的质量分数最大为
(2)已知可用间接碘量法测出体系中Cu3+ 的质量分数,该法涉及的化学反应有:4Cu3++2H2O=4Cu2++O2+4H+,2Cu2++4I-=Cu2I2+I2,2S2O
 +I2=S4O
+I2=S4O +2I-等。现有两份质量都为m的该氧化物,其中一份加过量的KI固体,溶解后用浓度为0.1568mol/L的Na2S2O3 滴定至终点,消耗Na2S2O3 的体积为30.26mL,另一份先完全溶解,再加和第一份等量的KI固体,用同样浓度的Na2S2O3 滴定至终点,消耗的体积为23.89mL,该氧化物中Cu3+ 的质量分数为
+2I-等。现有两份质量都为m的该氧化物,其中一份加过量的KI固体,溶解后用浓度为0.1568mol/L的Na2S2O3 滴定至终点,消耗Na2S2O3 的体积为30.26mL,另一份先完全溶解,再加和第一份等量的KI固体,用同样浓度的Na2S2O3 滴定至终点,消耗的体积为23.89mL,该氧化物中Cu3+ 的质量分数为
您最近一年使用:0次
8 . MAX(M代表过渡金属元素,A代表主族元素,X代表碳或氮)相是一类备受关注的新型陶瓷材料。由于独特的层状晶体结构,其具有自润滑、高韧性、可导电等性能,可作为高温结构材料、电极材料和化学防腐材料。某MAX相材料含有Ti、Al、N 3种原子,属六方晶系,Ti原子的堆积方式为 …BACBBCABBACBBCAB…,其中A、B、C都是密置单层。N原子占据所有的正八面体空隙,而Al原子占据一半的三棱柱空隙。如果Ti原子层上下同时接触N和Al原子,则沿着晶胞c轴方向,Al和N原子的投影重合。。
(1)写出该化合物的化学式________ ,及每个正当晶胞中的原子种类和个数________ 。
(2)沿着晶胞c轴方向,画一条同时含有Al和N原子的直线,标出直线上的原子排列________ (无需考虑原子间距离,直线上总原子数不少于10个。Al、Ti、N分别用о, Δ,口表示)。
(3)已知Ti、N原子之间的平均键长为210.0 pm, Ti、Al原子之间的平均键长为281.8 pm,估算晶体的理论密度________ (原子量: Ti:47.87, Al:26.98, N: 14.01, NA=6.02 × 1023 mo-1)。
(4)晶粒尺寸会影响上述材料的性质,所以高温制备时一般通过延长保温时间来增加晶粒尺寸。 判断常温下晶粒生长过程的熵变、焓变和自由能变化的正负________ ,并从化学热力学角度判断常温下该晶粒生长过程是否自发________ 。
(5)以上描述均针对完美晶体。一般情况下,晶粒中会出现缺陷。从热力学角度证明:对于足够大的晶体,出现缺陷是自发的________ 。
(1)写出该化合物的化学式
(2)沿着晶胞c轴方向,画一条同时含有Al和N原子的直线,标出直线上的原子排列
(3)已知Ti、N原子之间的平均键长为210.0 pm, Ti、Al原子之间的平均键长为281.8 pm,估算晶体的理论密度
(4)晶粒尺寸会影响上述材料的性质,所以高温制备时一般通过延长保温时间来增加晶粒尺寸。 判断常温下晶粒生长过程的熵变、焓变和自由能变化的正负
(5)以上描述均针对完美晶体。一般情况下,晶粒中会出现缺陷。从热力学角度证明:对于足够大的晶体,出现缺陷是自发的
您最近一年使用:0次
9 . N2O4和NO2的相互转化N2O4(g)⇌2NO(g)是讨 论化学平衡问题的常用体系。已知该反应在295K和315K温度下平衡常数Kp分别为0.100和0.400。将一定量的气体充入一个带活塞的特制容器,通过活塞移动使体系总压恒为lbar(lbar=100kPa)。
(1)计算295K下体系达平衡时N2O4和NO2的分压____ 。
(2)将上述体系温度升至315K,计算达平衡时N2O4和NO2的分压____ 。
(3)计算恒压下体系分别在315K和295K达平衡时的体积比及物质的量之比____ 。
(4)保持恒压条件下,不断升高温度,体系中NO2分压最大值的理论趋近值是____ (不考虑其他反应)?根据平衡关系式给出证明____ 。
(5)上述体系在保持恒外压的条件下,温度从295K升至315K,下列说法正确的是____ 。
a.平衡向左移动 b.平衡不移动 c.平衡向右移动 d.三者均有可能
(6)与体系在恒容条件下温度从295K升至315K的变化相比,恒压下体系温度升高,下列说法正确的是____ (简述理由,不要求计算)。
a.平衡移动程度更大 b.平衡移动程度更小 c.平衡移动程度不变 d.三者均有可能
(1)计算295K下体系达平衡时N2O4和NO2的分压
(2)将上述体系温度升至315K,计算达平衡时N2O4和NO2的分压
(3)计算恒压下体系分别在315K和295K达平衡时的体积比及物质的量之比
(4)保持恒压条件下,不断升高温度,体系中NO2分压最大值的理论趋近值是
(5)上述体系在保持恒外压的条件下,温度从295K升至315K,下列说法正确的是
a.平衡向左移动 b.平衡不移动 c.平衡向右移动 d.三者均有可能
(6)与体系在恒容条件下温度从295K升至315K的变化相比,恒压下体系温度升高,下列说法正确的是
a.平衡移动程度更大 b.平衡移动程度更小 c.平衡移动程度不变 d.三者均有可能
您最近一年使用:0次
解题方法
10 . 下列实验事实不能证明苯分子中不存在独立的碳碳双键的是


| A.用扫描隧道显微镜获得的苯分子图像(如图) |
| B.苯可与氢气在一定条件下发生加成反应 |
| C.苯不能使酸性高锰酸钾溶液褪色 |
| D.环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ·mol-1、-3747 kJ·mol-1和-3265 kJ·mol-1 |
您最近一年使用:0次



