1 . 实验室制取少量 水溶液并探究其酸性,下列实验装置和操作不能达到实验目的的是
水溶液并探究其酸性,下列实验装置和操作不能达到实验目的的是
 水溶液并探究其酸性,下列实验装置和操作不能达到实验目的的是
水溶液并探究其酸性,下列实验装置和操作不能达到实验目的的是 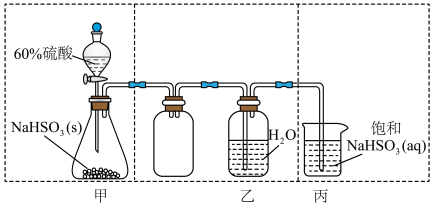
A.用装置甲制取 气体 气体 | B.用装置乙制取 水溶液 水溶液 |
C.用装置丙吸收尾气中的 | D.用干燥pH试纸检验 水溶液的酸性 水溶液的酸性 |
您最近一年使用:0次
2022-07-21更新
|
9819次组卷
|
35卷引用:江苏省2022年普通高中学业水平选择性考试
江苏省2022年普通高中学业水平选择性考试江苏省邳州市2022-2023学年高一上学期期末考试化学试题(已下线)专题07 硫及含硫化合物 环境保护-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)山东新高考2022-2023学年高一上学期质量测评模拟演练化学试题 江苏省南京市金陵中学2023-2024学年高一下学期3月月考化学试题(已下线)专题11 化学实验基础-2022年高考真题模拟题分项汇编(已下线)第13讲 硫及其化合物(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)2022年江苏卷高考真题变式题1-13(已下线)第11讲 硫及其化合物(讲)-2023年高考化学一轮复习讲练测(新教材新高考)安徽师范大学附属中学2022-2023学年高二上学期开学考试化学试题河南省洛阳市第一高级中学2023届高三上学期8月调研考试化学试题湖南省邵阳市第二中学2022-2023学年高二上学期入学考试化学试题(已下线)第28讲 定性、定量实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)微专题43 常见物质的分离、提纯和鉴别-备战2023年高考化学考点微专题(全国版)(已下线)易错点10 硫元素及其化合物-备战2023年高考化学考试易错题江苏省宿迁市泗阳县实验高级中学2022-2023学年高三上学期第一次质量调研化学试题(已下线)专题11 化学实验基础(讲)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题24 实验分析设计型选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 专题8 常见无机物性质的转化(已下线)江苏省2022年普通高中学业水平选择性考试变式题(选择题1-5)(已下线)素养卷07 微型物质制备方案设计-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)回归教材重难点10 再现常考化学实验基础知识-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)江苏省泰州中学2022-2023学年高二5月检测化学试题(已下线)考点10 硫及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第3讲 硫及其重要化合物(已下线)专题11 化学实验(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)第12讲 硫及其化合物(已下线)专题05 化学实验基础-2023年高考化学真题题源解密(全国通用)(已下线)考点15 硫及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)陕西省汉中市西乡县第一中学2023-2024学年高二上学期开学考试化学试题(已下线)考点44 化学实验基础(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点3 物质的制备与性质实验 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)天津市滨海新区田家炳中学2023-2024学年高三上学期期中考试化学试题天津市第四中学2023-2024学年高三上学期第二次月考化学试卷江西省南昌市第十九中学2022-2023学年高三上学期(10月)第三次月考化学试卷
真题
名校
2 . 下列实验能达到实验目的且符合安全要求的是
A.制备氢氧化亚铁并观察其颜色 |
B.收集氧气 |
C.制备并检验氢气的可燃性 |
D.浓硫酸稀释 |
您最近一年使用:0次
2019-01-30更新
|
1560次组卷
|
11卷引用:09真题汇编-物质的制备、分离与提纯、鉴别与检验
09真题汇编-物质的制备、分离与提纯、鉴别与检验2009年普通高等学校招生统一考试理科基础化学部分(广东卷)(已下线)2010—2011学年吉林省长春十一中高一上学期期末考试化学试卷(已下线)2012-2013学年山西省忻州一中高一12月月考化学试卷(已下线)09~10年宝鸡中学高二下学期期末考试化学卷2015-2016学年新疆哈密二中高二下期末化学试卷2017届宁夏石嘴山三中高三上第二次适应性考试化学卷【全国百强校】吉林省延边第二中学2018-2019学年高二下学期第二次月考化学试题2020年安徽省全省教学质量检测统一考试(练习检测一)浙江省温州市龙湾中学2019-2020学年高二下学期第1次居家月考化学试题宁夏石嘴山三中2016届高三(上)第四次质检化学试卷(解析版)
真题
解题方法
3 . 根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量Ar(Cu) (近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H2O),由此计算Ar(Cu)。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):

请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为________________________________ ;
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→______________________________ ;
(3)在本实验中,若测得m(CuO)=ag,m(H2O)=bg,则Ar(Cu)=_______________ ;
(4)在本实验中,使测定结果Ar(Cu)偏大的是_______________ (填序号);
①CuO未完全起反应 ② CuO不干燥
③CuO中混有不反应的杂质 ④碱石灰不干燥
⑤NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定_______________ 和_______________ ,或_______________ 和_______________ 达到实验目的。

请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→
(3)在本实验中,若测得m(CuO)=ag,m(H2O)=bg,则Ar(Cu)=
(4)在本实验中,使测定结果Ar(Cu)偏大的是
①CuO未完全起反应 ② CuO不干燥
③CuO中混有不反应的杂质 ④碱石灰不干燥
⑤NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定
您最近一年使用:0次
2016-12-09更新
|
197次组卷
|
6卷引用:2010年高考化学试题分项专题十五 化学实验
真题
解题方法
4 . 工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是________ 。
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除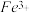 外还可能含有
外还可能含有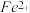 。若要确认其中的
。若要确认其中的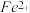 ,应选用
,应选用_________ 选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性 溶液
溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:
然后加入足量 溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中
溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中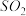 的体积分数为
的体积分数为____________ 。
[探究二]
分析上述实验中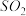 体积分数的结果,丙同学认为气体Y中还可能含有
体积分数的结果,丙同学认为气体Y中还可能含有 和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
(3)装置B中试剂的作用是___________ 。
(4)认为气体Y中还含有Q的理由是___________ (用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于____________ (选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有 ,预计实验现象应是
,预计实验现象应是___________ 。
(7)若要测定限定体积气体Y中 的含量(标准状况下约有28mL
的含量(标准状况下约有28mL ),除可用测量
),除可用测量 体积的方法外,可否选用质量称量的方法?做出判断并说明理由
体积的方法外,可否选用质量称量的方法?做出判断并说明理由_____________ 。
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除
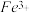 外还可能含有
外还可能含有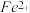 。若要确认其中的
。若要确认其中的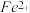 ,应选用
,应选用a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性
 溶液
溶液②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:

然后加入足量
 溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中
溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中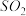 的体积分数为
的体积分数为[探究二]
分析上述实验中
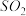 体积分数的结果,丙同学认为气体Y中还可能含有
体积分数的结果,丙同学认为气体Y中还可能含有 和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
(3)装置B中试剂的作用是
(4)认为气体Y中还含有Q的理由是
(5)为确认Q的存在,需在装置中添加M于
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有
 ,预计实验现象应是
,预计实验现象应是(7)若要测定限定体积气体Y中
 的含量(标准状况下约有28mL
的含量(标准状况下约有28mL ),除可用测量
),除可用测量 体积的方法外,可否选用质量称量的方法?做出判断并说明理由
体积的方法外,可否选用质量称量的方法?做出判断并说明理由
您最近一年使用:0次
2019-01-30更新
|
1141次组卷
|
9卷引用:2010年高考化学试题分项专题十一 金属元素及其化合物
2010年高考化学试题分项专题十一 金属元素及其化合物2010年高考化学试题分项专题十五 化学实验(已下线)2010年福建省高校招生全国统一考试理综理科综合能力测试试题(化学)(已下线)2010年黑龙江省双鸭山一中高三上学期期中考试(化学)(已下线)2014高考名师推荐化学--预测12016届重庆市第一中学高三上学期开学考试化学试卷2016届黑龙江省牡丹江一中高三上学期10月月考化学试卷2016届甘肃省张掖、嘉峪关、山丹部分高中高三上学期期中联考化学试卷2016届福建省漳州八校高三上学期12月联考化学试卷
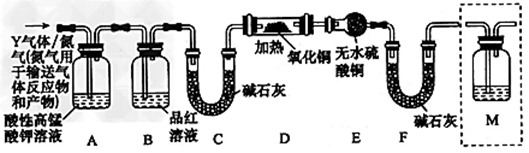
5 . 某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。
(1)装置A中盛放亚硫酸钠的仪器名称是____ ,其中发生反应的化学方程式为_____ 。
(2)实验过程中,装置B、C中发生的现象分别是_______ 、_______ ;这些现象分别说明SO2具有的性质是_______ 和_______ ;装置B中发生反应的离子方程式为_______ 。
(3)装置D的目的是探究SO2与品红反应的可逆性,请写出实验操作及现象_______ 。
(4)尾气可采用_______ 溶液吸收。
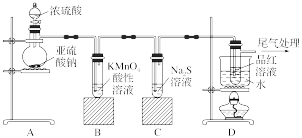
(1)装置A中盛放亚硫酸钠的仪器名称是
(2)实验过程中,装置B、C中发生的现象分别是
(3)装置D的目的是探究SO2与品红反应的可逆性,请写出实验操作及现象
(4)尾气可采用
您最近一年使用:0次
2016-12-09更新
|
5779次组卷
|
57卷引用:2010年高考化学试题分项专题四 离子共存和离子反应
2010年高考化学试题分项专题四 离子共存和离子反应2010年高考化学试题分项专题十二 非金属元素及其化合物2010年高考化学试题分项专题十五 化学实验2010年普通高等学校招生全国统一考试理综化学部分(新课标全国I卷)2010年普通高等学校招生全国统一考试(课标Ⅰ卷)理综化学部分全解全析2010年普通高等学校招生全国统一考试(湖南卷)理综化学部分全解全析(已下线)2012-2013学年广东省汕头市金山中学高一下学期期末考试化学试卷2014-2015海南省文昌中学高一下学期期中段考化学(理)试卷2014-2015学年四川省成都市树德中学高一下学期期末考试化学试卷2015-2016学年广东省汕头市金山中学高一下期末化学试卷四川省资阳市2016-2017学年高一下学期期末考试化学试题云南省腾冲市第八中学2017-2018学年高一下学期第一次月考化学试题步步为赢 高一化学寒假作业:作业十四 硫和氮的氧化物安徽省淮北市第一中学2019-2020学年高一下学期2月在线测试化学试题福建省福州市第一中学2020年高一在线自测自评质检化学试题江西省南昌市第二中学2019-2020学年高一下学期第一次月考化学试题甘肃省西北师范大学附属中学2019-2020学年高一上学期期末考试化学试题辽宁省锦州市凌海市第三高级中学2019-2020学年高一6月月考化学试题山东省济南市长清第一中学2020-2021学年高一上学期第三次月考化学试题(已下线)5.1.1 硫与二氧化硫(练好题)(基础过关)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)陕西省榆林市第十二中学2020-2021学年高一下学期第一次月考化学试题吉林省汪清县第四中学2020-2021学年高一下学期第一次阶段考试化学试题甘肃省金昌市第一中学2020-2021学年高一下学期期中考试化学(理)试题(已下线)广东省深圳中学2020-2021学年高一下学期期中考试化学试题云南省楚雄天人中学2020-2021学年高一下学期3月月考化学(B)试题湖北省安陆市第一高级中学2021-2022学年高一下学期开学考试化学试题(已下线)【期中复习】必刷题-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)甘肃省会宁县第一中学2021-2022学年高一下学期期中(等级考)化学试题辽宁省朝阳市建平县实验中学2021-2022学年高一下学期第一次月考化学试题河南省平顶山市龙河实验高级中学2021-2022学年高一下学期期中考试化学试题安徽省池州市贵池区2021-2022学年高一下学期期中考试化学试题海南省海口嘉勋高级中学2021-2022学年高一下学期5月校考(高考班)化学试题内蒙古自治区第二地质中学2020-2021学年高一下学期第一次阶段检测化学试题(已下线)第01练 硫及其化合物-2023年【暑假分层作业】高一化学(人教版2019必修第二册)山东新高考2022-2023学年高一上学期质量测评模拟演练化学试题 云南省保山市腾冲市第八中学2020-2021学年高一下学期期中考试化学试题云南省腾冲市第八中学2023-2024学年高一下学期开学化学试题湖南省衡阳市衡阳县第一中学2023-2024学年高一下学期4月期中考试化学试题(已下线)2014届贵州省六盘水市六校上学期期末联合统考理综化学试卷(已下线)2014年化学高考总复习课时演练 4-3硫及其重要化合物练习卷(已下线)2015届黑龙江省哈尔滨市第32中学高三上学期期中考试化学试卷(已下线)2015届黑龙江省绥化市三校高三上学期期中联考化学试卷黑龙江省哈尔滨市第三十二中学2018届高三上学期期中考试化学试题广西陆川县中学2018届高三期中考试化学试题(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第3讲 硫及其化合物【教学案】成都龙泉第二中学2019-2020学年高二上学期入学考试化学试题黑龙江省牡丹江市第三高级中学2020届高三上学期第一次月考化学试题(已下线)考点06 典型的非金属元素及其化合物——《备战2020年高考精选考点专项突破题集》2020届高三化学一轮复习 化学基础实验(选择题和大题训练)江苏省邗江中学2019-2020学年高二(新疆班)下学期期中考试化学试题云南省普洱市景东彝族自治县第一中学2019-2020学年高二下学期期中考试理综化学试题(已下线)第15讲 硫及其化合物(精讲)——2021年高考化学一轮复习讲练测(已下线)微专题22 二氧化硫性质四重性探究-备战2022年高考化学考点微专题新疆伊犁市奎屯市第一高级中学2019-2020学年高二上学期期中考试化学试题(已下线)【教材实验热点】06 二氧化硫的漂白性黑龙江省大兴安岭呼玛县高级中学2021-2022学年高三上学期第一次月考化学试题(已下线)第3讲 硫及其重要化合物
真题
解题方法
6 . 某研究性学习小组在网上收集到如下信息: 溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
【实验】制作银镜,并与 溶液反应,发现银镜溶解。
溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是_______________ 。
a. 边振荡盛有2%的 溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止
溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2ml乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
【提出假设】
假设1: 具有氧化性,能氧化Ag。
具有氧化性,能氧化Ag。
假设2: 溶液显酸性,在此酸性条件下
溶液显酸性,在此酸性条件下 能氧化Ag。
能氧化Ag。
【设计实验方案,验证假设】
(2)甲同学从上述实验的生成物中检验出 ,验证了假设1的成立。请写出
,验证了假设1的成立。请写出 氧化Ag的离子方程式:
氧化Ag的离子方程式:_________________________________ 。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示: 在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
【思考与交流】
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立,则丙同学由此得出结论: 溶液中的
溶液中的 和
和 都氧化了Ag。你是否同意丙同学的结论,并简述理由:
都氧化了Ag。你是否同意丙同学的结论,并简述理由:_________________________________________________ 。
 溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:【实验】制作银镜,并与
 溶液反应,发现银镜溶解。
溶液反应,发现银镜溶解。(1)下列有关制备银镜过程的说法正确的是
a. 边振荡盛有2%的
 溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止
溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止b.将几滴银氨溶液滴入2ml乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
【提出假设】
假设1:
 具有氧化性,能氧化Ag。
具有氧化性,能氧化Ag。假设2:
 溶液显酸性,在此酸性条件下
溶液显酸性,在此酸性条件下 能氧化Ag。
能氧化Ag。【设计实验方案,验证假设】
(2)甲同学从上述实验的生成物中检验出
 ,验证了假设1的成立。请写出
,验证了假设1的成立。请写出 氧化Ag的离子方程式:
氧化Ag的离子方程式:(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示:
 在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ① ② | 若银镜消失,假设2成立 若银镜不消失,假设2不成立 |
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立,则丙同学由此得出结论:
 溶液中的
溶液中的 和
和 都氧化了Ag。你是否同意丙同学的结论,并简述理由:
都氧化了Ag。你是否同意丙同学的结论,并简述理由:
您最近一年使用:0次
2016-12-09更新
|
910次组卷
|
6卷引用:2010年高考化学试题分项专题五 氧化还原反应
2010年高考化学试题分项专题五 氧化还原反应2010年高考化学试题分项专题十一 金属元素及其化合物2010年高考试题理综化学部分(安徽卷)(已下线)2010年6月浙江省金温七校高二化学期末卷(已下线)2011届广东省增城中学高三第一次综合测试理综)化学试题(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)
7 . 某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其发扬进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式:SO2+2NaOH=_____________ 。
(2)反应Cl2+Na2SO3+2NaOH=2NaCl+Na2SO4+H2O中的还原剂为_________ 。
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42- 。请设计实验,探究该吸收液中可能存在的其它离子(不考虑空气的CO2的影响)
①提出合理假设
假设1:只存在SO32-;
假设2:既不存在SO32-,也不存在ClO-;
假设3:_____________ ;
②设计实验方案,进行实验。请写出实验步骤以及预期现象和结论。限选实验试剂:3moL L-1H2SO4、1moL
L-1H2SO4、1moL L-1NaOH、0.01mol
L-1NaOH、0.01mol L-1KMnO4、淀粉-KI溶液、紫色石蕊试液。
L-1KMnO4、淀粉-KI溶液、紫色石蕊试液。
(1)请完成SO2与过量NaOH溶液反应的化学方程式:SO2+2NaOH=
(2)反应Cl2+Na2SO3+2NaOH=2NaCl+Na2SO4+H2O中的还原剂为
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42- 。请设计实验,探究该吸收液中可能存在的其它离子(不考虑空气的CO2的影响)
①提出合理假设
假设1:只存在SO32-;
假设2:既不存在SO32-,也不存在ClO-;
假设3:
②设计实验方案,进行实验。请写出实验步骤以及预期现象和结论。限选实验试剂:3moL
 L-1H2SO4、1moL
L-1H2SO4、1moL L-1NaOH、0.01mol
L-1NaOH、0.01mol L-1KMnO4、淀粉-KI溶液、紫色石蕊试液。
L-1KMnO4、淀粉-KI溶液、紫色石蕊试液。| 实验步骤 | 预期现象和结论 |
步骤1:取少量吸收液于试管中,滴加3 moL L-1H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 L-1H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 |  |
| 步骤2: | |
| 步骤3: |
您最近一年使用:0次
2016-12-09更新
|
189次组卷
|
7卷引用:2010年高考化学试题分项专题五 氧化还原反应
真题
解题方法
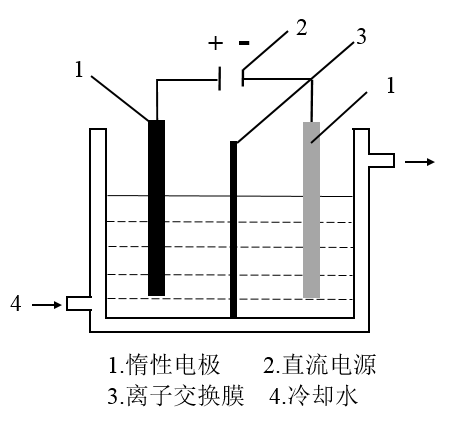
8 . 碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如图所示。请回答下列问题:

(1)碘是_______ (填颜色)固体物质,实验室常用_______ 方法来分离提纯含有少量杂质的固体碘。
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。电解时,阳极上发生反应的电极反应式为_______ ;阴极上观察到的实验现象是_______ 。
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有I-。请设计一个检验电解液中是否有I-的实验方案,并按要求填写下表。
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选。
试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。
(4)电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:

步骤②的操作名称是_______ ,步骤⑤的操作名称是_______ 。步骤④洗涤晶体的目的是_______ 。

(1)碘是
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。电解时,阳极上发生反应的电极反应式为
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有I-。请设计一个检验电解液中是否有I-的实验方案,并按要求填写下表。
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选。
试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。
| 实验方法 | 实验现象及结论 |

步骤②的操作名称是
您最近一年使用:0次
真题
解题方法
9 . 碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如图所示。请回答下列问题:

(1)碘是_______ (填颜色)固体物质,实验室常用_______ 方法来分离提纯含有少量杂质的固体碘。
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。电解时,阳极上发生反应的电极反应式为_______ ;阴极上观察到的实验现象是_______ 。
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有I-。请设计一个检验电解液中是否有I-的实验方案,并按要求填写下表。
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选。
试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。
(4)电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:
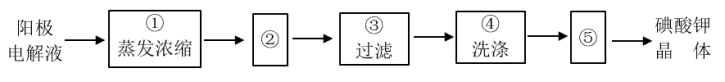
步骤②的操作名称是_______ ,步骤⑤的操作名称是_______ 。步骤④洗涤晶体的目的是_______ 。

(1)碘是
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。电解时,阳极上发生反应的电极反应式为
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有I-。请设计一个检验电解液中是否有I-的实验方案,并按要求填写下表。
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选。
试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。
| 实验方法 | 实验现象及结论 |

步骤②的操作名称是
您最近一年使用:0次
10 . 碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如图所示。请回答下列问题:
(1)碘是_______ (填颜色)固体物质,实验室常用_______ 方法来分离提纯含有少量杂质的固体碘。
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。电解时,阳极上发生反应的电极反应式为_______ ;阴极上观察到的实验现象是_______ 。
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有I-。请设计一个检验电解液中是否有I-的实验方案,并按要求填写下表。
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选。
试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。
(4)电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:
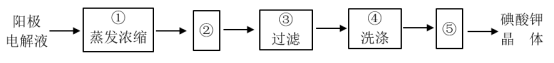
步骤②的操作名称是_______ ,步骤⑤的操作名称是_______ 。步骤④洗涤晶体的目的是_______ 。

(1)碘是
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。电解时,阳极上发生反应的电极反应式为
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有I-。请设计一个检验电解液中是否有I-的实验方案,并按要求填写下表。
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选。
试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。
| 实验方法 | 实验现象及结论 |

步骤②的操作名称是
您最近一年使用:0次



