1 . 物质中的化学能在一定条件下可转化为电能。请依据下图原电池装置回答下列问题。
(1)该装置将反应___________ (写离子方程式)释放的能量直接转化为电能,能证明产生电能的实验现象是:_____________ 。
(2)下列关于该装置说法正确的是:_________ (填字母)。
A.Zn为原电池的正极
B.电子从Cu经导线流向Zn
C.Cu的作用是导电、提供H+得电子的场所
(3)下列反应通过原电池装置,可实现化学能直接转化为电能的是______ (填字母)。
A.2H2+O2 2H2O
2H2O
B.Zn+Cu2+=Zn2++Cu
C.Na2CO3+2HCl=2NaCl+H2O+CO2↑

(1)该装置将反应
(2)下列关于该装置说法正确的是:
A.Zn为原电池的正极
B.电子从Cu经导线流向Zn
C.Cu的作用是导电、提供H+得电子的场所
(3)下列反应通过原电池装置,可实现化学能直接转化为电能的是
A.2H2+O2
 2H2O
2H2OB.Zn+Cu2+=Zn2++Cu
C.Na2CO3+2HCl=2NaCl+H2O+CO2↑
您最近一年使用:0次
2020-09-21更新
|
258次组卷
|
2卷引用:北京市丰台区2020年普通高中合格性考试调研化学试题
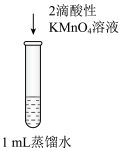
2 . 小组同学探究 与水的反应。
与水的反应。
在注射器中充入 ,然后吸入10mL水,用乳胶管和弹簧夹封住管口,振荡注射器,静置,实验结果如图1所示。一天后,无色气体明显增多,实验结果如图2所示;打开弹簧夹,吸入空气后夹上弹簧夹,无色气体变为红棕色。
,然后吸入10mL水,用乳胶管和弹簧夹封住管口,振荡注射器,静置,实验结果如图1所示。一天后,无色气体明显增多,实验结果如图2所示;打开弹簧夹,吸入空气后夹上弹簧夹,无色气体变为红棕色。_______ 。
(2)进一步探究无色气体增多的原因。
【查阅资料】
ⅰ. 与水反应:
与水反应: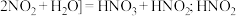 不稳定,分解产生气体。
不稳定,分解产生气体。
ⅱ. 能与KI反应生成
能与KI反应生成 。
。
【提出猜想】溶液A中含有 。
。
【进行实验】
①实验Ⅰ的目的是_______ 。
②实验Ⅱ中选择 溶液的依据是
溶液的依据是_______ (填字母)。
a. 具有氧化性,
具有氧化性, 具有还原性
具有还原性
b. 溶液有颜色,反应前后溶液颜色有变化
溶液有颜色,反应前后溶液颜色有变化
③甲同学认为,实验Ⅲ不能证明溶液A中含有 ,理由是
,理由是_______ 。
【实验反思】
本实验条件下, 与水反应生成了
与水反应生成了 ;
; 分解产生气体,且速率较小。
分解产生气体,且速率较小。
 与水的反应。
与水的反应。在注射器中充入
 ,然后吸入10mL水,用乳胶管和弹簧夹封住管口,振荡注射器,静置,实验结果如图1所示。一天后,无色气体明显增多,实验结果如图2所示;打开弹簧夹,吸入空气后夹上弹簧夹,无色气体变为红棕色。
,然后吸入10mL水,用乳胶管和弹簧夹封住管口,振荡注射器,静置,实验结果如图1所示。一天后,无色气体明显增多,实验结果如图2所示;打开弹簧夹,吸入空气后夹上弹簧夹,无色气体变为红棕色。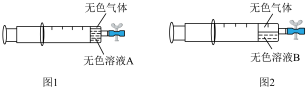
(2)进一步探究无色气体增多的原因。
【查阅资料】
ⅰ.
 与水反应:
与水反应: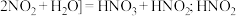 不稳定,分解产生气体。
不稳定,分解产生气体。ⅱ.
 能与KI反应生成
能与KI反应生成 。
。【提出猜想】溶液A中含有
 。
。【进行实验】
实验序号 | Ⅰ | Ⅱ | Ⅲ |
实验操作 |
|
|
|
实验现象 | 液体颜色变为浅红色 | 溶液颜色仍为无色 | 溶液颜色变为蓝色 |
②实验Ⅱ中选择
 溶液的依据是
溶液的依据是a.
 具有氧化性,
具有氧化性, 具有还原性
具有还原性b.
 溶液有颜色,反应前后溶液颜色有变化
溶液有颜色,反应前后溶液颜色有变化③甲同学认为,实验Ⅲ不能证明溶液A中含有
 ,理由是
,理由是【实验反思】
本实验条件下,
 与水反应生成了
与水反应生成了 ;
; 分解产生气体,且速率较小。
分解产生气体,且速率较小。
您最近一年使用:0次
解题方法
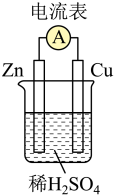
3 . 化学电池的发明,改变了人们的生活方式。
(1)某原电池实验装置如图1。 片作
片作_______ (填“正极”或“负极”)。
② 片上的电极反应为
片上的电极反应为_______ 。
③能证明化学能转化为电能的实验现象是_______ 。
(2)某种氢氧燃料电池的装置如图2所示。
下列说法正确的是_______ (填字母)。
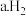 在负极发生反应
在负极发生反应  发生还原反应
发生还原反应
(1)某原电池实验装置如图1。
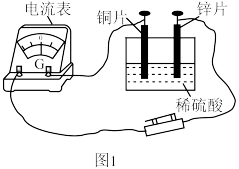
 片作
片作②
 片上的电极反应为
片上的电极反应为③能证明化学能转化为电能的实验现象是
(2)某种氢氧燃料电池的装置如图2所示。


下列说法正确的是
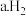 在负极发生反应
在负极发生反应  发生还原反应
发生还原反应
您最近一年使用:0次
4 . 某实验小组研究Zn单质与三价铁盐的反应。
【查阅资料】
1.25℃,pH<7溶液显酸性,pH越小,溶液中H+浓度越大,酸性越强。
2.1 mol·L-1的FeCl3溶液, pH>1时开始产生Fe(OH)3沉淀。
3.Fe2++NO [Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。
[Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。
【实验过程】
【分析解释】
(1)实验I中,经检验反应后的溶液中存在Fe2+,产生Fe2+的离子方程式为___________ 。
(2)实验II中,产生的大量气体为___________ (填化学式)。
(3)实验III中,溶液变成深棕色,NO 发生了如下反应,补全该反应的离子方程式:
发生了如下反应,补全该反应的离子方程式:___________ 。
(4)由实验I~IV可知:过量的Zn与Fe3+反应能否得到Fe单质与多种因素有关,能证明“阴离子种类”是影响因素的实验为___________ (填实验编号)。
(5)一定条件下Fe3+与过量Zn粉反应能够生成Fe单质,其原因与Zn、Fe2+、Fe还原性密切相关,三种微粒还原性由强到弱的顺序为___________
【查阅资料】
1.25℃,pH<7溶液显酸性,pH越小,溶液中H+浓度越大,酸性越强。
2.1 mol·L-1的FeCl3溶液, pH>1时开始产生Fe(OH)3沉淀。
3.Fe2++NO
 [Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。
[Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。【实验过程】
| 实验 | 编号 | 试剂 | 现象 |
| I | 0.1 mol·L-1 FeCl3溶液(pH≈1.30 ) | 黄色溶液很快变浅,有无色气泡产生,无铁产生 |
| II | 1 mol·L-1 FeCl3溶液 (pH≈0.70 ) | 片刻后有大量气体产生,出现红褐色浑浊,约半小时后,产生红褐色沉淀,溶液颜色变浅,产生少量铁 | |
| III | 1 mol·L-1 Fe(NO3)3溶液(pH≈0.70 ) | 约半小时后,溶液变为深棕色且浑浊,无铁产生 | |
| IV | 0.5 mol·L-1 Fe2(SO4)3溶液(pH≈0.70 ) | 约半小时后,溶液呈浅绿色且浑浊,产生少量铁 |
(1)实验I中,经检验反应后的溶液中存在Fe2+,产生Fe2+的离子方程式为
(2)实验II中,产生的大量气体为
(3)实验III中,溶液变成深棕色,NO
 发生了如下反应,补全该反应的离子方程式:
发生了如下反应,补全该反应的离子方程式:3Zn + NO
NO +8H+=3Zn2++
+8H+=3Zn2++ ___________+4H2O
___________+4H2O
(4)由实验I~IV可知:过量的Zn与Fe3+反应能否得到Fe单质与多种因素有关,能证明“阴离子种类”是影响因素的实验为
(5)一定条件下Fe3+与过量Zn粉反应能够生成Fe单质,其原因与Zn、Fe2+、Fe还原性密切相关,三种微粒还原性由强到弱的顺序为
您最近一年使用:0次
解题方法
5 . 为探究 与
与 的反应,小组同学选用两种不同的铁盐进行了如下实验。
的反应,小组同学选用两种不同的铁盐进行了如下实验。
【查阅资料】
ⅰ. 在水溶液中不能稳定存在。
在水溶液中不能稳定存在。
ⅱ.氯化亚铜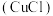 是难溶于水的白色固体。
是难溶于水的白色固体。
【分析解释】
(1)实验Ⅰ中发生反应的离子方程式是_______ 。
(2)为探究实验Ⅱ中白色固体是否为 ,小组同学设计并完成了如图实验。
,小组同学设计并完成了如图实验。 价铜的实验现象是
价铜的实验现象是_______ 。
② 中滴加
中滴加 溶液的目的是
溶液的目的是_______ 。
通过以上实验,证明了实验Ⅱ中白色固体为 。
。
【反思评价】
(3)实验Ⅰ和实验Ⅱ现象不同的原因可能是_______ 。
 与
与 的反应,小组同学选用两种不同的铁盐进行了如下实验。
的反应,小组同学选用两种不同的铁盐进行了如下实验。| 序号 | 实验操作 | 实验现象 |
| Ⅰ | 向盛有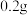 铜片的试管中加入 铜片的试管中加入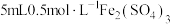 溶液 溶液 | 铜片部分溶解,溶液变为蓝色 |
| Ⅱ | 向盛有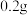 铜片的试管中加入 铜片的试管中加入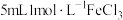 溶液 溶液 | 铜片部分溶解,溶液黄色变浅,铜片表面有白色固体出现 |
ⅰ.
 在水溶液中不能稳定存在。
在水溶液中不能稳定存在。ⅱ.氯化亚铜
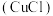 是难溶于水的白色固体。
是难溶于水的白色固体。【分析解释】
(1)实验Ⅰ中发生反应的离子方程式是
(2)为探究实验Ⅱ中白色固体是否为
 ,小组同学设计并完成了如图实验。
,小组同学设计并完成了如图实验。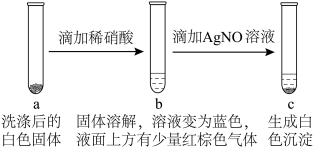
 价铜的实验现象是
价铜的实验现象是②
 中滴加
中滴加 溶液的目的是
溶液的目的是通过以上实验,证明了实验Ⅱ中白色固体为
 。
。【反思评价】
(3)实验Ⅰ和实验Ⅱ现象不同的原因可能是
您最近一年使用:0次
解题方法
6 . 电池的发明是化学对人类的一项重大贡献。
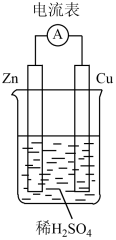
(1)下图所示装置中,Zn片作___________ (填“正极”或“负极”)。Cu片上发生反应的电极反应式为___________ ;能证明化学能转化为电能的实验现象是___________ 。
(2)氢氧燃料电池是一种高效、低污染的新型电池,在新能源汽车、航空航天、轨道交通等领域均有应用。某氢氧燃料电池的示意图如下。

下列说法正确的是___________ (填序号)。
①b电极是电池的负极
②该装置实现了将 反应释放的能量直接转化为电能
反应释放的能量直接转化为电能
③电池工作时,电池内部的 定向移动
定向移动
(1)下图所示装置中,Zn片作

(2)氢氧燃料电池是一种高效、低污染的新型电池,在新能源汽车、航空航天、轨道交通等领域均有应用。某氢氧燃料电池的示意图如下。

下列说法正确的是
①b电极是电池的负极
②该装置实现了将
 反应释放的能量直接转化为电能
反应释放的能量直接转化为电能③电池工作时,电池内部的
 定向移动
定向移动
您最近一年使用:0次
名校
解题方法
7 . 下列不能 达到“实验目的”的“实验操作及现象”是
| 选项 | 实验目的 | 实验操作及现象 |
| A | 证明浓硫酸有吸水性 | 向蔗糖中滴加浓硫酸,蔗糖变黑 |
| B | 证明SO2具有漂白性 | 向品红溶液中通入SO2,溶液褪色 |
| C | 证明氧化性:Br2>I2 | 向KI和淀粉的混合溶液中滴加溴水,溶液变蓝 |
| D | 检验NH4Cl溶液中的NH | 向NH4Cl溶液中加入浓NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-01-17更新
|
319次组卷
|
2卷引用:北京市2022-2023学年高二上学期第二次合格考化学试题
解题方法
8 . 化学电池的发明,改变了人们的生活。
(1)图所示装置中,Cu片作_______ (填“正极”或“负极”)。
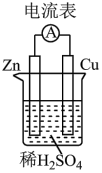
(2)Zn片上发生反应的电极反应式为_______ ;能证明化学能转化为电能的实验现象是_______ 。
(3)常见的锌锰干电池构造示意图如下。
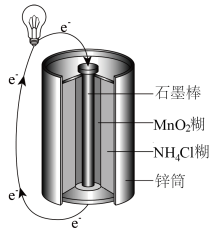
已知:电池的总反应为Zn+2MnO2+2NH =Zn2++Mn2O3+2NH3+H2O。下列说法正确的是
=Zn2++Mn2O3+2NH3+H2O。下列说法正确的是_______ (填字母)。
a.锌筒作负极
b.MnO2发生还原反应
(1)图所示装置中,Cu片作

(2)Zn片上发生反应的电极反应式为
(3)常见的锌锰干电池构造示意图如下。

已知:电池的总反应为Zn+2MnO2+2NH
 =Zn2++Mn2O3+2NH3+H2O。下列说法正确的是
=Zn2++Mn2O3+2NH3+H2O。下列说法正确的是a.锌筒作负极
b.MnO2发生还原反应
您最近一年使用:0次
9 . 某实验小组欲通过加热蒸发KNO3溶液的方法获得KNO3固体。已知KNO3固体在一定温度下能够发生反应:2KNO3 2KNO2 + O2↑。为了探究加热蒸发所得固体X中是否含有KNO2,小组同学分别设计并完成了以下实验。
2KNO2 + O2↑。为了探究加热蒸发所得固体X中是否含有KNO2,小组同学分别设计并完成了以下实验。
【查阅资料】
ⅰ.AgNO2是微溶于水的白色(略带黄色)固体
ⅱ.KNO2能在酸性条件下与KI反应,生成I2
【实验过程】
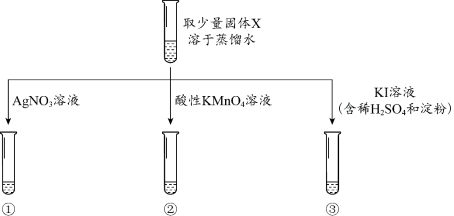
【分析解释】
(1)实验①中,观察到有少量白色沉淀生成,该白色沉淀是_______ 。
(2)实验②中,观察到酸性KMnO4溶液紫红色褪去,利用对比实验排除了稀释对溶液颜色变化的影响。补全该反应的离子方程式:2MnO + 5NO
+ 5NO + 6H+ = 2Mn2+ +
+ 6H+ = 2Mn2+ +_______ + 3H2O
(3)实验③中,观察到溶液变为蓝色。实验③中选择KI溶液的依据是_______ (填字母)。
a.KNO2具有氧化性,KI具有还原性
b.KNO2具有还原性,KI具有氧化性
【反思评价】
(4)综合上述实验,甲同学认为,实验①、②、③均可以证明固体X中含有KNO2;乙同学认为,通过实验③不能证明固体X中含有KNO2。乙同学的理由是_______ 。
 2KNO2 + O2↑。为了探究加热蒸发所得固体X中是否含有KNO2,小组同学分别设计并完成了以下实验。
2KNO2 + O2↑。为了探究加热蒸发所得固体X中是否含有KNO2,小组同学分别设计并完成了以下实验。【查阅资料】
ⅰ.AgNO2是微溶于水的白色(略带黄色)固体
ⅱ.KNO2能在酸性条件下与KI反应,生成I2
【实验过程】

【分析解释】
(1)实验①中,观察到有少量白色沉淀生成,该白色沉淀是
(2)实验②中,观察到酸性KMnO4溶液紫红色褪去,利用对比实验排除了稀释对溶液颜色变化的影响。补全该反应的离子方程式:2MnO
 + 5NO
+ 5NO + 6H+ = 2Mn2+ +
+ 6H+ = 2Mn2+ +(3)实验③中,观察到溶液变为蓝色。实验③中选择KI溶液的依据是
a.KNO2具有氧化性,KI具有还原性
b.KNO2具有还原性,KI具有氧化性
【反思评价】
(4)综合上述实验,甲同学认为,实验①、②、③均可以证明固体X中含有KNO2;乙同学认为,通过实验③不能证明固体X中含有KNO2。乙同学的理由是
您最近一年使用:0次
2022-04-15更新
|
291次组卷
|
2卷引用:北京市2021-2022学年高三年级下学期合格考(第一次)化学试题
名校
10 . 根据原电池原理,人们研制出了性能各异的化学电池。
(1)如图装置中,Zn片作_______ (填“正极”或“负极”),Cu片上发生反应的电极反应式为_______ ,能证明化学能转化为电能的实验现象是_______ 。 = Mg2+ + 3Br-。下列说法正确的是
= Mg2+ + 3Br-。下列说法正确的是_______ (填字母)。
(1)如图装置中,Zn片作
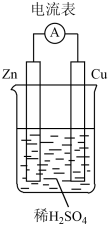
 = Mg2+ + 3Br-。下列说法正确的是
= Mg2+ + 3Br-。下列说法正确的是
您最近一年使用:0次
2022-04-15更新
|
211次组卷
|
3卷引用:北京市2021-2022学年高三年级下学期合格考(第一次)化学试题