1 . 某小组同学探究溶液中的 能否被金属钠还原,进行实验:
能否被金属钠还原,进行实验:
①在干燥试管中加入绿豆大小的金属钠,逐滴滴加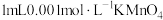 溶液,产生无色气体,溶液由紫红色变为浅绿色
溶液,产生无色气体,溶液由紫红色变为浅绿色 。
。
②向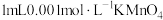 溶液中持续通入
溶液中持续通入 ,水浴加热,溶液颜色无明显变化。
,水浴加热,溶液颜色无明显变化。
③向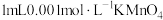 溶液中加入
溶液中加入 固体,溶液由紫红色变为浅绿色。
固体,溶液由紫红色变为浅绿色。
下列说法不正确 的是
 能否被金属钠还原,进行实验:
能否被金属钠还原,进行实验:①在干燥试管中加入绿豆大小的金属钠,逐滴滴加
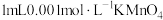 溶液,产生无色气体,溶液由紫红色变为浅绿色
溶液,产生无色气体,溶液由紫红色变为浅绿色 。
。②向
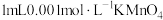 溶液中持续通入
溶液中持续通入 ,水浴加热,溶液颜色无明显变化。
,水浴加热,溶液颜色无明显变化。③向
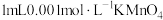 溶液中加入
溶液中加入 固体,溶液由紫红色变为浅绿色。
固体,溶液由紫红色变为浅绿色。下列说法
| A.实验①中还可能观察到钠块浮在溶液表面,剧烈燃烧,发出黄色火焰 |
| B.实验②中的现象说明实验①中溶液变色的原因与产生的气体无关 |
C.实验③中的现象说明实验①中可能发生的反应: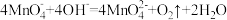 |
D.上述实验能证明溶液中的 可以被金属钠还原 可以被金属钠还原 |
您最近一年使用:0次
2023-05-07更新
|
1689次组卷
|
7卷引用:选择题11-14
(已下线)选择题11-14北京市海淀区2022-2023学年高三第二次模拟(下学期期末)考试化学试题(已下线)T12-化学反应及限度(已下线)第4讲 钠及其重要化合物北京师范大学附属实验中学2023-2024学年暑期高三第一次督导化学试题(已下线)选择题6-10湖南省邵阳市第二中学2023-2024学年高二上学期基础知识竞赛化学试题
名校
解题方法
2 . 某实验小组用如下实验测定海带预处理后所得溶液的碘含量,实验步骤及现象如下:
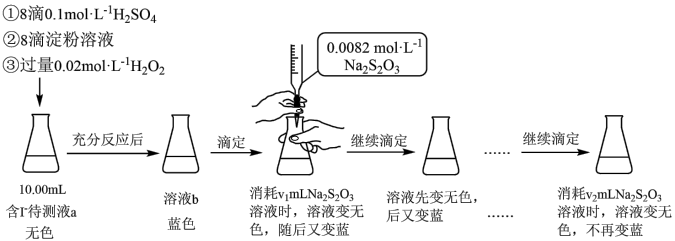
已知:I2+2Na2S2O3=2NaI+Na2S4O6,下列说法不正确 的是:

已知:I2+2Na2S2O3=2NaI+Na2S4O6,下列说法
| A.溶液b为蓝色是因为发生了反应:H2O2+2I-+2H+=I2+2H2O |
| B.该实验可证明蓝色恢复与空气无关 |
| C.溶液反复由无色变蓝的原因可能是H2O2氧化I-的反应速率比Na2S2O3还原I2的反应速率快 |
| D.上述实验不能准确测定待测液中的碘含量,应补充实验步骤:滴定前向溶液b中加少量MnO2,反应至不再产生气泡,过滤,对滤液进行滴定 |
您最近一年使用:0次
2023-11-06更新
|
1274次组卷
|
10卷引用:选择题11-14
(已下线)选择题11-14北京市丰台区2023-2024学年高三上学期期中练习化学试题(已下线)选择题21-23北京实验学校2023-2024学年高三上学期12月化学学科竞赛试题内蒙古赤峰二中2023-2024学年高二上学期第二次月考化学试题湖北省武昌实验中学2023-2024学年高三上学期12月月考化学试题黑龙江省大庆实验中学实验三部2023-2024学年高三上学期阶段考试(二)化学试题湖南省长沙市长郡中学2023-2024学年高二上学期12月阶段性检测化学试题河北省保定市唐县第一中学2023-2024学年高二上学期1月期末化学试题河南省信阳高级中学2023-2024学年高二上学期元旦测试化学试题
3 . 某学习小组通过如图所示装置探究 与
与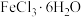 ,能否反应产生
,能否反应产生 ,已知
,已知 的升华温度为315℃。下列相关说法不正确的是
的升华温度为315℃。下列相关说法不正确的是
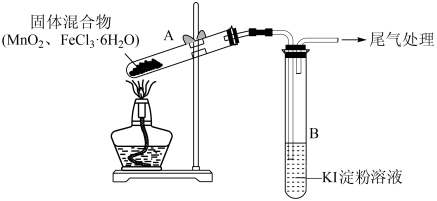
实验操作和现象:
 与
与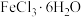 ,能否反应产生
,能否反应产生 ,已知
,已知 的升华温度为315℃。下列相关说法不正确的是
的升华温度为315℃。下列相关说法不正确的是
实验操作和现象:
| 操作 | 现象 |
| 点燃酒精灯,加热 | ⅰ.试管A中部分固体溶解,上方出现白雾,将固体产物分离得到 固体和 固体和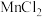 溶液 溶液ⅱ.稍后,试管A中产生黄色气体,管壁附着黄色液滴 ⅲ.试管B中溶液变蓝 |
A.为保证实验的严谨性,应另设置加热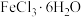 的对照实验 的对照实验 |
| B.黄色气体中可能含有氯化氢、氯化铁和氯气 |
C.为进一步确认黄色气体是否含有 ,应在A、B间增加盛有 ,应在A、B间增加盛有 饱和溶液的洗气瓶 饱和溶液的洗气瓶 |
D.若实验证明A中产生 ,则其化学方程式为 ,则其化学方程式为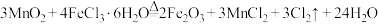 |
您最近一年使用:0次
2022-11-11更新
|
966次组卷
|
5卷引用:T11-物质性质的探究
(已下线)T11-物质性质的探究安徽省安庆市第二中学2022-2023学年高三上学期11月月考化学试题 安徽省阜阳市江淮十校2022-2023学年高三上学期第二次联考化学试题(已下线)化学(山东B卷)-学易金卷:2023年高考第一次模拟考试卷湖南省娄底市第一中学2022-2023学年高三下学期开学摸底考试化学试题
名校
4 . 某小组同学验证SO2的性质。装置如图所示,培养皿中①、②、③三个塑料瓶盖内盛有不同物质。向Na2SO3固体上滴加适量70%的H2SO4,迅速用玻璃片将培养皿盖严,实验记录如表。下列说法不正确 的是
| 实验装置 | 瓶盖 | 物质 | 实验现象 |
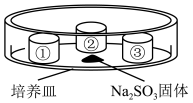 | ① | 酸性KMnO4溶液 | 紫色褪去 |
| ② | 蘸有品红溶液的棉花 | 红色褪去 | |
| ③ | 蒸馏水 | 无明显变化 |
| A.Na2SO3和H2SO4反应的化学方程式:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O |
| B.瓶盖①中的实验现象能证明SO2具有还原性 |
| C.瓶盖②中的实验现象能证明SO2具有漂白性 |
| D.瓶盖③中的实验现象能证明SO2和水不反应 |
您最近一年使用:0次
2022-01-17更新
|
445次组卷
|
6卷引用:选择题11-14
(已下线)选择题11-14北京市石景山区2021-2022学年高三上学期期末考试化学试题(已下线)微专题21 二氧化硫性质四重性探究-备战2023年高考化学一轮复习考点微专题北京市顺义区杨镇第一中学2022-2023学年高三上学期10月月考化学试题(已下线)一轮巩固卷4-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(广东专用)江西省赣州市赣县第三中学2021-2022学年高一下学期3月月考化学试题
名校
解题方法
5 . 室温下,通过实验探究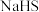 溶液的性质并记录如下。下列说法不正确的是
溶液的性质并记录如下。下列说法不正确的是
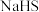 溶液的性质并记录如下。下列说法不正确的是
溶液的性质并记录如下。下列说法不正确的是| 实验 | 实验操作和现象 |
| 1 | 向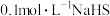 溶液中滴加几滴酚酞试剂,溶液变红 溶液中滴加几滴酚酞试剂,溶液变红 |
| 2 | 向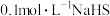 溶液中通入少量 溶液中通入少量 ,产生淡黄色沉淀 ,产生淡黄色沉淀 |
| 3 | 向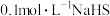 溶液中滴加过量 溶液中滴加过量 溶液,产生黑色沉淀 溶液,产生黑色沉淀 |
A.实验1证明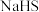 溶液中存在: 溶液中存在: |
B.实验1可推测出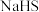 溶液中存在: 溶液中存在: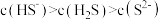 |
C.实验2证明氧化性: |
D.实验3反应静置后的上层清液中存在: |
您最近一年使用:0次
2022-05-28更新
|
234次组卷
|
3卷引用:北京市海淀区2023届高三上学期期末考试变式汇编(8-14)
2020高三·北京·专题练习
名校
解题方法
6 . 某小组同学探究 SO2 与 Fe3+盐溶液的反应,进行了如下实验:已知:Fe3++HSO3- Fe(HSO3)2+(红棕色)
Fe(HSO3)2+(红棕色)
结合上述实验,下列说法不正确的是
 Fe(HSO3)2+(红棕色)
Fe(HSO3)2+(红棕色)| 实验 | ① | ② | ③ |
| 操作 | 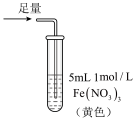 | 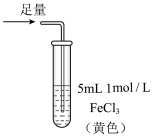 | 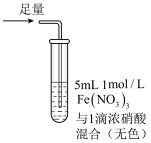 |
| 现象 | 溶液中立即产生大量红棕色物质,无丁达尔现象;5 h 后,溶液变为浅黄色,加入铁氰化钾溶液,产生蓝色沉淀 | 溶液中立即产生大量红棕色物质,无丁达尔现象;5 h 后,溶液几乎无色,加入铁氰化钾溶液,产生大量蓝色沉淀 | 溶液中立即产生大量红棕色物质,无丁达尔现象;5 h 后,溶液变为黄色(比①深),加入铁氰化钾溶液,产生蓝色沉淀 |
| A.产生红棕色物质的反应速率快于SO2与Fe3+氧化还原反应的速率 |
| B.①与②对照,说明阴离子种类对SO2与Fe3+氧化还原反应的速率有影响 |
| C.Fe(NO3)3溶液中加入1滴浓硝酸后变为无色,说明浓硝酸具有漂白性 |
| D.5h后③比①黄色更深不能证明是 NO3-浓度的增大减慢了SO2与Fe3+反应的速率 |
您最近一年使用:0次
7 . 某小组根据 SO2既有还原性又有氧化性,探究其能否实现 Cu2+→Cu 或 Cu→Cu2+的转化。
已知:i.水合 Cu+既易被氧化也易被还原,因此水溶液中无法生成水合 Cu+;
ii.CuCl 为白色固体,难溶于水,可溶于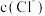 较大的溶液生成
较大的溶液生成  ,也可溶于氨水生成
,也可溶于氨水生成 (无色)。
(无色)。
Ⅰ.SO2与 Cu2+的反应:向试管中通入足量 SO2(尾气处理装置已略),记录如下。
(1)CuCl2溶液呈酸性的原因___________ (用离子方程式解释)。
(2)将 b 所得沉淀过滤,充分洗涤,进行下列实验,证实该沉淀为 CuCl。

①证明白色沉淀中有 Cu+,推理过程是___________ 。
②iii 排除了干扰 Cl‒检验的因素。
写出 iii 中反应的离子方程式___________ ;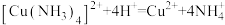
(3)进一步证实 b 中 SO2作还原剂,补全实验方案和预期现象:取 b 中反应后的上层清液于试管中,___________ 。
(4)由实验Ⅰ可推知,该条件下:①a 中 SO2不能将 Cu2+还原为 Cu+或 Cu;②SO2、CuCl、Cu 的还原性由强到弱的顺序为___________ 。
综上所述,改变还原产物的价态或形态可以影响氧化还原反应能否发生。
Ⅱ.SO2与 Cu 的反应:向试管中通入足量 SO2(尾气处理装置已略),记录如下。
(5)证明 d 所得棕色溶液中含有[CuCl3]2‒:用滴管吸取少量棕色溶液,滴入蒸馏水中,出现白色沉淀。用平衡移动原理解释产生该现象的原因:___________ 。
(6)经进一步检验,铜表面黑色沉淀为 Cu2S。补全 d 中反应的离子方程式:___________ 。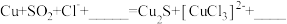
(7)与 c 对比,d 能够发生反应的原因是___________ 。
已知:i.水合 Cu+既易被氧化也易被还原,因此水溶液中无法生成水合 Cu+;
ii.CuCl 为白色固体,难溶于水,可溶于
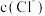 较大的溶液生成
较大的溶液生成  ,也可溶于氨水生成
,也可溶于氨水生成 (无色)。
(无色)。Ⅰ.SO2与 Cu2+的反应:向试管中通入足量 SO2(尾气处理装置已略),记录如下。
| 装置 | 编号 | 试剂 | 实验现象 |
 | a | 1 mol·L‒1 CuSO4溶液 | 始终无明显变化 |
b | 1 mol·L‒1 CuCl2溶液 | 溶液变绿,进而变棕黄色,一段时间后出现白色沉淀 |
(1)CuCl2溶液呈酸性的原因
(2)将 b 所得沉淀过滤,充分洗涤,进行下列实验,证实该沉淀为 CuCl。

①证明白色沉淀中有 Cu+,推理过程是
②iii 排除了干扰 Cl‒检验的因素。
写出 iii 中反应的离子方程式
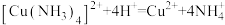
(3)进一步证实 b 中 SO2作还原剂,补全实验方案和预期现象:取 b 中反应后的上层清液于试管中,
(4)由实验Ⅰ可推知,该条件下:①a 中 SO2不能将 Cu2+还原为 Cu+或 Cu;②SO2、CuCl、Cu 的还原性由强到弱的顺序为
综上所述,改变还原产物的价态或形态可以影响氧化还原反应能否发生。
Ⅱ.SO2与 Cu 的反应:向试管中通入足量 SO2(尾气处理装置已略),记录如下。
| 装置 | 编号 | 试剂 | 实验现象 |
 | c | 3 mol·L‒1 稀硫酸 | 始终无明显变化 |
| d | 3 mol·L‒1 稀盐酸 | 铜片表面变黑,溶液变为棕色 |
(5)证明 d 所得棕色溶液中含有[CuCl3]2‒:用滴管吸取少量棕色溶液,滴入蒸馏水中,出现白色沉淀。用平衡移动原理解释产生该现象的原因:
(6)经进一步检验,铜表面黑色沉淀为 Cu2S。补全 d 中反应的离子方程式:
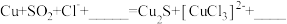
(7)与 c 对比,d 能够发生反应的原因是
您最近一年使用:0次
8 . 维生素C是重要的营养素,其分子结构如图。下列关于维生素C的叙述不正确的是
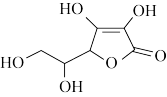
| A.维生素C的分子式为C6H8O6 |
| B.维生素C中的官能团有五种 |
| C.维生素C易溶于水,可能与其分子中含有多个羟基有关 |
| D.向碘和淀粉的混合液中加入维生素C,蓝色褪去,证明维生素C具有还原性 |
您最近一年使用:0次
名校
解题方法
9 . 下列实验方案能达到相应目的的是
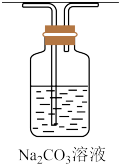 | 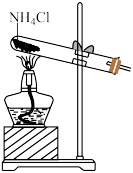 | 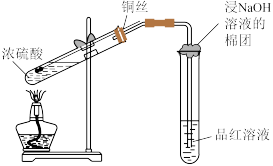 |  |
A.除 中的HCl 中的HCl | B.实验室制 | C.证明浓硫酸有强氧化性 | D.检验 溶液是否变质 溶液是否变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022·北京·高考真题
10 . 某小组同学探究不同条件下氯气与二价锰化合物的反应。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。
ⅱ、浓碱条件下,MnO 可被OH-还原为MnO
可被OH-还原为MnO 。
。
ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
(1)B中试剂是_____ 。
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为_____ 。
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是_____ 。
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO 氧化为MnO
氧化为MnO 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因:_____ ,但通过实验测定溶液的碱性变化很小。
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为_____ ,溶液绿色缓慢加深,原因是MnO2被_____ (填化学式)氧化,可证明实验Ⅲ的悬浊液中氧化剂过量。
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是_____ 。
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:_____ 。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO
 (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。ⅱ、浓碱条件下,MnO
 可被OH-还原为MnO
可被OH-还原为MnO 。
。ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
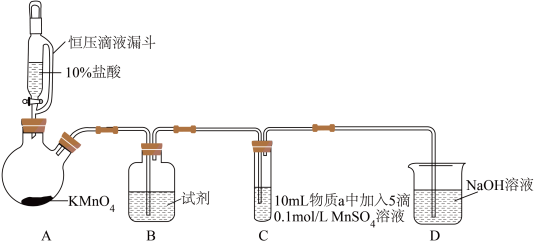
| 实验 | 物质a | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 40%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO
 氧化为MnO
氧化为MnO 。
。①用化学方程式表示可能导致溶液碱性减弱的原因:
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:
您最近一年使用:0次
2023-11-29更新
|
862次组卷
|
29卷引用:2022年北京高考真题变式题1-14
(已下线)2022年北京高考真题变式题1-14(已下线)2022年北京高考真题化学试题变式题(实验探究题)(已下线)2022年北京市高考真题化学试题(部分试题)(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)2022年北京市高考真题化学试题(已下线)第28讲 定性、定量实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点09 氯元素及其化合物-备战2023年高考化学考试易错题(已下线)专题三 离子反应-实战高考·二轮复习核心突破突破超重点 高效突破综合实验 实验4 创新探究实验角度1控制变量法探究(已下线)题型46 实验原理探究型综合实验(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 氯气和卤族元素(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)北京一零一中学2023-2024学年高三上学期11月统练五化学试题(已下线)微专题 物质性质综合实验探究北京市日坛中学2023-2024学年高三上学期10月检测化学试题北京师范大学第二附属中学2023-2024学年高三上学期期中考试化学试题四川省成都市树德中学2022-2023学年高三上学期入学考试理综化学试题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)新疆乌鲁木齐市第101中学2022-2023学年高一上学期12月月考化学试题江苏省苏州市工业园区星海实验高级中学2023-2024学年高一上学期12月调研化学试题山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题



