1 . 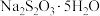 俗称“大苏打”,它是一种常用的试剂.
俗称“大苏打”,它是一种常用的试剂.
(1)工业上,常用 溶液吸收尾气中的
溶液吸收尾气中的 ,氧化产物为
,氧化产物为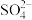 .写出离子方程式:
.写出离子方程式:__________________ .理论上,能发生的氧化还原反应都可以设计成原电池.如果将上述反应设计成原电池,则正极反应式为____________ .
(2)已知: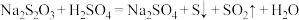
某小组设计实验探究影响化学反应速率的外界因素:
①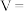
_________ ,设计实验I,Ⅱ的目的是_________ .
②实验测得: .由实验I、Ⅲ得出结论是
.由实验I、Ⅲ得出结论是________________ .
③根据表格信息,__________ (填“能”或“不能”)比较a和d的大小,原因是________ .
(3)已知: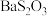 是白色难溶物.大苏打易变质生成
是白色难溶物.大苏打易变质生成 .设计实验证明某大苏打样品是否变质:
.设计实验证明某大苏打样品是否变质:__________________ .
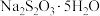 俗称“大苏打”,它是一种常用的试剂.
俗称“大苏打”,它是一种常用的试剂.(1)工业上,常用
 溶液吸收尾气中的
溶液吸收尾气中的 ,氧化产物为
,氧化产物为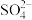 .写出离子方程式:
.写出离子方程式:(2)已知:
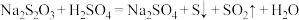
某小组设计实验探究影响化学反应速率的外界因素:
| 序号 | 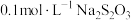 溶液 溶液 | 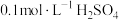 溶液 溶液 | 蒸馏水 | 温度 | 变浑浊时间 |
| I |  |  | 0 | 35℃ | a s |
| II |  | 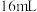 | V mL | 35℃ | b s |
| III |  |  | 0 | 45℃ | c s |
| IV |  | 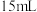 | 5 mL | 40℃ | d s |
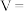
②实验测得:
 .由实验I、Ⅲ得出结论是
.由实验I、Ⅲ得出结论是③根据表格信息,
(3)已知:
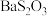 是白色难溶物.大苏打易变质生成
是白色难溶物.大苏打易变质生成 .设计实验证明某大苏打样品是否变质:
.设计实验证明某大苏打样品是否变质:
您最近一年使用:0次
名校
解题方法
2 .  是一种重要的氧化剂与供氧剂。
是一种重要的氧化剂与供氧剂。
(一)研究 与水的反应。取一定量
与水的反应。取一定量 ,加入足量的水,充分反应。
,加入足量的水,充分反应。
(1)反应的离子方程式是_______ 。
(2)收集并测量生成 的体积,发现体积小于理论计算值。某小组研究产生这一差异的原因,进行如下实验。
的体积,发现体积小于理论计算值。某小组研究产生这一差异的原因,进行如下实验。
查阅资料:
a.过氧化钠与水反应的过程中还可能存在以下两个复分解反应:
i.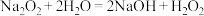 ii.
ii.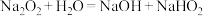
b.与 类似,
类似,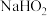 也能在
也能在 催化的条件下分解生成
催化的条件下分解生成
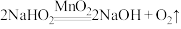
依据资料设计如下实验:取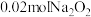 与足量水反应,140s时不再产生气泡,180s时向所得溶液中加入少量
与足量水反应,140s时不再产生气泡,180s时向所得溶液中加入少量 ,立即产生无色气体。过程中溶液的体积始终约为40mL。反应过程中pH变化图所示。
,立即产生无色气体。过程中溶液的体积始终约为40mL。反应过程中pH变化图所示。
已知:溶液中 越大,溶液pH越大
越大,溶液pH越大
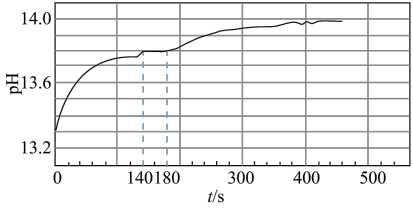
①小组同学根据pH的变化判断反应过程中一定发生反应ⅱ,判断的理由是_______ 。
②根据140s-180s的pH算出溶液中 为0.6mol/L,则此时段内溶液中
为0.6mol/L,则此时段内溶液中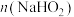 为
为_______ 。
③由上述实验得出的结论是_______ 。
(二) 空气中容易变质。某小组结合(一)的研究设计如下实验测定某久置ag的
空气中容易变质。某小组结合(一)的研究设计如下实验测定某久置ag的 的纯度。
的纯度。
(3)向反应容器中加入一定质量的样品,加入少量 ,再加入足量的水,收集产生的气体并测量体积为VmL(折合到标准状况),计算过氧化钠的纯度
,再加入足量的水,收集产生的气体并测量体积为VmL(折合到标准状况),计算过氧化钠的纯度_______ 。
(4)与水类似,硫酸也能与过氧化钠发生类似反应,若用过量硫酸溶液替代上述方案中的一定量的水,其他测定条件不变,则测量结果会_______ (填“偏大”、“偏小”或“不变”)。
 是一种重要的氧化剂与供氧剂。
是一种重要的氧化剂与供氧剂。(一)研究
 与水的反应。取一定量
与水的反应。取一定量 ,加入足量的水,充分反应。
,加入足量的水,充分反应。(1)反应的离子方程式是
(2)收集并测量生成
 的体积,发现体积小于理论计算值。某小组研究产生这一差异的原因,进行如下实验。
的体积,发现体积小于理论计算值。某小组研究产生这一差异的原因,进行如下实验。查阅资料:
a.过氧化钠与水反应的过程中还可能存在以下两个复分解反应:
i.
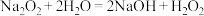 ii.
ii.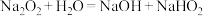
b.与
 类似,
类似,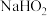 也能在
也能在 催化的条件下分解生成
催化的条件下分解生成
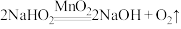
依据资料设计如下实验:取
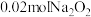 与足量水反应,140s时不再产生气泡,180s时向所得溶液中加入少量
与足量水反应,140s时不再产生气泡,180s时向所得溶液中加入少量 ,立即产生无色气体。过程中溶液的体积始终约为40mL。反应过程中pH变化图所示。
,立即产生无色气体。过程中溶液的体积始终约为40mL。反应过程中pH变化图所示。已知:溶液中
 越大,溶液pH越大
越大,溶液pH越大
①小组同学根据pH的变化判断反应过程中一定发生反应ⅱ,判断的理由是
②根据140s-180s的pH算出溶液中
 为0.6mol/L,则此时段内溶液中
为0.6mol/L,则此时段内溶液中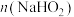 为
为③由上述实验得出的结论是
(二)
 空气中容易变质。某小组结合(一)的研究设计如下实验测定某久置ag的
空气中容易变质。某小组结合(一)的研究设计如下实验测定某久置ag的 的纯度。
的纯度。(3)向反应容器中加入一定质量的样品,加入少量
 ,再加入足量的水,收集产生的气体并测量体积为VmL(折合到标准状况),计算过氧化钠的纯度
,再加入足量的水,收集产生的气体并测量体积为VmL(折合到标准状况),计算过氧化钠的纯度(4)与水类似,硫酸也能与过氧化钠发生类似反应,若用过量硫酸溶液替代上述方案中的一定量的水,其他测定条件不变,则测量结果会
您最近一年使用:0次
解题方法
3 . 关于下列实验的说法中正确的是
| A.实验室中通过加热氯化铵固体制取氨气 |
| B.在胆矾中加入浓硫酸后,胆矾由蓝色变为白色,说明浓硫酸具有吸水性 |
| C.常温下,可以用铝罐贮存浓硫酸和浓硝酸,说明铝与浓硫酸和浓硝酸不反应 |
D.将 样品溶于稀硫酸,滴入 样品溶于稀硫酸,滴入 溶液,溶液变红,说明原样品已变质 溶液,溶液变红,说明原样品已变质 |
您最近一年使用:0次
名校
4 . 根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向某溶液中滴加少量稀硝酸 | 产生白色沉淀 | 该溶液中一定含有SiO32- |
| B | 室温下,测定等浓度的Na2A和NaB溶液的pH | Na2A溶液的pH较大 | 酸性:H2A<HB |
| C | 将0.1mol/LMgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol/LCuSO4溶液 | 先有白色沉淀生成后变为浅蓝色沉淀 | Cu(OH)2的溶度积比Mg(OH)2的小 |
| D | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液 | 溶液变红 | Fe(NO3)2样品已氧化变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
5 . 铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
(1)实验中用已经准确量取的浓硫酸配制500 mL 1 mol·L-1的硫酸溶液,则配制时用到的仪器除烧杯、玻璃棒外,还有两种仪器是_________ ,__________ 。
(2)步骤②加入过量氯水的作用是_____________ ,反应的离子方程式为______________________ 。
(3)步骤④中一系列操作步骤为________ 、洗涤、灼烧、冷却、称量。
(4)若实验无损耗,则该补血剂含铁元素的质量分数为_____________ 。
(5)下列操作会导致所测定的铁元素含量偏高的是___________
A.步骤③所加氨水量不足 B.步骤④洗涤不充分 C.步骤④灼烧不充分.
(6)某同学发现部分补血剂药片表面发黄,取样品研细,溶于1 mol·L-1的硫酸溶液,过滤。取滤液加________ 溶液,若溶液变成____________ 色,说明该补血剂已变质。

(1)实验中用已经准确量取的浓硫酸配制500 mL 1 mol·L-1的硫酸溶液,则配制时用到的仪器除烧杯、玻璃棒外,还有两种仪器是
(2)步骤②加入过量氯水的作用是
(3)步骤④中一系列操作步骤为
(4)若实验无损耗,则该补血剂含铁元素的质量分数为
(5)下列操作会导致所测定的铁元素含量偏高的是
A.步骤③所加氨水量不足 B.步骤④洗涤不充分 C.步骤④灼烧不充分.
(6)某同学发现部分补血剂药片表面发黄,取样品研细,溶于1 mol·L-1的硫酸溶液,过滤。取滤液加
您最近一年使用:0次
2019-01-30更新
|
165次组卷
|
2卷引用:2015-2016学年山西省忻州一中高二下期中化学试卷
名校
解题方法
6 . 高锰酸钾是一种强氧化剂,具有很好的消炎、杀菌、抑菌的作用,因此临床上可以用于急性皮炎、湿疹、皮肤感染等疾病的治疗。
回答下列问题:
(1)某高锰酸钾外用片的部分使用说明及注意事项如下:
①高锰酸钾外用片可以治疗皮肤感染,是应用了高锰酸钾的___________ 性。
②高锰酸钾水溶液易变质的原因是___________ 。
③高锰酸钾外用片不可与碘化物接触或并用的原因是___________ 。
(2)将 溶液酸化可制得
溶液酸化可制得 ,同时生成
,同时生成 ,在此反应中氧化剂和还原剂的物质的量之比为
,在此反应中氧化剂和还原剂的物质的量之比为___________ ;当生成0.1mol还原产物时转移电子的数目为___________ 。
回答下列问题:
(1)某高锰酸钾外用片的部分使用说明及注意事项如下:
| 【注意事项】 1.本品仅供外用,切忌口服。 2.本品水溶液易变质,故使用前用温水配制,并立即使用。 【药品相互作用】 不可与碘化物、有机物接触或并用,尤其是晶体。 |
①高锰酸钾外用片可以治疗皮肤感染,是应用了高锰酸钾的
②高锰酸钾水溶液易变质的原因是
③高锰酸钾外用片不可与碘化物接触或并用的原因是
(2)将
 溶液酸化可制得
溶液酸化可制得 ,同时生成
,同时生成 ,在此反应中氧化剂和还原剂的物质的量之比为
,在此反应中氧化剂和还原剂的物质的量之比为
您最近一年使用:0次
7 . 叠氮化钠(NaN3)是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,可用于合成抗生素头孢菌素药物的中间体、汽车安全气囊的药剂等。氨基钠(NaNH2)的熔点为210℃,沸点为400℃,在水溶液中易水解。实验室制取叠氮化钠的实验步骤及实验装置如下:
①打开止水夹K1,关闭止水夹K2,加热装置D一段时间;
②加热装置A中的金属钠,使其熔化并充分反应后,再停止加热装置D并关闭K1;
③向装置A中b容器内加入加热介质并加热到210~220℃,打开止水夹K2,通入N2O;
④冷却,向产物中加入乙醇,减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。
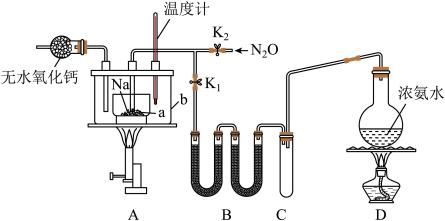
回答下列问题:
(1)装置B中盛放的药品为____________ 。
(2)氨气与熔化的钠反应生成NaNH2的化学方程式为__________ 。
(3)步骤③中,为了使反应受热均匀,A装置里a容器的加热方式为__________ ;生成NaN3的化学方程式为__________ ;N2O可由NH4NO3在240~245℃分解制得(硝酸铵的熔点为169.6℃),则应选择的气体发生装置是_____________ (填序号)。

(4)步骤④中用乙醚洗涤的主要目的是______________ 。
(5)实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:
①将2.500g试样配成500.00mL溶液。
②取50.00mL溶液置于锥形瓶中,加入50.00mL0.1010mol/L(NH4)2Ce(NO3)6溶液。
③充分反应后,将溶液稍稀释,向溶液中加入8mL浓硫酸,滴入3滴邻菲啰啉指示液,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+消耗溶液体积为29.00mL。测定过程的反应方程式为:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑;Ce4++Fe2+=Ce3++Fe3+,则试样中NaN3的质量分数为_______________ 。
①打开止水夹K1,关闭止水夹K2,加热装置D一段时间;
②加热装置A中的金属钠,使其熔化并充分反应后,再停止加热装置D并关闭K1;
③向装置A中b容器内加入加热介质并加热到210~220℃,打开止水夹K2,通入N2O;
④冷却,向产物中加入乙醇,减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。

回答下列问题:
(1)装置B中盛放的药品为
(2)氨气与熔化的钠反应生成NaNH2的化学方程式为
(3)步骤③中,为了使反应受热均匀,A装置里a容器的加热方式为

(4)步骤④中用乙醚洗涤的主要目的是
(5)实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:
①将2.500g试样配成500.00mL溶液。
②取50.00mL溶液置于锥形瓶中,加入50.00mL0.1010mol/L(NH4)2Ce(NO3)6溶液。
③充分反应后,将溶液稍稀释,向溶液中加入8mL浓硫酸,滴入3滴邻菲啰啉指示液,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+消耗溶液体积为29.00mL。测定过程的反应方程式为:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑;Ce4++Fe2+=Ce3++Fe3+,则试样中NaN3的质量分数为
您最近一年使用:0次
名校
解题方法
8 . 锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33℃、沸点为114℃。
2H++SnO22- Sn(OH)2
Sn(OH)2 Sn2++2OH-
Sn2++2OH-
请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为_______ 。
(2)用于微电子器件生产的锡粉纯度测定:
① 取1.19g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
② 加入过量的Fe2(SO4)3;③ 用0.1000 mol/LK2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。
步骤② 中加入Fe2(SO4)3的作用是_______ ;此锡粉样品中锡的质量分数________ 。
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如图所示:
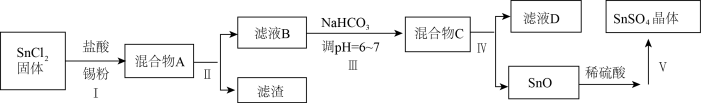
① 步骤I加入Sn粉的作用:___________ 及调节溶液pH。
② 步骤Ⅲ生成SnO的离子方程式:____________________ 。
③ 以锡单质为阳极,铁片为阴极,SnSO4溶液为电解质溶液,在铁片上镀锡,阴极反应式是____________ ,镀锡铁破损后在潮湿的环境中容易发生腐蚀的原因是_________ ,若是在较弱的酸性环境中发生腐蚀,正极反应式是____________ 。
(4)SnCl4蒸气遇水汽呈浓烟状,因而叮制作烟幕弹, 其反应的化学方程式为___________ 。
(5)锡的+2价化合物应具有较强的还原性,已知Sn2+的还原性比 Fe2+的还原性强,PbO2的氧化性比Cl2的氧化性强。试写出下列反应的化学方程式:
① 将SnCl4溶液蒸干灼烧得到的固体物质是________ ;
② 若用SnCl2溶液与过量的碱溶液反应制Sn(OH)2,该碱溶液可选用________ 。
2H++SnO22-
 Sn(OH)2
Sn(OH)2 Sn2++2OH-
Sn2++2OH-请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为
(2)用于微电子器件生产的锡粉纯度测定:
① 取1.19g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
② 加入过量的Fe2(SO4)3;③ 用0.1000 mol/LK2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。
步骤② 中加入Fe2(SO4)3的作用是
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如图所示:

① 步骤I加入Sn粉的作用:
② 步骤Ⅲ生成SnO的离子方程式:
③ 以锡单质为阳极,铁片为阴极,SnSO4溶液为电解质溶液,在铁片上镀锡,阴极反应式是
(4)SnCl4蒸气遇水汽呈浓烟状,因而叮制作烟幕弹, 其反应的化学方程式为
(5)锡的+2价化合物应具有较强的还原性,已知Sn2+的还原性比 Fe2+的还原性强,PbO2的氧化性比Cl2的氧化性强。试写出下列反应的化学方程式:
① 将SnCl4溶液蒸干灼烧得到的固体物质是
② 若用SnCl2溶液与过量的碱溶液反应制Sn(OH)2,该碱溶液可选用
您最近一年使用:0次
2017-05-15更新
|
706次组卷
|
2卷引用:山西省阳泉市第一中学校2022-2023学年高三上学期11月期中考试化学试题
11-12高三·浙江温州·阶段练习
真题
名校
9 . 硒和硫是同一主族元素,二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和一定量的浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3反应的化学方程式:________________________________________ 。
(2)已知:Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O===Se+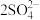 +4H+,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是
+4H+,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是________________________________________ 。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①_____SeO2+_______KI+______HNO3=__________Se+__________I2+__________KNO3+_______H2O
②I2+2Na2S2O3===Na2S4O6+2NaI
配平化学方程①,并标出电子转移的方向和数目。__________
(4)实验中,准确称量SeO2样品0.1500g,消耗了0.2000mol·L-1的Na2S2O3溶液25.00mL,所测样品中SeO2的质量分数为__________ 。
(1)Se和一定量的浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3反应的化学方程式:
(2)已知:Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O===Se+
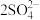 +4H+,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是
+4H+,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①_____SeO2+_______KI+______HNO3=__________Se+__________I2+__________KNO3+_______H2O
②I2+2Na2S2O3===Na2S4O6+2NaI
配平化学方程①,并标出电子转移的方向和数目。
(4)实验中,准确称量SeO2样品0.1500g,消耗了0.2000mol·L-1的Na2S2O3溶液25.00mL,所测样品中SeO2的质量分数为
您最近一年使用:0次
2012-11-23更新
|
1465次组卷
|
16卷引用:2016届山西省晋中市四校高三上学期期中联考化学试卷
2016届山西省晋中市四校高三上学期期中联考化学试卷(已下线)2012-2013学年湖北省部分重点中学高一秋季期中联考化学试卷2016届山西平遥中学等重点中学高三第三次练兵化学试卷2016届辽宁省实验中学分校高三上期中测试理综化学试卷安徽省合肥市第六中学2017-2018学年高一上学期期中考试化学试题(已下线)2013届浙江省乐清市第二中学高三第一次月考化学试卷(已下线)2013-2014黑龙江省鹤岗一中高二下学期期末考试化学试卷2016届山东省枣庄市第二中学高三9月阶段性学情检测化学试题2016届重庆市万州二中高三上学期9月月考化学试卷2016届江西省高安市第二中学高三上学期第二次段考化学试卷2017届湖北省荆州中学高三上学期8月摸底化学试卷2018届高三一轮复习化学:考点14-氧化还原反应的计算山东省济宁市微山县第二中学2018届高三上学期第一次月考化学试题北京市第二十中学2018届高三10月月考化学试题吉林省白城市通榆县第一中学2020届高三上学期第一次月考化学试题2012年上海市高考化学试题



