名校
解题方法
1 . 山大附中化学实验兴趣小组制备高铁酸钾(K2FeO4)并探究其性质和纯度分析。
资料:K2FeO4为紫色固体,微溶于KOH溶液,热稳定性差,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
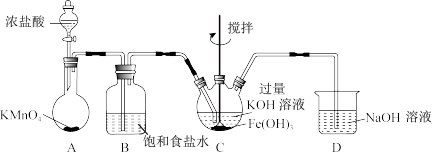
①A为氯气发生装置。A中反应离子方程式是___________ 。
②仪器C的名称为___________ 。反应时C的控温20~25℃,温度不能高于25℃的主要原因___________ 。C中得到紫色固体和溶液。写出C中反应生成K2FeO4的化学方程式___________ 。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2,为证明是否K2FeO4氧化了Cl﹣而产生Cl2,设计以下方案:
i.由方案1中溶液变红可知a中含有___________ 离子,但该离子的产生不能判断一定K2FeO4将Cl﹣氧化,还可能由___________ 产生(用离子方程式表示)。
ii.方案Ⅱ可证明K2FeO4氧化了Cl﹣。用KOH溶液洗涤的目的是___________ 。
②根据K2FeO4的制备实验得出:氧化性Cl2___________ FeO (填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是___________ 。
(3)K2FeO4的纯度分析
将1.32 g样品与过量的的KI溶液 (硫酸酸化)充分反应(杂质不参与反应)后配成100 mL溶液,每次取10.00 mL用0.1000 mol·L-1的Na2S2O3标准溶液滴定,三次滴定消耗Na2S2O3标准溶液体积平均为19.20 mL,则原样品中高铁酸钾的质量分数为___________ 。已知:I2+2Na2S2O3=2NaI+ Na2S4O6
资料:K2FeO4为紫色固体,微溶于KOH溶液,热稳定性差,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中反应离子方程式是
②仪器C的名称为
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2,为证明是否K2FeO4氧化了Cl﹣而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生。 |
ii.方案Ⅱ可证明K2FeO4氧化了Cl﹣。用KOH溶液洗涤的目的是
②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是(3)K2FeO4的纯度分析
将1.32 g样品与过量的的KI溶液 (硫酸酸化)充分反应(杂质不参与反应)后配成100 mL溶液,每次取10.00 mL用0.1000 mol·L-1的Na2S2O3标准溶液滴定,三次滴定消耗Na2S2O3标准溶液体积平均为19.20 mL,则原样品中高铁酸钾的质量分数为
您最近一年使用:0次
2021-12-04更新
|
163次组卷
|
2卷引用:山西大学附属中学校2021-2022学年高三上学期期中考试化学试题
9-10高一下·云南曲靖·期末
名校
解题方法
2 . 苹果汁是人们喜爱的饮料,由于此饮料中含有Fe2+,在空气中易转变为Fe3+。若榨汁时加入维生素C,可有效防止这种现象的发生。这说明维生素C具有
| A.还原性 | B.氧化性 | C.碱性 | D.酸性 |
您最近一年使用:0次
2024-03-06更新
|
214次组卷
|
238卷引用:山西省阳泉市盂县第三中学校2020-2021学年高一上学期期中考试化学试题
山西省阳泉市盂县第三中学校2020-2021学年高一上学期期中考试化学试题山西省灵丘县第四中学校2021-2022学年高一上学期期中考试化学试题(已下线)2010年浙江省杭州市七校高一上学期期中考试化学卷(已下线)2011-2012年河北省大名县第三中学高一上学期期中检测化学试卷(已下线)2011-2012学年湖南省衡阳八中高二上学期期中考试化学(文)试卷(已下线)2011-2012学年江苏省常熟中学高一上学期期中考试化学试卷(已下线)2011-2012学年福建省南安一中高二上学期期中考试化学(文)试卷(已下线)2011-2012学年山东省日照一中高二上学期期中考试化学(文)试卷(已下线)2011-2012年浙江宁波万里国际中学高二上学期期中考试文科化学试卷(已下线)2011-2012学年广东汕头市达濠中学高一第一学期期中考试化学试卷(已下线)2011-2012学年浙江省嘉兴八校高二上学期期中联考文科化学试卷(已下线)2012-2013学年四川成都二十中高一上学期期中考试理科化学试卷(已下线)2012-2013学年山东省日照市某高中高一上学期期中考试化学试卷(已下线)2012-2013学年江苏泰州二中高二上学期期中考试化学(必修)试卷(已下线)2012-2013学年浙江省桐乡一中高二上学期期中考试文科化学试卷(已下线)2012-2013学年陕西省三原县北城中学高一上学期期中考试化学试卷(已下线)2014届河南省平顶山市部分高中高一上学期期中联考化学试卷(已下线)2013-2014学年江西省景德镇市高二上学期期中质量检测文科化学试卷(已下线)2014-2015学年河南省实验中学高一上学期期中考试化学试卷(已下线)2014秋浙江省杭州地区六校高一上学期期中考试化学试卷(已下线)2014秋贵州省遵义市第四中学高二上学期期中化学(文)试卷(已下线)2014-2015江西省景德镇市高二上学期期中化学(文)试卷2014-2015学年江苏省大丰市南阳中学高一下学期期中考试化学试卷2015-2016学年湖南省株洲十八中高二上学期期中(文)化学试卷2015-2016学年浙江省温州市龙湾中学高一上学期期中测试化学试卷2015-2016学年山西省临汾二中高一上学期期末化学试卷2016-2017学年海南省琼海嘉积中学高二上期中文化学卷2016-2017学年云南省昆明三中高一上期中化学试卷2016-2017学年广西桂林十八中高二上期中文化学卷云南省大理市下关一中2017-2018学年高一上学期期中考试化学试题甘肃省兰州市第一中学2017-2018学年高一上学期期中考试化学试题辽宁省抚顺市第十九中学2016-2017学年高一上学期期中考试化学试题内蒙古商都县高级中学2017-2018学年高一上学期期中考试化学试题【全国百强校】江苏省南菁高级中学2017-2018学年高一(1、2班)上学期期中考试化学试题安徽省巢湖市柘皋中学2018-2019学年高二(文)上学期期中考试化学试题云南省楚雄州南华县第一中学2018-2019学年高一上学期期中考试化学试题【校级联考】广西壮族自治区南宁市马山县金伦中学“4+ N”高中联合体2018-2019学年高二上学期期中考试化学试题【全国百强校】福建省师范大学附属中学2018-2019学年高一上学期期中考试化学试题福建省晋江市季延中学2018-2019学年高二(文)上学期期中考试化学试题辽宁省辽河油田第二高级中学2018-2019学年高一上学期期中考试化学试题【市级联考】云南省大理市2017-2018学年高一上学期期中考试化学试题【市级联考】浙江省台州市2018-2019学年高一下学期期中考试化学试题【市级联考】贵州省遵义市2018-2019学年高一下学期期中考试化学试题天津市六校(静海一中,杨村中学,宝坻一中,大港一中等)2019-2020学年高一上学期期中联考化学试题黑龙江省哈尔滨市第六中学2019-2020学年高二上学期期中考试化学(文)试题四川省成都市成都外国语学校2019-2020学年高一上学期期中考试化学试题甘肃省庆阳市宁县第二中学2019-2020学年高二上学期期中考试化学(文)试题山西省太原市第五十三中学2019-2020学年高二上学期12月月考化学(文)试题云南省大理市下关第一中学2019-2020学年高一上学期期中考试化学试题山西省河津市第二中学2019-2020学年高一上学期11月月考化学试题山西省运城市2019-2020学年高一上学期期末调研测试化学试题陕西省宝鸡市金台区2019-2020学年高二上学期期中检测化学试题(文)吉林省吉林市第五十五中学2020-2021学年高一上学期期中考试化学试题江苏省南京师范大学附属中学2020-2021学年高一上学期期中考试化学试题北京市第三十五中学2020-2021学年高一上学期期中考试化学试题甘肃省会宁县第一中学2020-2021学年高二上学期期中考试化学(文)试题安徽省安庆市2020-2021学年高一上学期期中考试化学试题辽宁省开原市第二高级中学2020-2021学年高一上学期期中考试化学试题吉林省油田高级中学2019-2020学年高一上学期期中考试化学试题(已下线)【浙江新东方】76.(已下线)【浙江新东方】71.广东省台山市华侨中学2020-2021学年高一上学期期中考试化学试题甘肃省永昌县第一高级中学2021-2022学年高三上学期期中考试化学试题广东省深圳市红岭中学 2021-2022学年高一上学期期中考试化学试题新疆吐鲁番市高昌区第二中学2021-2022学年高一上学期期中考试化学试题广东省湛江市第二十一中学2021-2022学年高一上学期期中考试化学试题湖南省衡阳市田家炳实验中学2021-2022学年高一上学期期中考试化学试题北京市顺义区第一中学2021-2022学年高一上学期中阶段质量检测化学试题甘肃省秦安县第一中学2021-2022学年高一上学期期中考试化学试题四川省成都市第二十中学2021-2022学年高一上学期期中考试化学试题新疆生产建设兵团第二师八一中学2021-2022学年高一上学期期中考试化学试题甘肃省兰州市西固区三校2021-2022学年高一上学期期中联考化学试题江苏省金湖中学、涟水中学等七校2021-2022学年高一上学期期中大联考化学试题湖北省宜城市第三中学2021-2022学年高一上学期期中化学试题安徽省怀宁县第二中学2021-2022学年高一上学期期中考试化学试题四川省眉山市仁寿第一中学北校区2021-2022学年高一上学期半期化学试题河北省唐山市十县一中联盟2022-2023学年高一上学期期中考试化学试题河北省唐山市2022—2023学年高一上学期期中考试化学试题江苏省海门中学2021--2022学年高一上学期期中考试化学试题天津市武清区2022-2023学年高一上学期期中考试化学试题天津市第三中学2022-2023学年高一上学期期中考试化学试题北京市北京一零一中学2022-2023学年高一上学期期中考试化学试题浙江省杭州市S9联盟2022-2023学年高一上学期期中联考化学试题新疆巴楚县第一中学2021-2022学年高一上学期期中考试化学试题重庆市永川北山中学校2022-2023学年高三上学期期中质量监测化学试题北京市月坛中学2022-2023学年高一上学期期中考试化学试题浙江省宁波市奉化二中2021-2022学年高一上学期期中考试化学试题广东省东莞市翰林高级中学2022-2023学年高一上学期期中考试化学试题江苏省无锡市市北高级中学2022-2023学年高一上学期期中检测化学试题辽宁省鞍山市普通高中2022-2023学年高一上学期期中测试化学(A卷)试题甘肃省庆阳市华池县第一中学2022-2023学年高一上学期期中考试化学试题天津市部分区2023-2024学年高一上学期期中考试化学试题福建省厦门市海沧中学2022-2023学年高一上学期11月期中考试化学试题江苏省连云港高级中学2023-2024学年高一上学期11月期中考试化学试题北京市月坛中学2023-2024学年高一上学期期中考试化学试题(已下线)09-10学年云南会泽一中高一下期末考试化学卷(已下线)江苏省2011届高三化学一轮过关测试(8)(已下线)2010年湖南省浏阳一中高二上学期第三次阶段性测试化学卷(已下线)2011-2012学年甘肃省白银市平川中恒学校高二上学期期末考试化学(文)试卷(已下线)2011-2012学年贵州省湄潭中学高一上学期期末考试化学试卷(已下线)2011-2012学年黑龙江省庆安三中高二下学期期末考试化学试卷(已下线)2011-2012学年安徽省亳州二中高一第一学期期末考试化学试卷(已下线)2012年鲁科版高中化学必修1 2.3氧化剂和还原剂练习卷(已下线)2012-2013学年天津市天津一中高一上学期期末考试化学试卷(已下线)2012年苏教版高中化学选修1 2.2提供能量与营养的食物练习卷(已下线)2012-2013学年广东省深圳科学高中高一第一学期期末考试化学试卷B(已下线)2014-2015学年江苏江阴高一上暑期学习反馈(开学检测)化学试卷2016届福建省四地六校高三上学期第一次联考化学试卷2015-2016学年广西武鸣高级中学高二上段考文化学试卷2015-2016学年上海市虹口区度高二上学期期终考试化学试卷2015-2016学年河北省唐山市迁安二中高一上学期期末化学试卷2015-2016学年湖南省衡阳县高一上学期期末质检化学试卷2015-2016学年广东省惠州市高二上学期期末文化学试卷2016届广西普通高中高三上学期模拟考试化学试卷2015-2016学年广西桂林十八中高二下开学测化学试卷2016-2017学年广东省清远三中高二上第二次月考化学卷2016-2017学年福建省四地六校高一上学期12月月考化学试卷2016-2017学年广东省惠州市高一上学期期末化学试卷2016-2017学年北京市怀柔区高一上学期期末考试化学试卷2016-2017学年黑龙江省鸡西市第十九中学高一上学期期末考试化学试卷2016-2017学年河南省商丘市第一高级中学高一上学期期末考试化学试卷上海市金山中学2016-2017学年高二上学期期末合格考试化学试题甘肃省兰州新舟中学2017-2018学年高一上学期第二次月考化学试题河北省辛集中学2017-2018学年高一上学期12月月考化学试题江苏省东台市创新学校2017-2018学年高一11月月考化学试题青海省西宁二十一中2017-2018学年高一上学期12月月考化学试题四川省攀枝花市2017-2018学年高一上学期调研检测化学试题陕西省岐山县2017-2018学年高二上学期期末质量检测(文科)化学试题安徽省六安市第一中学2017-2018学年高一下学期开学考试化学试题天津市武清区城关中学2019届高三上学期月考(一)化学试题2018-2019学年鲁科版高二化学选修一:模块检测题江苏省东台市创新学校2018-2019学年高二上学期9月月考化学(必修)试题【全国百强校】陕西省西安市第一中学2019届高三上学期第一次月考化学试题【全国百强校】河北省石家庄市辛集中学2018-2019学年高一上学期第二次月考化学试题甘肃省岷县二中2018-2019学年高一上学期第三次月考化学试题甘肃省武威第十八中学2018-2019学年高一上学期期末考试化学试题湖南省醴陵市第一中学2018-2019学年高二(文)上学期期末考试化学试题新疆石河子市兵团八师一四三团第一中学2018-2019学年高一上学期期末考试化学试题【全国百强校】上海市金山中学2017-2018学年高二上学期期末考试(合格考)化学试题云南省元江县一中2020届高三上学期开学考试化学试题山东省聊城第二中学2019-2020学年高一上学期第二次考试(9月)化学试题上海第二工业大学附属龚路中学2018-2019学年高二上学期第一次阶段测试化学试题河南省郑州市106中学2019-2020学年高二9月月考化学(文)试题湖南省常德市2018-2019学年高二下学期期末考试化学试题(文科)陕西省吴起高级中学2019-2020学年高一上学期期末考试化学试题湖南省邵东县创新实验学校2019-2020学年高二上学期期末考试(学考)化学试题(已下线)【新东方】2019新中心五地087高中化学云南省陇川县民族中学2019-2020学年高一上学期期末考试化学试题山东省济南市历城第二中学2019-2020学年高一上学期期末考试化学试题安徽省合肥市六校2019-2020学年高二上学期期末考试化学(文)试题湖南省常德市石门县第二中学2019-2020学年高二上学期第一次月考化学试题(学考)云南省昭通市彝良县一中2019—2020学年高一上学期期末考试化学试题2019-2020学年高一上学期期末复习《新题速递·化学》12月(考点12-15)甘肃省永昌四中2019-2020学年高一上学期期末考试化学试题四川省成都三中2019-2020学年高一11月月考化学试题广西2015-2016学年上学期普通高中学业水平考试仿真模拟化学试题(已下线)【新东方】高中化学X004(已下线)【南昌新东方】莲塘一中化学高一10月份云南省2019年7月普通高中学业水平考试化学试题(已下线)衔接点07 氧化剂和还原剂-2020年【衔接教材·暑假作业】初高中衔接化学(已下线)第01章 物质及其变化(A卷基础强化篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)吉林省长春市榆树市实验高级中学2020-2021学年高一上学期第一次月考化学试题吉林省长春市养正高级中学2020-2021学年高一第一次月考化学试题(已下线)【浙江新东方】32(已下线)3.1.2 铁的氢氧化物 铁盐和亚铁盐(精练)-2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)广东省东莞市东莞中学2020-2021学年高一上学期第一次月考化学试题河北省张家口市涿鹿中学2020-2021学年高一10月调研考试化学试题(已下线)【浙江新东方】双师 (59).西藏自治区林芝市第二高级中学2020-2021学年高一上学期第二学段(期末)考试化学试题吉林省吉化第一高级中学校2020-2021学年高一上学期第一次月考化学试题(已下线)练习7 氧化还原反应-2020-2021学年【补习教材·寒假作业】高一化学(鲁科版2019)海南省东方市八所中学2020-2021学年高一上学期第三次月考化学试题福建省莆田第十五中学2019-2020学年高一12月月考化学试题上海市黄浦区向明中学2020-2021学年高一上学期期末化学试题海南省万宁市北京师范大学万宁附属中学2020-2021学年高一下学期开学考试化学试题浙江省之江教育评价2020-2021学年高一下学期返校联考化学试题(已下线)【浙江新东方】在线化学61高一下福建省莆田第七中学2020-2021学年高一下学期第一次月考化学试题浙江省金华市云富高级中学2020-2021学年高一10月月考化学试题云南省峨山彝族自治县第一中学2020-2021学年高一下学期3月月考化学试题四川省成都市蒲江县蒲江中学2019-2020学年高一上学期12月月考化学试题云南省普洱市第一中学天有实验学校2020—2021学年高一下学期 (文科)月考化学试题(已下线)衔接点07 氧化剂和还原剂-2021年初升高化学无忧衔接(已下线)专题1.3.3 氧化剂、还原剂(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)江苏省南京市金陵中学河西分校2020-2021学年高一上学期10月月考化学试题(已下线)专题六 铁及其化合物(A卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)(已下线)【苏州新东方】04 十中江西省南昌市进贤县第二中学2021-2022高一上学期第一次月考化学广东省广州市祈福教育管理有限公司2021-2022学年高一上学期10月月考化学试题云南省玉溪市江川区第二中学2020-2021学年高一下学期期末考试化学试卷甘肃省天水市田家炳中学2021-2022学年高一上学期第一阶段考试化学试卷上海市吴淞中学2021-2022学年高二上学期第一次月考化学试题云南省玉溪市江川区第二中学2021-2022学年高一上学期第一次月考化学试题广东省茂名市电白区水东中学2021-2022学年高一10月测试化学试题浙江省杭州市富阳区实验中学2021-2022学年高一上学期10月月考化学试题辽宁省阜新市第二高级中学2021-2022学年高一化学上学期第一次月考试题湖南省宁乡市第七高级中学2021-2022学年高一10月月考化学试题广东省梅州市大埔县虎山中学2021-2022学年高一上学期第一次段考(11月)化学试题江苏省徐州市2021-2022学年高一上学期12月月考化学试题吉林省长春市第二十九中学2021-2022学年高一上学期第二学程考试化学(文)试题河南省郑州市第四十七高级中学2021-2022学年高一上学期第二次月考化学试题广东省普宁市华侨中学2021—2022学年高一上学期第三次月考化学试题黑龙江省哈尔滨市阿城区第一中学校2021-2022学年高一上学期10月月考化学试题新疆喀什地区疏附县2021-2022学年高一上学期1月测试化学试题湖南省长沙市湖南师范大学附属中学2021-2022学年高一上学期期末考试化学试题吉林省长春外国语学校2021-2022学年高一上学期期末考试化学试题(学考)(已下线)衔接点12 氧化剂和还原剂-2022年初升高化学无忧衔接?(已下线)1.3 氧化还原反应-同步学习必备知识天津市红桥区2019-2020学年高一上学期期末考试化学试题福建省仙游县枫亭中学2021-2022学年高一上学期期末考试化学试题安徽省青阳县第一中学2021-2022学年高一下学期3月月考化学试题西藏林芝市第二高级中学2021-2022学年高一上学期期末考试化学试题上海市格致中学2022-2023学年高一上学期第一次月考化学试题黑龙江省牡丹江市第三高级中学2022-2023学年高一上学期第一次月考化学试题新疆和田地区皮山县高级中学2021-2022学年高二下学期期末考试化学试题重庆市礼嘉中学校2022-2023学年高一上学期第一次月考化学试题湖北省襄阳四中2021-2022学年高一上学期10月考试化学试题安徽省合肥市庐巢八校联考2022-2023学年高一上学期12月集中练习2化学试题河北省保定市蠡县第二中学2022-2023学年高一上学期12月月考化学试题新疆阿瓦提县第四中学2022-2023学年高一上学期9月份测试化学B试题湖南省衡阳市第八中学2022-2023学年高一上学期期末考试化学试题上海市育才中学2022-2023学年高一上学期期末调研化学试题云南省玉溪第一中学2022-2023学年高一上学期第一月考化学试题 (已下线)考点巩固卷02 化学物质及其变化(3大考点44题)?-2024年高考化学一轮复习考点通关卷(新高考通用)【精品卷】1.3.2 氧化剂和还原剂课堂例题-人教版2023-2024学年必修第一册贵州省三新联盟校2023-2024学年高一上学期10月联考化学试题广西柳州高级中学2023-2024学年高一上学期10月月考化学试题天津市南开中学2023-2024学年高三上学期第二次考试化学试题江苏省苏州大学附属中学2023-2024学年高一上学期10月检测化学试题辽宁省朝阳市建平县实验中学2023-2024学年高一上学期10月月考化学试题福建省福清西山学校2023-2024学年高一上学期12月月考化学试题广西桂林市平乐县平乐中学2023-2024学年高一上学期10月月考化学试题湖南省长沙市雨花区2023-2024学年高一上学期期末质量监测化学试题上海市第三女子中学2023-2024学年高二上学期期末化学合格考试题甘肃省兰州市第五十五中学2023-2024学年高一下学期开学测试化学试卷陕西省延安市延川县中学2023-2024学年高一上学期第一次月考化学试题贵州省毕节市金沙县精诚中学2023-2024学年高一上学期期末考试化学试题内蒙古呼伦贝尔市满洲里远方中学2023-2024学年高一上学期期末考试化学试题
2010·全国·一模
名校
解题方法
3 . 人体血红蛋白中含有Fe2+,如果误食亚硝酸盐会使人中毒,因为亚硝酸盐会使Fe2+变Fe3+,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐中毒。说明维生素C具有
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
您最近一年使用:0次
2020-11-09更新
|
1006次组卷
|
70卷引用:2015-2016学年山西晋城市高平市特立高级中学高二下期中理科化学卷
2015-2016学年山西晋城市高平市特立高级中学高二下期中理科化学卷山西省运城市盐湖五中2019-2020学年高一上学期期中考试化学试题(已下线)2011-2012学年浙江省余姚中学高一下学期期中考试文科化学试卷(已下线)2011-2012学年福建省泉州一中高一下学期期中考试化学试卷(已下线)2012-2013学年浙江省杭州地区七校高一下学期期中联考文科化学试卷(已下线)2013-2014学年山东省临沂市重点中学高一上学期期中考试化学试卷2014-2015山西省原平市一中高一上学期期末考试化学试卷2015-2016学年吉林省吉林五十五中高二上学期期中(文)化学试卷2015-2016学年广东广州执信中学高二上期中文化学试卷2016-2017学年遵义市第四中学高二上学期期中考试化学(文)试卷2016-2017学年广东省广州执信中学高二上期中化学卷甘肃省武威市河西成功学校2017-2018学年高一上学期期中考试化学试题山东省临沂市蒙阴县实验中学2017-2018学年高一上学期期中考试化学试题云南民族大学附属中学2017-2018学年高一下学期期中考试化学试题福建省晋江市季延中学2018-2019学年高二(文)上学期期中考试化学试题山西省祁县第二中学校2018-2019学年高二下学期5月考试化学试题江苏省苏州市第五中学2018-2019学年高二上学期期中考试(必修)化学试题甘肃省嘉峪关市一中2017-2018学年高一上学期期中考试化学试题黑龙江省哈尔滨市第三中学2019-2020学年高二上学期期中考试化学(文)试题上海市嘉定区封浜高中2019-2020学年高二上学期期中考试化学试题江苏省常州市2020-2021学年高一上学期期中考试化学试题江西省九江市浔阳区九江市第七中学2020-2021学年高一上学期期中考试化学试题上海市奉城高级中学2018-20219学年高二上学期期中考试化学试题河南省南阳市油田第一中学2020-2021学年高二上学期期中考试化学试题福建省莆田第一中学2021-2022学年高一上学期期中考试化学试题山西省大同市2021-2022学年高一上学期期末调研化学试题上海理工大学附属中学中2021-2022学年高一下学期期中考试化学试题江苏省常州市金坛区2021-2022学年高一上学期期中教学质量调研化学试题广东省华南师范大学附属中学2020-2021学年高一上学期期中考试化学试题海南省临高县新盈中学2021-2022学年高二上学期(5-8班)期中考试化学试题北京市顺义区杨镇第一中学2023-2024学年高一上学期期中考试化学试题(已下线)高考第一轮复习化学反应与能量变化单元测试(已下线)2010—2011学年云南省元阳一中高一上学期期末考试化学试卷(已下线)2011-2012学年上海理工大学附属中学高一上学期期末考试化学试卷(已下线)2011-2012学年广东省汕头金山中学高一第一学期期末考试化学(文)试卷(已下线)2012-2013学年河北省邢台一中高一上学期第三次月考化学试卷(已下线)2012-2013学年浙江省杭州十四中高一上学期期末考试化学试卷(已下线)2012-2013学年上海市上海理工大学附属中学高一上期末考试化学试卷2015-2016学年宁夏吴忠中学高一上学期期末考试化学试卷2015-2016学年湖南省常德一中高一上学期期末化学试卷2015-2016学年福建省莆田二十五中高一下学期第一次月考化学试卷2016-2017学年广东佛山一中高一上第一次段考化学卷2016-2017学年广东省汕头市金山中学高二上学业水平测试化学卷山东省桓台第二中学2017-2018学年高一12月月考化学试题陕西省西安市长安区第一中学2017-2018学年高二上学期期末考试化学(文)试题广东省惠州市2017-2018学年高一上学期期末教学质量检测化学试题湖南省师范大学附属中学2017-2018学年高二上学期期末考试化学(文)试题云南省昆明市黄冈实验学校2017-2018学年高二上学期期末考试化学(理)试题2018-2019学年鲁科版必修1第2章元素与物质世界本章测试题广东省普通高中2018-2019学年高二学业水平测试预测试题江苏省苏州陆慕高级中学2018-2019学年高一下学期5月月考化学试题云南省云天化中学2019-2020学年高一9月月考化学试题黑龙江省哈尔滨市阿城区龙涤中学2019-2020学年高一上学期第一次段考化学试题湖南省常德市2018-2019学年高二下学期第一次月考化学试题江西省抚州市南城县第二中学2019-2020学年高一上学期第二次月考化学试题江苏省海头高级中学2019-2020学年高一上学期第三次月考化学试题福建省晋江市养正中学2019-2020学年高二上学期第二次月考化学试题安徽省六安市第一中学2019-2020学年高一下学期疫情防控延期开学期间辅导测试(三)化学试题安徽省芜湖市2019-2020学年高二上学期期末考试化学(文)试题辽宁省东北育才学校科学高中部2020-2021学年高一上学期第一学段检测化学试题(已下线)【浙江新东方】7广东省佛山市第一中学2020-2021学年高一上学期第一次段考化学试题吉林省大安市第六中学2019-2020学年高二下学期期末考试化学(理)试题河北省石家庄市第二中学西校区2020-2021学年高一上学期12月月考化学试卷河南省南阳市第四中学2020-2021学年高一上学期第二次月考化学试题辽宁省锦州市黑山县黑山中学2021-2022学年高一上学期12月月考化学试题北京清华大学附属中学2022-2023学年高一上学期期末考试化学试卷湖南省株洲市炎陵县第一中学等2校2022-2023学年高一下学期3月月考化学试题甘肃省武威市天祝藏族自治县第一中学2022-2023学年高一下学期开学考试化学试题广东省汕头市潮阳第一中学2023-2024学年高一上学期12月月考化学试题
4 . 利用图象,可以从不同角度研究含氯物质的性质及其转化关系,图中甲~辛均含氯元素。回答下列问题:

(1)丙的化学式为__________ ,用途之一是__________ ;丁属于__________ (“酸性”或”碱性”)氧化物。
(2)根据氯元素的化合价判断,乙物质__________ 。
a.只有氧化性 b.既有氧化性又有还原性 c.只有还原性
(3)电解甲溶液制备己的化学反应为甲+H2O 己+H2↑(未配平),配平后参与反应的甲与H2O的计量数之比是
己+H2↑(未配平),配平后参与反应的甲与H2O的计量数之比是__________ 。
(4)若庚是漂粉精的有效成分,存放不当,在空气中易失效。原因是________ (用化学方程式表示)。

(1)丙的化学式为
(2)根据氯元素的化合价判断,乙物质
a.只有氧化性 b.既有氧化性又有还原性 c.只有还原性
(3)电解甲溶液制备己的化学反应为甲+H2O
 己+H2↑(未配平),配平后参与反应的甲与H2O的计量数之比是
己+H2↑(未配平),配平后参与反应的甲与H2O的计量数之比是(4)若庚是漂粉精的有效成分,存放不当,在空气中易失效。原因是
您最近一年使用:0次
5 . 向2 mL 1 mol/L淀粉KI溶液中通入SO2再加入1 mL 1mol/L盐酸,溶液迅速变黄,塞紧胶塞静置一段时间,溶液变成乳黄色。
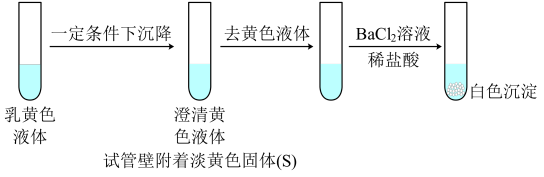
下列说法中不正确 的是
资料:SO2+4I-+4H+=S↓+2I2+2H2O

下列说法中
资料:SO2+4I-+4H+=S↓+2I2+2H2O
| A.整个反应过程中,KI可能起到了催化剂的作用 |
| B.该反应能够证明SO2既有氧化性又有还原性。 |
| C.改变c(H+)对反应速率没有影响 |
| D.结合实验现象可以证明SO2与I-的反应速率小于SO2与I2的反应 |
您最近一年使用:0次
2021-04-04更新
|
248次组卷
|
3卷引用:山西省天镇县实验中学2021-2022学年高二上学期期中考试化学试题
6 . 下列各组性质比较中,不正确的
| A.酸性:HClO4>H2SO4>H3PO4 | B.碱性:KOH> NaOH>LiOH |
| C.单质的氧化性:F2<Cl2<Br2<I2 | D.单质的还原性:Al<Mg<Na |
您最近一年使用:0次
2016-12-09更新
|
56次组卷
|
2卷引用:2014-2015山西省浮山中学高一下学期期中考试化学试卷
13-14高一下·山西·期中
名校
7 . 下列各组性质比较中,正确的是
①酸性:HClO4>HBrO4>HIO4 ②碱性:Ba(OH)2>Mg(OH)2>Be(OH)2
③氧化性:F>C>O ④还原性:Cl<S<Si
⑤气态氢化物稳定性:HF>HCl>H2S
①酸性:HClO4>HBrO4>HIO4 ②碱性:Ba(OH)2>Mg(OH)2>Be(OH)2
③氧化性:F>C>O ④还原性:Cl<S<Si
⑤气态氢化物稳定性:HF>HCl>H2S
| A.①②③ | B.②③④ | C.①②④⑤ | D.①②③④⑤ |
您最近一年使用:0次
2016-07-05更新
|
120次组卷
|
5卷引用:2013-2014山西省山大附中高一下学期期中化学试卷
8 . 部分常见含氯物质的分类与相应化合价关系如图所示。

下列推断不合理的是

下列推断不合理的是
| A.d的稳定性强于e | B.c与d在碱性条件不能大量共存 |
| C.d和e均可用作漂白剂 | D.a和b既具有氧化性,又具有还原性 |
您最近一年使用:0次
2023-01-05更新
|
189次组卷
|
2卷引用:山西大学附属中学校2023-2024学年高一上学期期中考试化学试卷
9 . 某学习小组做了如下实验探究海带中碘元素的存在形式,探究过程如图:
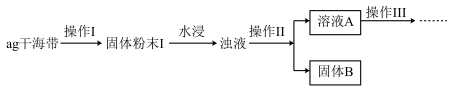
(1)操作I为灼烧,则灼烧时应该用___ (仪器名称)盛装海带,操作II为___ ;
(2)水浸时通常要将悬浊液煮沸2-3min,目的是___ 。
(3)操作III,是同学们对溶液A中碘元素的存在形式进行的探究实验。
推测:①以IO 形式存在②以I-形式存在
形式存在②以I-形式存在
查阅资料:IO 具有较强的氧化性将上述溶液稀释配制成200mL溶液,请完成下列实验探究。
具有较强的氧化性将上述溶液稀释配制成200mL溶液,请完成下列实验探究。
限选试剂:3%H2O2溶液、KSCN溶液、FeC12溶液、稀硫酸
(4)取20mL稀释后溶液A于锥形瓶,滴加0.01mol/LKMnO4溶液至溶液刚显浅红色,将I-氧化为I2并得到溶液B;已知在酸性条件下,MnO 的还原产物为Mn2+,写出离子方程式
的还原产物为Mn2+,写出离子方程式___ 。

(1)操作I为灼烧,则灼烧时应该用
(2)水浸时通常要将悬浊液煮沸2-3min,目的是
(3)操作III,是同学们对溶液A中碘元素的存在形式进行的探究实验。
推测:①以IO
 形式存在②以I-形式存在
形式存在②以I-形式存在查阅资料:IO
 具有较强的氧化性将上述溶液稀释配制成200mL溶液,请完成下列实验探究。
具有较强的氧化性将上述溶液稀释配制成200mL溶液,请完成下列实验探究。限选试剂:3%H2O2溶液、KSCN溶液、FeC12溶液、稀硫酸
| 序号 | 实验操作 | 实验现象 | 结论 |
| ① | 取少量稀释后的溶液A加入淀粉后再 用硫酸酸化,分装于试管I、II | 无现象 | |
| ② | 往试管I中加入FeC12溶液,然后加入2滴KSCN溶液并振荡; | 证明不是以IO 形式存在 形式存在 | |
| ③ | 往试管II中加入 | 证明以I-形式存在 |
(4)取20mL稀释后溶液A于锥形瓶,滴加0.01mol/LKMnO4溶液至溶液刚显浅红色,将I-氧化为I2并得到溶液B;已知在酸性条件下,MnO
 的还原产物为Mn2+,写出离子方程式
的还原产物为Mn2+,写出离子方程式
您最近一年使用:0次
10 . 氧化还原反应原理在研究物质性质及物质转化等方面具有重要的价值。回答下列问题:
(1)按照不同的分类方法将下列化学反应进行分类。
a. CO2+C 2CO
2CO
b. 3Fe+4H2O(g) Fe3O4 +4H2
Fe3O4 +4H2
c. CuO+CO Cu+CO2
Cu+CO2
d. NaOH+HCl=NaCl+ H2O
e.2H2+O2 2H2O
2H2O
①其中属于氧化还原反应,但不属于四大基本反应类型的是_______ (填字母,下同);
②其中属于置换反应的是_______ 。
(2)用惰性电极电解饱和食盐水可以得到NaOH、H2、Cl2,写出该反应的化学方程式:_______ 。
(3)亚硝酸钠(NaNO2)具有致癌作用,许多腌制食品中含NaNO2。酸性KMnO4溶液与NaNO2反应的化学方程式为2KMnO4+5NaNO2+3H2SO4=2MnSO4+K2SO4+5NaNO3+3H2O,将它改写为离子方程式并用双线桥表示电子转移的方向和数目:_______ 。
(4)新储氢材料——碳纳米管可利用电弧法合成,合成过程中会伴随大量的碳纳米颗粒杂质,这种碳纳米颗粒杂质可用氧化气化法提纯,反应方程式为2K2Cr2O7+3C+8H2SO4=2Cr2(SO4)3+2X+8H2O+3CO2↑。
①该反应中,生成物X的化学式为_______ ;
②该反应中,氧化剂为_______ (填化学式),被氧化的元素为_______ (填元素符号);
③该反应中,H2SO4表现出_______ (填字母);
A.酸性 B.还原性 C.氧化性
④该反应中,每生成3 mol CO2,转移_______ mol电子。
(1)按照不同的分类方法将下列化学反应进行分类。
a. CO2+C
 2CO
2COb. 3Fe+4H2O(g)
 Fe3O4 +4H2
Fe3O4 +4H2c. CuO+CO
 Cu+CO2
Cu+CO2d. NaOH+HCl=NaCl+ H2O
e.2H2+O2
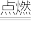 2H2O
2H2O①其中属于氧化还原反应,但不属于四大基本反应类型的是
②其中属于置换反应的是
(2)用惰性电极电解饱和食盐水可以得到NaOH、H2、Cl2,写出该反应的化学方程式:
(3)亚硝酸钠(NaNO2)具有致癌作用,许多腌制食品中含NaNO2。酸性KMnO4溶液与NaNO2反应的化学方程式为2KMnO4+5NaNO2+3H2SO4=2MnSO4+K2SO4+5NaNO3+3H2O,将它改写为离子方程式并用双线桥表示电子转移的方向和数目:
(4)新储氢材料——碳纳米管可利用电弧法合成,合成过程中会伴随大量的碳纳米颗粒杂质,这种碳纳米颗粒杂质可用氧化气化法提纯,反应方程式为2K2Cr2O7+3C+8H2SO4=2Cr2(SO4)3+2X+8H2O+3CO2↑。
①该反应中,生成物X的化学式为
②该反应中,氧化剂为
③该反应中,H2SO4表现出
A.酸性 B.还原性 C.氧化性
④该反应中,每生成3 mol CO2,转移
您最近一年使用:0次
2023-12-04更新
|
109次组卷
|
4卷引用:山西省朔州市怀仁市第一中学校2023-2024学年高一上学期12月期中理综试题



