1 . 下列实验操作或方案正确的是
A.向某溶液中加盐酸,产生的无色无味气体能使澄清石灰水变浑浊,则原溶液中一定有 |
B.滴入NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,则原溶液一定含有 |
C.检验 晶体是否已经氧化变质:将 晶体是否已经氧化变质:将 样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| D.碳和浓硫酸加热所得气体产物依次通过品红溶液和澄清石灰水,品红溶液褪色,澄清石灰水变浑浊,则气体产物中含有CO2和SO2 |
您最近一年使用:0次
解题方法
2 . 钠的化合物是化工生产与科学研究的重要组成部分。
(1)将Na、 、
、 、NaOH长时间露置在空气中,最终都会变为
、NaOH长时间露置在空气中,最终都会变为______ (填化学式)。
(2)探究某 样品是否已经变质:取少量
样品是否已经变质:取少量 样品,将其溶于水,加入
样品,将其溶于水,加入 溶液,充分振荡后,观察到
溶液,充分振荡后,观察到_______ (填实验现象),则说明 样品已经与空气中的
样品已经与空气中的 发生反应变质。
发生反应变质。
(3)“神舟号”载人航天器的返回舱内,为防止 浓度过大引起宇航员困乏,可用
浓度过大引起宇航员困乏,可用 降低
降低 的浓度,有关反应的化学方程式为
的浓度,有关反应的化学方程式为_______ ;用 (超氧化钾)代替
(超氧化钾)代替 也能达到同样的目的,反应产物也很相似,试计算用
也能达到同样的目的,反应产物也很相似,试计算用 和
和 分别与
分别与 反应,产生等质量的
反应,产生等质量的 ,所需
,所需 和
和 的质量比为
的质量比为_____ (填最简整数比)。
(4)食品工业经常把 和
和 用作膨松剂,室温下向含某膨松剂试样(
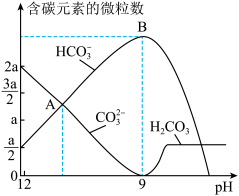
用作膨松剂,室温下向含某膨松剂试样(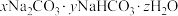 )的溶液中逐滴加入稀盐酸,反应过程中含碳元素的微粒数随pH变化的图像如图所示。(已知:
)的溶液中逐滴加入稀盐酸,反应过程中含碳元素的微粒数随pH变化的图像如图所示。(已知: 因有逸出未画出;
因有逸出未画出; 与少量盐酸发生下列反应:
与少量盐酸发生下列反应: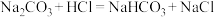 )。
)。
①x:y=____ 。
②图中B点溶液溶质的主要成分为_______ (填化学式),B点后发生反应的离子方程式为______ 。
(1)将Na、
 、
、 、NaOH长时间露置在空气中,最终都会变为
、NaOH长时间露置在空气中,最终都会变为(2)探究某
 样品是否已经变质:取少量
样品是否已经变质:取少量 样品,将其溶于水,加入
样品,将其溶于水,加入 溶液,充分振荡后,观察到
溶液,充分振荡后,观察到 样品已经与空气中的
样品已经与空气中的 发生反应变质。
发生反应变质。(3)“神舟号”载人航天器的返回舱内,为防止
 浓度过大引起宇航员困乏,可用
浓度过大引起宇航员困乏,可用 降低
降低 的浓度,有关反应的化学方程式为
的浓度,有关反应的化学方程式为 (超氧化钾)代替
(超氧化钾)代替 也能达到同样的目的,反应产物也很相似,试计算用
也能达到同样的目的,反应产物也很相似,试计算用 和
和 分别与
分别与 反应,产生等质量的
反应,产生等质量的 ,所需
,所需 和
和 的质量比为
的质量比为(4)食品工业经常把
 和
和 用作膨松剂,室温下向含某膨松剂试样(
用作膨松剂,室温下向含某膨松剂试样(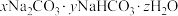 )的溶液中逐滴加入稀盐酸,反应过程中含碳元素的微粒数随pH变化的图像如图所示。(已知:
)的溶液中逐滴加入稀盐酸,反应过程中含碳元素的微粒数随pH变化的图像如图所示。(已知: 因有逸出未画出;
因有逸出未画出; 与少量盐酸发生下列反应:
与少量盐酸发生下列反应: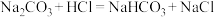 )。
)。①x:y=
②图中B点溶液溶质的主要成分为

您最近一年使用:0次
3 . 室温下进行下列实验,根据实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 加热盛有 固体的试管,试管底部固体消失,试管口有固体凝结 固体的试管,试管底部固体消失,试管口有固体凝结 |  固体受热易升华 固体受热易升华 |
| B | 将 样品溶于稀硫酸后,滴加KSCN溶液,溶液变为红色 样品溶于稀硫酸后,滴加KSCN溶液,溶液变为红色 |  样品已变质 样品已变质 |
| C | 向无色气体中通入少量氧气,气体变成红棕色,加水振荡后变为无色 | 该无色气体含有NO |
| D | 取5mL 0.1 KI溶液,加入1mL 0.1 KI溶液,加入1mL 0.1  溶液,用 溶液,用 萃取,下层呈紫红色,分液后,向水层滴入KSCN溶液,溶液变成红色 萃取,下层呈紫红色,分液后,向水层滴入KSCN溶液,溶液变成红色 |  与 与 所发生的反应为可逆反应 所发生的反应为可逆反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-08-21更新
|
164次组卷
|
2卷引用:安徽省皖中名校2022-2023学年高一下学期期中联考化学试题
名校
4 . 过氧化钠保存不当容易变质生成Na2CO3
(1)关于碳酸钠的分类正确的是________
(2)某过氧化钠样品已经部分变质,用一种溶液 ,证明过氧化钠已经变质,这种试剂可以选用:___________
(3)检验样品中还有过氧化钠的方法是取适量样品放入试管中,再加入适量的水,将气体通过盛有___________ 的洗气瓶收集气体能使带火星的木条复燃,证明样品中仍有Na2O2。
(4)某课外活动小组为了测定过氧化钠的质量分数,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。
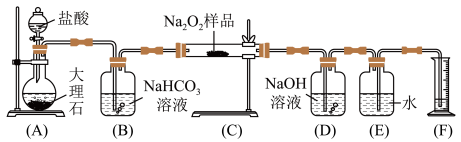
①写出仪器或装置的名称,图A中盛放盐酸的仪器___________ ;装置B的名称___________ ;
②上图中的E和F构成量气装置,用来测定O2的体积。他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为__________ ;若去掉(D)装置,测量数值偏___________ (填“高、低或无影响”)。
(1)关于碳酸钠的分类正确的是________
| A.氧化物 | B.碱 | C.盐 | D.电解质 |
(2)某过氧化钠样品已经部分变质,用
| A.BaCl2溶液 | B.稀盐酸 | C.石蕊溶液 | D.AgNO3溶液 |
(3)检验样品中还有过氧化钠的方法是取适量样品放入试管中,再加入适量的水,将气体通过盛有
(4)某课外活动小组为了测定过氧化钠的质量分数,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。

①写出仪器或装置的名称,图A中盛放盐酸的仪器
②上图中的E和F构成量气装置,用来测定O2的体积。他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为
您最近一年使用:0次
5 . 为检验某漂白粉是否变质,进行下列探究实验:
实验1:取5g漂白粉样品于烧杯中,加足量蒸馏水并搅拌,观察到有固体不溶解。
实验2:静置,取少量实验1的上层清液于试管中。放入红色花瓣,观察到花瓣褪色。
实验3:另取5g漂白粉样品于试管中,滴加浓盐酸,观察到有气体产生。
下列说法正确的是
实验1:取5g漂白粉样品于烧杯中,加足量蒸馏水并搅拌,观察到有固体不溶解。
实验2:静置,取少量实验1的上层清液于试管中。放入红色花瓣,观察到花瓣褪色。
实验3:另取5g漂白粉样品于试管中,滴加浓盐酸,观察到有气体产生。
下列说法正确的是
| A.工业上用氯气和澄清石灰水制取漂白粉 |
| B.实验1和实验2说明漂白粉没有变质 |
| C.实验3中产生的气体只有氯气 |
D.实验3中下列反应的电子转移可表示为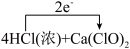 =CaCl2+2Cl2↑+2H2O =CaCl2+2Cl2↑+2H2O |
您最近一年使用:0次
2023-02-15更新
|
819次组卷
|
9卷引用:安徽省六安市舒城晓天中学2023-2024学年高一上学期期中考试化学试卷
安徽省六安市舒城晓天中学2023-2024学年高一上学期期中考试化学试卷(已下线)专题05 氯及其化合物【考点清单】(讲+练)-2023-2024学年高一化学上学期期中考点大串讲(人教版2019必修第一册)(已下线)专题05 氯及其化合物【考题猜想】(10大题型)-2023-2024学年高一化学上学期期中考点大串讲(人教版2019必修第一册)江苏省南京市2022-2023学年高一上学期期末学情调研测试化学试题(已下线)第07讲 氯气的性质和次氯酸-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)辽宁省丹东市凤城市第一中学2023-2024学年高三上学期10月测试化学试题(已下线)专题04 氯气及氯的化合物-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)江苏省江都区大桥中学2023-2024学年高一上学期期末复习模拟测试化学试题贵州省遵义市桐梓县荣兴高级中学2023-2024学年高一上学期第四次月考化学试题
名校
解题方法
6 . 过氧化钠常用作漂白剂、杀菌剂、消毒剂,能与水和二氧化碳等物质发生反应,保存不当时容易变质。某实验小组以过氧化钠为研究对象进行了如下实验。
(1)探究一包Na2O2样品是否已经变质:取少量样品,加水将其溶解,加入_______ 溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该实验小组为了粗略测定过氧化钠的质量分数,称取了m g样品,并设计用下图装置来测定过氧化钠的质量分数。
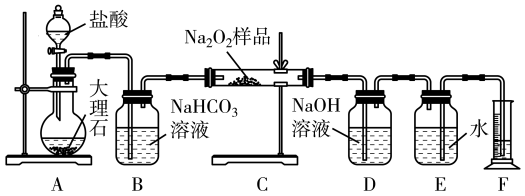
①装置中盛放盐酸的仪器的名称是_______ ,装置B中发生反应的离子方程式是_______ 。
②将仪器连接好以后,必须进行的第一步操作是_______ 。
③写出装置C中发生的主要反应的化学方程式:_______ 。
④反应结束后,在读取实验中生成气体的体积时,你认为合理的是_______ (填序号)。
A.读取气体体积前,需冷却到室温
B.调整量筒使E、F内液面高度相同
C.视线与凹液面的最低点相平时读取量筒中水的体积
⑤读出量筒内水的体积后,将其折算成氧气的质量为ng,则样品中过氧化钠的质量分数为_______ ×100%。
⑥压强不变时在一个密闭容器中放入足量过氧化钠固体,然后充入等体积的CH4和O2,电火花引燃后充分反应,恢复至原温度,余下气体的体积为原体积的_______ 。
(1)探究一包Na2O2样品是否已经变质:取少量样品,加水将其溶解,加入
(2)该实验小组为了粗略测定过氧化钠的质量分数,称取了m g样品,并设计用下图装置来测定过氧化钠的质量分数。

①装置中盛放盐酸的仪器的名称是
②将仪器连接好以后,必须进行的第一步操作是
③写出装置C中发生的主要反应的化学方程式:
④反应结束后,在读取实验中生成气体的体积时,你认为合理的是
A.读取气体体积前,需冷却到室温
B.调整量筒使E、F内液面高度相同
C.视线与凹液面的最低点相平时读取量筒中水的体积
⑤读出量筒内水的体积后,将其折算成氧气的质量为ng,则样品中过氧化钠的质量分数为
⑥压强不变时在一个密闭容器中放入足量过氧化钠固体,然后充入等体积的CH4和O2,电火花引燃后充分反应,恢复至原温度,余下气体的体积为原体积的
您最近一年使用:0次
2022-10-26更新
|
372次组卷
|
2卷引用:安徽省安庆市第一中学2022-2023学年高一上学期期中考试化学试题
名校
解题方法
7 . 下列化学物质在实际生产生活和科技等方面的叙述正确的是
| A.SO2、漂白粉、Na2O2都能使品红溶液褪色,其作用原理相同 |
| B.在食品袋中放入装有硅胶、铁粉的透气小袋,可防止食物受潮、氧化变质 |
| C.高温结构陶瓷、压电陶瓷等新型陶瓷均属于硅酸盐材料 |
| D.某雨水样品放置一段时间酸性增强,是因为空气中的CO2溶解进入雨水 |
您最近一年使用:0次
2021-05-10更新
|
295次组卷
|
2卷引用:安徽省合肥市第一中学2020-2021学年高一下学期期中考试化学试题
8 . 氧化还原反应在生产、生活和生命活动中起着十分重要的作用。例如,燃料的燃烧与利用、金属的冶炼、食品的加工与保存、环境污染的监测与治理过程中都涉及氧化还原反应。
(1)天然气的主要成分是甲烷,完全燃烧时发生反应CH4+2O2 CO2 +2H2O,则反应中的还原剂是
CO2 +2H2O,则反应中的还原剂是_______ (填化学式,下同),氧化产物是_______ 。
(2)“曾青得铁则化为铜”出自西汉淮南王刘安的《淮南万毕术》,是关于湿法炼铜的最早记录。已知曾青为硫酸铜,则反应的离子方程式为_______ ,反应中的氧化剂是_______ 。
(3)我国自主研制的第五代单座双发隐形战斗机歼—31使用了高强度、耐高温的钛合金材料。工业上冶炼钛的反应为TiCl4+2Mg Ti+2MgCl2.反应中被氧化的元素是
Ti+2MgCl2.反应中被氧化的元素是_______ 。
(4)维生素C(分子式为C6H8O6)又名抗坏血酸,可预防坏血病等,也是一种常见的食品添加剂,能够阻止空气中的氧气将食品氧化变质,则维生素C具有_______(填字母)。
(5)NO2是空气污染物,在一定条件下可利用NH3与之反应而除去,反应的化学方程式为6NO2 +8NH3 7N2+12H2O,氧化产物和还原产物的分子个数之比为
7N2+12H2O,氧化产物和还原产物的分子个数之比为_______ 。
(1)天然气的主要成分是甲烷,完全燃烧时发生反应CH4+2O2
 CO2 +2H2O,则反应中的还原剂是
CO2 +2H2O,则反应中的还原剂是(2)“曾青得铁则化为铜”出自西汉淮南王刘安的《淮南万毕术》,是关于湿法炼铜的最早记录。已知曾青为硫酸铜,则反应的离子方程式为
(3)我国自主研制的第五代单座双发隐形战斗机歼—31使用了高强度、耐高温的钛合金材料。工业上冶炼钛的反应为TiCl4+2Mg
 Ti+2MgCl2.反应中被氧化的元素是
Ti+2MgCl2.反应中被氧化的元素是(4)维生素C(分子式为C6H8O6)又名抗坏血酸,可预防坏血病等,也是一种常见的食品添加剂,能够阻止空气中的氧气将食品氧化变质,则维生素C具有_______(填字母)。
| A.酸性 | B.碱性 | C.氧化性 | D.还原性 |
 7N2+12H2O,氧化产物和还原产物的分子个数之比为
7N2+12H2O,氧化产物和还原产物的分子个数之比为
您最近一年使用:0次
9 . 过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入__________ 溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用下图装置来测定过氧化钠的质量分数。
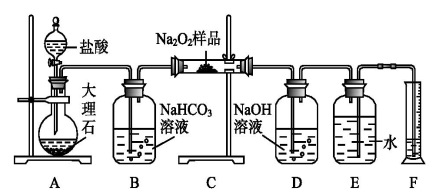
①A中发生反应离子方程式为_____________________ 。
②将仪器连接好以后,必须进行的第一步操作是_____________________ 。
③B装置出来的气体是否需要干燥_________________ 。(填“是”或“否”)
④写出装置C中发生的所有反应的化学方程式_____________ ,______________ 。
⑤D中NaOH溶液的作用_______________________ 。
⑥实验结束时,读取实验中生成气体的体积时,不合理的是_______________ 。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑦读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为__________________ 。
⑧实验完成后E到F之间导管内残留水的体积会使测量结果__________ 。(填“偏大”、“偏小”或“不影响”)
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用下图装置来测定过氧化钠的质量分数。

①A中发生反应离子方程式为
②将仪器连接好以后,必须进行的第一步操作是
③B装置出来的气体是否需要干燥
④写出装置C中发生的所有反应的化学方程式
⑤D中NaOH溶液的作用
⑥实验结束时,读取实验中生成气体的体积时,不合理的是
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑦读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为
⑧实验完成后E到F之间导管内残留水的体积会使测量结果
您最近一年使用:0次
2017-02-17更新
|
2185次组卷
|
22卷引用:【校级联考】安徽省滁州市定远县西片区2018-2019学年高一上学期期中考试化学试题
【校级联考】安徽省滁州市定远县西片区2018-2019学年高一上学期期中考试化学试题云南省通海县三中2019-2020学年高一上学期期中考试化学试题2016-2017陕西西安长安区一中实验班高一12月考化学卷云南省富宁县民族中学2019-2020学年高二上学期开学考试化学试题云南省文山州马关县第一中学2019-2020学年高二上学期9月份考试 化学试题云南省通海县三中2019-2020学年高二9月份(开学考试)化学试题云南省玉溪元江民中2019-2020学年高二开学考试化学试题云南省金平县一中2019-2020学年高二上学期开学考试化学试题云南省玉溪市通海县第二中学2019-2020学年高一上学期12月月考化学试题云南省剑川县第一中学2019-2020学年高一上学期期末考试化学试题云南省绿春县高级中学2019-2020学年高一上学期期末考试化学试题云南省武定民族中学2019-2020学年 高一上学期期末考试化学试题人教版高一化学必修1第三章《金属及其化合物》测试卷云南省丽江市华坪县第一中学2019—2020学年高一上学期期末考试化学试题云南省丽江县第三中学2019—2020学年高一上学期期末考试化学试题云南省昭通市永善县明志高级中学2019—2020学年高一上学期期末考试化学试题云南省昭通市大关县第一中学2019-2020学年高一上学期期末考试化学试题云南省昆明市寻甸县第三中学2019-2020学年高一上学期期末考试化学试题广西隆林县第二中学2019-2020学年高一上学期期末考试化学试题甘肃省白银市会宁县第四中学2021届高三上学期第二次月考化学试题云南省曲靖市第二中学2020-2021学年高一上学期期末考试化学试题云南省迪庆州香格里拉中学2019-2020学年高一上学期期末考试化学试题
名校
10 . 氯化铁是一种常用的试剂。
(1)配制一定物质的量浓度的 溶液时,取一定量
溶液时,取一定量 溶于浓盐酸中,加水稀释至指定的浓度。盐酸的作用是
溶于浓盐酸中,加水稀释至指定的浓度。盐酸的作用是___________ 。
(2)蒸干 溶液并灼烧所得固体,最终得到的物质是
溶液并灼烧所得固体,最终得到的物质是___________ (填化学式)。
(3)测定 样品的纯度(杂质不参与反应)。
样品的纯度(杂质不参与反应)。
方案1:配合滴定法。
文献资料 已知:溶液中 与EDTA以物质的量之比
与EDTA以物质的量之比 形成稳定的配合物,
形成稳定的配合物, ,其溶液颜色为亮黄色。磺基水杨酸溶于水得到无色溶液,在
,其溶液颜色为亮黄色。磺基水杨酸溶于水得到无色溶液,在 时与
时与 形成红色配合物,可用作滴定
形成红色配合物,可用作滴定 的指示剂。
的指示剂。
实验操作:称取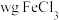 样品溶于盐酸中,稀释成
样品溶于盐酸中,稀释成 溶液,取
溶液,取 配制的溶液于锥形瓶中,滴几滴磺基水杨酸溶液,滴加稀硫酸至
配制的溶液于锥形瓶中,滴几滴磺基水杨酸溶液,滴加稀硫酸至 左右,用
左右,用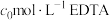 溶液滴定至终点,消耗EDTA溶液V mL。
溶液滴定至终点,消耗EDTA溶液V mL。
①部分滴定操作如下:
A.用待装液润洗滴定管
B.检查滴定管是否漏水
C.加入反应液并排气
D.终点时读数
正确的先后排序为___________ (填字母)。
②达到滴定终点的标志是___________ 。该 样品的纯度为
样品的纯度为___________ %(用含 、V、w的代数式表示)。
、V、w的代数式表示)。
方案2:氧化还原滴定法。
滴定原理:在甲基橙指示剂下,用 溶液(过量)还原
溶液(过量)还原 :
: 。过量的
。过量的 被甲基橙消除,同时甲基橙变色,且甲基橙的还原产物不和
被甲基橙消除,同时甲基橙变色,且甲基橙的还原产物不和 反应:
反应: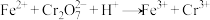 (未配平)。
(未配平)。
实验操作:称取一定量 样品溶于稀盐酸中,滴加几滴甲基橙,滴加
样品溶于稀盐酸中,滴加几滴甲基橙,滴加 溶液至甲基橙变色。用
溶液至甲基橙变色。用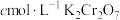 溶液继续滴定至终点,消耗滴定液x mL(在该条件下,滴定剂不氧化氯离子和甲基橙等)。
溶液继续滴定至终点,消耗滴定液x mL(在该条件下,滴定剂不氧化氯离子和甲基橙等)。
③应选择___________ 式滴定管盛放 溶液(填“酸”或“碱”)。
溶液(填“酸”或“碱”)。
④上述氯化铁样品中含___________ 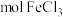 (用含c、x的代数式表示)。
(用含c、x的代数式表示)。
⑤若其他操作均正确,滴定管起始时仰视读数,终点时俯视读数,则测得结果___________ (填“偏高”“偏低”或“无影响”)。
(1)配制一定物质的量浓度的
 溶液时,取一定量
溶液时,取一定量 溶于浓盐酸中,加水稀释至指定的浓度。盐酸的作用是
溶于浓盐酸中,加水稀释至指定的浓度。盐酸的作用是(2)蒸干
 溶液并灼烧所得固体,最终得到的物质是
溶液并灼烧所得固体,最终得到的物质是(3)测定
 样品的纯度(杂质不参与反应)。
样品的纯度(杂质不参与反应)。方案1:配合滴定法。
文献资料 已知:溶液中
 与EDTA以物质的量之比
与EDTA以物质的量之比 形成稳定的配合物,
形成稳定的配合物, ,其溶液颜色为亮黄色。磺基水杨酸溶于水得到无色溶液,在
,其溶液颜色为亮黄色。磺基水杨酸溶于水得到无色溶液,在 时与
时与 形成红色配合物,可用作滴定
形成红色配合物,可用作滴定 的指示剂。
的指示剂。实验操作:称取
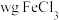 样品溶于盐酸中,稀释成
样品溶于盐酸中,稀释成 溶液,取
溶液,取 配制的溶液于锥形瓶中,滴几滴磺基水杨酸溶液,滴加稀硫酸至
配制的溶液于锥形瓶中,滴几滴磺基水杨酸溶液,滴加稀硫酸至 左右,用
左右,用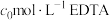 溶液滴定至终点,消耗EDTA溶液V mL。
溶液滴定至终点,消耗EDTA溶液V mL。①部分滴定操作如下:
A.用待装液润洗滴定管
B.检查滴定管是否漏水
C.加入反应液并排气
D.终点时读数
正确的先后排序为
②达到滴定终点的标志是
 样品的纯度为
样品的纯度为 、V、w的代数式表示)。
、V、w的代数式表示)。方案2:氧化还原滴定法。
滴定原理:在甲基橙指示剂下,用
 溶液(过量)还原
溶液(过量)还原 :
: 。过量的
。过量的 被甲基橙消除,同时甲基橙变色,且甲基橙的还原产物不和
被甲基橙消除,同时甲基橙变色,且甲基橙的还原产物不和 反应:
反应: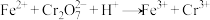 (未配平)。
(未配平)。实验操作:称取一定量
 样品溶于稀盐酸中,滴加几滴甲基橙,滴加
样品溶于稀盐酸中,滴加几滴甲基橙,滴加 溶液至甲基橙变色。用
溶液至甲基橙变色。用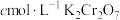 溶液继续滴定至终点,消耗滴定液x mL(在该条件下,滴定剂不氧化氯离子和甲基橙等)。
溶液继续滴定至终点,消耗滴定液x mL(在该条件下,滴定剂不氧化氯离子和甲基橙等)。③应选择
 溶液(填“酸”或“碱”)。
溶液(填“酸”或“碱”)。④上述氯化铁样品中含
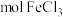 (用含c、x的代数式表示)。
(用含c、x的代数式表示)。⑤若其他操作均正确,滴定管起始时仰视读数,终点时俯视读数,则测得结果
您最近一年使用:0次



