名校
解题方法
1 . 某“84”消毒液部分标签如下图所示、回答下列问题:
(1)写出 变质失效中属于氧化还原反应的方程式
变质失效中属于氧化还原反应的方程式_______ 。
(2)计算该“84”消毒液的物质的量浓度_______  (保留小数点后一位,下同)。
(保留小数点后一位,下同)。
(3)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 )的浓硫酸配制1000
)的浓硫酸配制1000 0.50
0.50 的稀硫酸用于增强“84消毒液”的消毒能力。需用量筒量取浓硫酸的体积为
的稀硫酸用于增强“84消毒液”的消毒能力。需用量筒量取浓硫酸的体积为_______  。
。
(4)某实验用480 2.0
2.0
 的消毒液,现用
的消毒液,现用 固体配制。
固体配制。
a.要用托盘天平称量 的固体质量为
的固体质量为_______ g。
b.配制时。一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤移液 ⑥洗涤 ⑦定容 ⑧冷却。正确的操作顺序为:_______ (填序号)。在配制过程中,除需要烧杯、托盘天平外还必需的仪器有_______ (写两种)。
(5)下列操作可能使配制溶液浓度偏低的是_______ 。
A.移液时,未洗涤烧杯内壁和玻璃棒
B.溶解后未经冷却就移液
C.移液时,有少量液体溅出
D.定容时,俯视刻度线
E.容量瓶用蒸馏水洗净后,没烘干就直接使用
净含量:500 密度:1.19  主要成份:25%  ( ( 的摩尔质量74.5 的摩尔质量74.5 ) )注意事项:密封保存,易吸收空气中的  变质 变质 |
 变质失效中属于氧化还原反应的方程式
变质失效中属于氧化还原反应的方程式(2)计算该“84”消毒液的物质的量浓度
 (保留小数点后一位,下同)。
(保留小数点后一位,下同)。(3)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84
 )的浓硫酸配制1000
)的浓硫酸配制1000 0.50
0.50 的稀硫酸用于增强“84消毒液”的消毒能力。需用量筒量取浓硫酸的体积为
的稀硫酸用于增强“84消毒液”的消毒能力。需用量筒量取浓硫酸的体积为 。
。(4)某实验用480
 2.0
2.0
 的消毒液,现用
的消毒液,现用 固体配制。
固体配制。a.要用托盘天平称量
 的固体质量为
的固体质量为b.配制时。一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤移液 ⑥洗涤 ⑦定容 ⑧冷却。正确的操作顺序为:
(5)下列操作可能使配制溶液浓度偏低的是
A.移液时,未洗涤烧杯内壁和玻璃棒
B.溶解后未经冷却就移液
C.移液时,有少量液体溅出
D.定容时,俯视刻度线
E.容量瓶用蒸馏水洗净后,没烘干就直接使用
您最近一年使用:0次
名校
2 . 化学小组实验探究SO2与新制氢氧化铜悬浊液的反应。
(1)实验一:试剂瓶丙盛有新制纯净的Cu(OH)2悬浊液,制备SO2(夹持、加热仪器略),并向丙中通入足量SO2。开始可观察到丙中局部有浅黄色固体生成,Cu(OH)2全部溶解后得到蓝色溶液A和少量紫红色固体B。
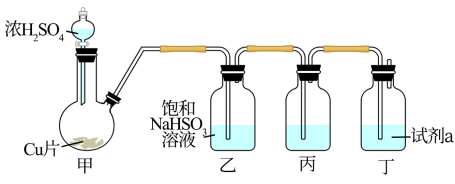
①浓H2SO4与Cu片反应的化学方程式是___ 。
②试剂a为____ 。
(2)分析物质性质,紫红色固体B应为___ 。用pH试纸测定淡绿色溶液A的pH约为3,向该溶液中鼓入足量氮气后溶液变蓝,预测浅黄色固体物质为中间产物Cu2O,写出生成Cu2O的化学反应方程式____ (资料:Cu2O酸性条件下不稳定,Cu2O+2H+=Cu+Cu2++H2O)
(3)为进一步验证SO2与Cu(OH)2悬浊液反应过程中产生Cu(I)。
实验二:向CuCl2溶液中加入NaOH溶液至恰好完全反应,得含NaCl的Cu(OH)2悬浊液,将此悬浊液加入丙中,重复上述实验。开始可观察到局部有浅黄色固体物质生成,Cu(OH)2全部溶解后丙底部有较多的白色沉淀C,上层是淡绿色的溶液A。
(资料:[Cu(NH3)2]+]无色,易被氧化为深蓝色[Cu(NH3)4]2+])
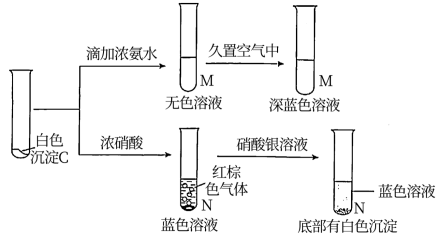
①试管N中加入硝酸银溶液后生成白色沉淀,证明白色沉淀C中含有的阴离子为___ ;试管M中无色溶液的主要成份为____ (写化学式)。
②C与浓硝酸反应的离子方程式为___ 。
(1)实验一:试剂瓶丙盛有新制纯净的Cu(OH)2悬浊液,制备SO2(夹持、加热仪器略),并向丙中通入足量SO2。开始可观察到丙中局部有浅黄色固体生成,Cu(OH)2全部溶解后得到蓝色溶液A和少量紫红色固体B。

①浓H2SO4与Cu片反应的化学方程式是
②试剂a为
(2)分析物质性质,紫红色固体B应为
(3)为进一步验证SO2与Cu(OH)2悬浊液反应过程中产生Cu(I)。
实验二:向CuCl2溶液中加入NaOH溶液至恰好完全反应,得含NaCl的Cu(OH)2悬浊液,将此悬浊液加入丙中,重复上述实验。开始可观察到局部有浅黄色固体物质生成,Cu(OH)2全部溶解后丙底部有较多的白色沉淀C,上层是淡绿色的溶液A。
(资料:[Cu(NH3)2]+]无色,易被氧化为深蓝色[Cu(NH3)4]2+])

①试管N中加入硝酸银溶液后生成白色沉淀,证明白色沉淀C中含有的阴离子为
②C与浓硝酸反应的离子方程式为
您最近一年使用:0次
名校
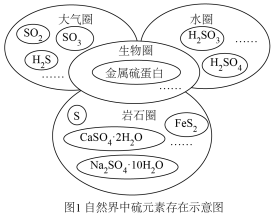
3 . 硫元素广泛存在于自然界中,是动植物生长不可缺少的元素。
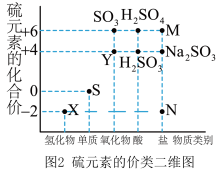
I.图1是自然界中硫元素的存在示意图,图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。___________ 。
(2)工业上常以黄铁矿为原料来制备硫酸,通入空气焙烧黄铁矿的化学方程式为___________ 。
(3) 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是___________ 。
II.小组同学利用图3装置测定空气中 的含量。
的含量。___________ ,该装置中发生反应的离子方程式为___________ 。
(5)若空气流速为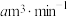 ,当观察到装置内
,当观察到装置内___________ 时,结束计时,测定耗时tmin,假定空气中的 可被溶液充分吸收,该空气样品中
可被溶液充分吸收,该空气样品中 的含量是
的含量是___________  。
。
I.图1是自然界中硫元素的存在示意图,图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。
(2)工业上常以黄铁矿为原料来制备硫酸,通入空气焙烧黄铁矿的化学方程式为
(3)
 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是II.小组同学利用图3装置测定空气中
 的含量。
的含量。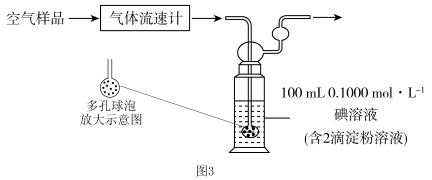
(5)若空气流速为
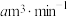 ,当观察到装置内
,当观察到装置内 可被溶液充分吸收,该空气样品中
可被溶液充分吸收,该空气样品中 的含量是
的含量是 。
。
您最近一年使用:0次
4 . 下列实验根据现象能得出相应结论的是
| 选项 | 实验 | 现象 | 结论 |
| A | 向FeI2溶液中滴加少量酸性 KMnO4溶液 | 酸性 KMnO4溶液褪色 | Fe2+具有还原性 |
| B | 在25℃和50℃时,分别测量0.1 mol·L-1Na2CO3溶液的pH | 升高温度,溶液的pH下降 | pH 变化是KW的改变与水解平衡移动共同作用的结果 |
| C | 向盛有2 mL 0.1 mol·L-1 AgNO3溶液的试管中先滴加2滴0.1 mol·L-1 NaCl溶液,再滴加2滴0.1 mol·L-1 NaBr 溶液 | 先生成白色沉淀,后产生淡黄色沉淀 | Ksp(AgBr) <Ksp(AgCl) |
| D | 向久置的Na2SO3样品中加入足量 Ba(NO3) 2溶液,再加入足量稀盐酸 | 出现白色沉淀,沉淀不溶解 | Na2SO3样品完全变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-02更新
|
799次组卷
|
3卷引用:安徽省部分学校2023-2024学年高三下学期3月联考化学试题
安徽省部分学校2023-2024学年高三下学期3月联考化学试题安徽省示范高中皖北协作区2024届高三联考化学试题(已下线)题型6 元素及其化合物 化学实验基础(25题)-2024年高考化学常考点必杀300题(新高考通用)
名校
5 . 根据实验操作和现象,不能得出相应结论的是
A.未知溶液中滴加 溶液出现不溶于硝酸的白色沉淀,说明该溶液中存在 溶液出现不溶于硝酸的白色沉淀,说明该溶液中存在 或 或 |
| B.将FeNO32样品溶于稀硫酸,滴加KSCN溶液变红,不能说明FeNO32样品溶于稀硫酸前已氧化变质 |
C.将充满 的密闭玻璃球没泡在热水中,红色加深,则 的密闭玻璃球没泡在热水中,红色加深,则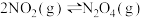 ,△H<0 ,△H<0 |
D.等体积 的 的 和 和 ,分别与足量的 ,分别与足量的 反应, 反应, 放出的氢气多,则酸性: 放出的氢气多,则酸性: |
您最近一年使用:0次
2022-11-03更新
|
202次组卷
|
2卷引用:安徽省宣城中学2023-2024学年高二上学期12月月考化学试题
6 . 过氧化钠常作漂白剂、杀菌剂、消毒剂。能与水和二氧化碳等物质发生反应,保存不当容易变质。某实验小组以过氧化钠为研究对进行了如下实验,
(1)探究过氧化钠样品是否已经变质,取少量样品,溶解,加入__________ 溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该实验小组为了粗略测定过氧化钠的纯度,他们称取mg样品,并设计用如图装置来测定过氧化钠的质量分数。
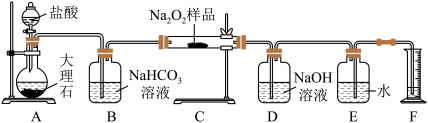
①将仪器连接好以后,必须进行的第一步操作是____________ 。
②D中NaOH溶液的作用____________ 。
③写出装置C中发生的反应的化学方程式____________ 。
④实验结束时,读取实验中生成气体的体积时,你认为合理的是_________ 。
a.读取气体体积,需冷却到室温
b.调整量筒使E. F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑤读出量筒内水的体积后,折算成氧气的质量为a g,则样品中过氧化钠的质量分数为______ 。
(1)探究过氧化钠样品是否已经变质,取少量样品,溶解,加入
(2)该实验小组为了粗略测定过氧化钠的纯度,他们称取mg样品,并设计用如图装置来测定过氧化钠的质量分数。

①将仪器连接好以后,必须进行的第一步操作是
②D中NaOH溶液的作用
③写出装置C中发生的反应的化学方程式
④实验结束时,读取实验中生成气体的体积时,你认为合理的是
a.读取气体体积,需冷却到室温
b.调整量筒使E. F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑤读出量筒内水的体积后,折算成氧气的质量为a g,则样品中过氧化钠的质量分数为
您最近一年使用:0次
名校
解题方法
7 . 下列与化学实验相关的说法正确的是
| A.向Na2O2样品中滴加过量的稀盐酸,将生成的气体通入BaCl2溶液中,无白色沉淀生成,说明样品未变质 |
| B.向2支盛有2 mL不同浓度的Na2SO3溶液的试管中同时加入1 mL2%的H2O2溶液,观察实验现象可得出浓度对反应速率的影响 |
C.向盛有Fe(NO3)2溶液的试管中加入0.1 mol/L的H2SO4溶液,试管口出现红棕色气体,说明NO 被还原成NO 被还原成NO |
| D.用标准HCl溶液滴定NaHCO3溶液来测定其浓度,选择酚酞作指示剂 |
您最近一年使用:0次
8 . 实验室盛放NaOH的试剂瓶瓶口出现了大量的白色蘑菇云状物质。某化学兴趣小组对其成分进行探究,称取一定质量的样品溶于水配成1000mL溶液,取40mL溶液于小烧杯中并加入指示剂1用1.00 mol/L盐酸标准液滴定,第一次达到滴定终点时消耗盐酸的体积V1=1.70mL,加入指示剂2继续滴定,第二次达到滴定终点时又消耗盐酸体积V2=3.40mL。下列说法错误的是

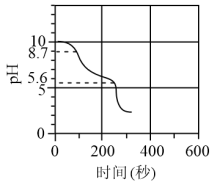


| A.久置NaOH变质后的固体主要成分为Na2CO3和NaHCO3,且物质的量之比为1:1 |
| B.指示剂1可能为酚酞,指示剂2可能为甲基橙 |
| C.原溶液中Na2CO3的浓度为0.0425 mol·L-1 |
D.第一次滴定终点时,溶液存在c(H2CO3)<c(CO ) ) |
您最近一年使用:0次
名校
解题方法
9 . 氯化亚铜(CuCl)是一种见光易分解的白色固体,难溶于水,在潮湿的环境中易被氧气氧化为碱式氯化铜。实验室用SOCl2与CuCl2溶液混合制取CuCl的装置如图所示。
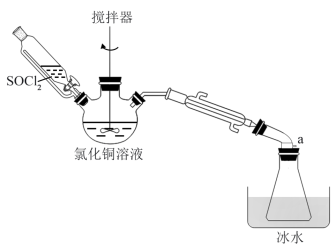
已知:①SOCl2是一种易发烟的液体,遇水剧烈水解生成SO2和HCl气体;
②CuCl在溶液中存在如下平衡:CuCl(s)+3Cl-(aq) [CuCl4]3-(aq)(无色)。
[CuCl4]3-(aq)(无色)。
回答下列问题:
(1)配制CuCl2溶液所需的蒸馏水需要去氧气,最简单的去氧操作是___ ,盛装SOCl2的仪器名称为___ 。
(2)SO2能在溶液中将CuCl2还原为CuCl,反应的离子方程式为___ 。
(3)当三颈烧瓶的溶液由___ 时(填实验现象),则说明反应已经完成,可以停止实验。
(4)实验结束后需要先向三颈烧瓶中加入蒸馏水,然后再进行过滤得到CuCl。加水的作用是___ ,过滤时需要在避光的条件下进行,原因是___ 。
(5)久置在空气中的CuCl可完全变质为碱式氯化铜[xCuCl2·yCu(OH)2,其x、y为整数],为探究该碱式氯化铜的组成,设计如下实验步骤:
①准确称取4.216g样品,溶于足量乙酸中,加蒸馏水配制成100mL溶液;
②取25mL溶液,向其中加入足量的AgNO3溶液,充分反应后过滤、洗涤、干燥,所得白色固体质量为0.574g;
③另取25mL溶液,向其中加入过量的KI溶液,再用0.400mol·L-1的Na2S2O3标准溶液滴定至终点,消耗标准溶液25.00mL。已知滴定过程涉及如下反应:2Cu2++4I-=2CuI↓+I2、2S2O +I2=2I-+S4O
+I2=2I-+S4O 。
。
计算碱式氯化铜中x=___ ;y=___ 。

已知:①SOCl2是一种易发烟的液体,遇水剧烈水解生成SO2和HCl气体;
②CuCl在溶液中存在如下平衡:CuCl(s)+3Cl-(aq)
 [CuCl4]3-(aq)(无色)。
[CuCl4]3-(aq)(无色)。回答下列问题:
(1)配制CuCl2溶液所需的蒸馏水需要去氧气,最简单的去氧操作是
(2)SO2能在溶液中将CuCl2还原为CuCl,反应的离子方程式为
(3)当三颈烧瓶的溶液由
(4)实验结束后需要先向三颈烧瓶中加入蒸馏水,然后再进行过滤得到CuCl。加水的作用是
(5)久置在空气中的CuCl可完全变质为碱式氯化铜[xCuCl2·yCu(OH)2,其x、y为整数],为探究该碱式氯化铜的组成,设计如下实验步骤:
①准确称取4.216g样品,溶于足量乙酸中,加蒸馏水配制成100mL溶液;
②取25mL溶液,向其中加入足量的AgNO3溶液,充分反应后过滤、洗涤、干燥,所得白色固体质量为0.574g;
③另取25mL溶液,向其中加入过量的KI溶液,再用0.400mol·L-1的Na2S2O3标准溶液滴定至终点,消耗标准溶液25.00mL。已知滴定过程涉及如下反应:2Cu2++4I-=2CuI↓+I2、2S2O
 +I2=2I-+S4O
+I2=2I-+S4O 。
。计算碱式氯化铜中x=
您最近一年使用:0次
名校
10 . 对下列实验事实的结论表述正确的是
| 选项 | 实验 | 现象 | 结论 |
| A | 向Na2CO3溶液中加入浓盐酸,将产生的气体直接通入硅酸钠溶液中 | 产生白色浑浊 | 酸性: 盐酸>碳酸>硅酸 |
| B | 将常温下用冷的浓硝酸处理过的铝片插入硫酸铜溶液中 | 铝片表面无明显现象 | 用硝酸处理后,铝的金属性减弱 |
| C | 取少量Na2SO3样品溶于蒸馏水,加入足量稀盐酸,再加入足量BaCl2溶液 | 有白色沉淀产生 | 样品已经变质 |
| D | 向黄色的Fe(NO3)3溶液中滴加氢碘酸,再加入四氯化碳 | 溶液变为紫红色 | 氧化性:Fe3+>I2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-07-13更新
|
230次组卷
|
3卷引用:安徽省舒城中学2021-2022学年高二上学期第一次月考化学试题



