名校
1 . 室温下进行下列实验,根据实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 取久置的 粉末,向其中滴加过量的盐酸,产生无色气体 粉末,向其中滴加过量的盐酸,产生无色气体 |  粉末没有变质 粉末没有变质 |
| B | 将 样品溶于稀硫酸后,滴加KSCN溶液,溶液变红 样品溶于稀硫酸后,滴加KSCN溶液,溶液变红 |  样品已变质 样品已变质 |
| C | 将 气体通入棕黄色 气体通入棕黄色 溶液,溶液变为浅绿色 溶液,溶液变为浅绿色 |  具有还原性 具有还原性 |
| D | 把 和气体X一起通入到 和气体X一起通入到 溶液中,有白色沉淀产生 溶液中,有白色沉淀产生 | X气体具有强氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-03-09更新
|
355次组卷
|
2卷引用:黑龙江省哈尔滨市第三中学校2023-2024学年 高一下学期第一次验收考试化学试题
名校
解题方法
2 . 下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
| 选项 | 实验 | 现象 | 结论 |
| A | 将过量铁粉加入稀硝酸中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化为Fe3+ |
| B | 将铜粉加入1.0mol/LFe2(SO4)3溶液中 | 溶液由黄色变为蓝绿(青)色 | 金属铁比铜活泼 |
| C | 向久置的FeCl2溶液中加入酸性KMnO4溶液 | KMnO4溶液紫色褪去 | FeCl2溶液没有完全被氧化 |
| D | 将少量Na2SO3样品溶于足量稀盐酸中,静置,取上层溶液于试管中,滴加BaCl2溶液 | 产生白色沉淀 | 该Na2SO3样品已经变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-06-19更新
|
361次组卷
|
4卷引用:黑龙江省哈尔滨市第九中学2020-2021学年高二下学期6月月考化学试题
黑龙江省哈尔滨市第九中学2020-2021学年高二下学期6月月考化学试题湖南省衡阳师范学院祁东附属中学2021-2022学年高三上学期12月月考化学试题(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)
名校
解题方法
3 . 乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O}(相对分子质量:288),可由乳酸与FeCO3反应制得,它易溶于水,几乎不溶于乙醇,是一种很好的补铁剂,但其水溶液易被氧化,光照可促进氧化。
I.制备碳酸亚铁:装置如图所示。

(1)仪器C的名称是________ 。
(2)该实验使用生铁比纯铁更好,原因为__________ 。
(3)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是_______ ,然后关闭活塞1,接下来的操作是________ ,此后,C装置溶液中有沉淀生成,并有大量气泡冒出,则C中发生反应的离子方程式为_______ 。装置D的作用是_______ 。
Ⅱ.制备乳酸亚铁。
(4)向纯净的FeCO3固体加入足量乳酸溶液,在75℃下搅拌使之充分反应。该反应的加热方式_________ 。为防止乳酸亚铁变质,在上述体系中还应加入适量_______ 。反应结束后,将所得溶液隔绝空气低温浓缩、_________ 、过滤、洗涤、干燥,得乳酸亚铁晶体。
III.乳酸亚铁晶体纯度的测量。
(5)某同学查阅文献后,用(NH4)4Ce(SO4)4滴定法测定样品中Fe2+的含量并计算样品纯度(反应中Ce4+还原为Ce3+),他称取6.00g样品,配制成250.00mL溶液,取出25.00mL,用浓度为0.10mol·L-1的(NH4)4Ce(SO4)4标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为________ (保留三位有效数字,以质量分数表示)。
I.制备碳酸亚铁:装置如图所示。

(1)仪器C的名称是
(2)该实验使用生铁比纯铁更好,原因为
(3)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是
Ⅱ.制备乳酸亚铁。
(4)向纯净的FeCO3固体加入足量乳酸溶液,在75℃下搅拌使之充分反应。该反应的加热方式
III.乳酸亚铁晶体纯度的测量。
(5)某同学查阅文献后,用(NH4)4Ce(SO4)4滴定法测定样品中Fe2+的含量并计算样品纯度(反应中Ce4+还原为Ce3+),他称取6.00g样品,配制成250.00mL溶液,取出25.00mL,用浓度为0.10mol·L-1的(NH4)4Ce(SO4)4标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为
您最近一年使用:0次
解题方法
4 . 从下列事实所列出的相应结论正确的是
| 序号 | 实验事实 | 结论 |
| ① | SO2使酸性高锰酸钾溶液褪色 | 可证明SO2有漂白性 |
| ② | 用磨口玻璃瓶保存NaOH溶液,硝酸用棕色试剂瓶保存在阴暗处 | 都发生了氧化还原反应 |
| ③ | 取少量Na2SO3样品加入Ba(NO3)2溶液后,产生白色沉淀滴加稀盐酸,沉淀不溶解, | 证明Na2SO3已氧化变质 |
| ④ | 某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,该溶液滴加CaCl2溶液,有白色沉淀生成 | 确定该溶液存在CO32- |
| ⑤ | 某无色溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH4+ |
| A.①② | B.③④⑤ | C.②④ | D.④⑤ |
您最近一年使用:0次
2020-01-20更新
|
42次组卷
|
3卷引用:黑龙江绥化市第七中学校2020-2021学年高一下学期第二次月考化学试题
名校
5 . 根据下列实验操作和实验现象所得到的实验结论正确的是( )
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向亚硫酸钠试样中滴入盐酸酸化的Ba(ClO)2溶液 | 产生白色沉淀 | 试样已氧化变质 |
B | 向氯仿(CHCl3)样品中加入AgNO3溶液 | 有白色沉淀产生 | 样品已变质 |
C | 向待测液中依次滴入氯水和KSCN溶液 | 溶液变为红色 | 待测液中含有Fe2+ |
D | 向NaHCO3溶液中滴加NaAlO2溶液 | 有白色沉淀和气体产生 | AlO2-与HCO3-发生了双水解反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-12-18更新
|
248次组卷
|
2卷引用:黑龙江省鹤岗市第一中学2020届高三12月月考化学试题
名校
6 . 化学小组设计以下实验方案,测定某部分变质为碳酸钠的小苏打样品中NaHCO3的质量分数。
(1)方案一:称取一定质量样品,置于仪器a中用酒精灯加热至恒重,冷却,用托盘天平称量剩余固体质量。重复操作,计算。仪器a的名称是____________ 。
(2)方案二:称取此混合物9.5g,溶于水中,配成100 mL溶液。利用化学反应把HCO3—、CO32—完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中ω(NaHCO3)。
①取配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3—、CO32—完全转化为沉淀,应选用的试剂
是____________ (填字母)。
A CaCl2溶液 B MgSO4溶液 C NaCl溶液 D Ba(OH)2溶液
②过滤,提取沉淀,则过滤操作所需要的玻璃仪器除玻璃棒、烧杯外,还有____________ 。
③将沉淀洗涤,并充分干燥,称量沉淀的质量为19.7g。由此可以计算ω(NaHCO3)=____________ 。
(3)方案三:称取一定质量样品,按如图装置进行实验:
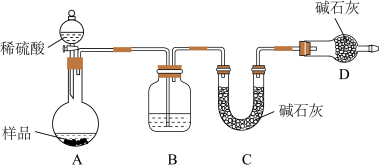
①B装置内所盛试剂是____________ ;
②D装置的作用是________ 。
③某同学认为上述测定结果__________ (填“偏高”或“偏低”),因为实验装置还存在一个明显的缺陷是________________ 。
(1)方案一:称取一定质量样品,置于仪器a中用酒精灯加热至恒重,冷却,用托盘天平称量剩余固体质量。重复操作,计算。仪器a的名称是
(2)方案二:称取此混合物9.5g,溶于水中,配成100 mL溶液。利用化学反应把HCO3—、CO32—完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中ω(NaHCO3)。
①取配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3—、CO32—完全转化为沉淀,应选用的试剂
是
A CaCl2溶液 B MgSO4溶液 C NaCl溶液 D Ba(OH)2溶液
②过滤,提取沉淀,则过滤操作所需要的玻璃仪器除玻璃棒、烧杯外,还有
③将沉淀洗涤,并充分干燥,称量沉淀的质量为19.7g。由此可以计算ω(NaHCO3)=
(3)方案三:称取一定质量样品,按如图装置进行实验:

①B装置内所盛试剂是
②D装置的作用是
③某同学认为上述测定结果
您最近一年使用:0次
2019-12-05更新
|
235次组卷
|
3卷引用:黑龙江省大庆实验中学2019-2020学年高一11月月考化学试题
名校
7 . 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)请设计简单实验检验绿矾是否氧化变质。限选试剂:蒸馏水,KSCN溶液,氯水,KMnO4溶液,铁粉________________________________________________ 。实验室保存绿矾水溶液时为防其氧化要加入 ______ 。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。
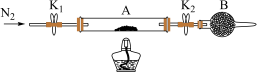
①仪器B的名称是____________________ 。
②将下列实验操作步骤补充完整d-___ ___ -f-___ ___ (填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________ (列式表示)。若实验时按a、d次序操作,则使x__________ (填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
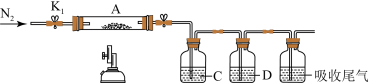
①C、D中的溶液依次为_________ (填标号)。C、D中有气泡冒出,并可观察到的现象分别为____ ,______ 。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_____________________________ 。
(1)请设计简单实验检验绿矾是否氧化变质。限选试剂:蒸馏水,KSCN溶液,氯水,KMnO4溶液,铁粉
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是
②将下列实验操作步骤补充完整d-
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式
您最近一年使用:0次
名校
8 . 由下列实验及现象能推出相应结论的是
| 实验 | 现象 | 结论 | |
| A | 将硝酸亚铁样品溶于稀硫酸,滴加KSCN溶液 | 溶液变为红色 | 硝酸亚铁样品已氧化变质 |
| B | 取等物质的量的两种金属单质X、Y,分别与足量的盐酸反应 | X产生氢气的体积比Y多 | 金属性:X>Y |
| C | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 有白色沉淀生产,苯层呈紫色 | Cu2+有氧化性,白色沉淀可能为CuI |
| D | 向无色溶液中滴入氯化钡溶液和稀硝酸 | 有白色沉淀产生 | 无色溶液中一定含有SO42-或SO32- |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-04-13更新
|
192次组卷
|
2卷引用:【全国百强校】黑龙江省大庆实验中学2018-2019学年高一下学期第一次月考化学试题
名校
9 . 乳酸亚铁晶体([CH3CH(OH)COO]2Fe·3H2O,Mr=288) 可由乳酸与FeCO3反应制得,它易溶于水,是一种很好的补铁剂。
Ⅰ.制备碳酸亚铁(装置如图所示)
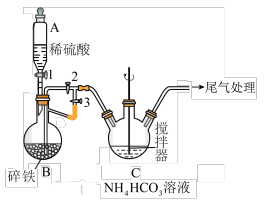
(1)仪器A的名称是______________ ;
(2)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是___________________________________________________________ ;然后关闭活塞1,接下来的操作是_______________ ; 装置C中发生反应的离子方程式为______________ 。
Ⅱ.制备乳酸亚铁
向纯净的FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应。
(3)为防止乳酸亚铁变质,在上述体系中还应加入____________________________________________________________________________
(4)为证明乳酸亚铁中含有Fe2+,选择的检验试剂为_______________________________________________________________________ ;
Ⅲ. 乳酸亚铁晶体纯度的测量
经过过滤、隔绝空气低温蒸发、冷却结晶、过滤、洗涤、干燥等操作,获得乳酸亚铁晶体后
(5)两位同学分别用不同的方案进行测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度,所得纯度总是大于100%,其原因可能是_________________________________________________________________________________________________________________
②乙同学经查阅文献后改用(NH4)4Ce(SO4)4滴定法测定样品中Fe2+的含量计算样品纯度(反应中Ce4+被还原为Ce3+),称取6.00g样品配成250.00mL溶液,取25mL,用0.1 mol•L—1(NH4)4Ce(SO4)4标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为_______________________________________ 。
Ⅰ.制备碳酸亚铁(装置如图所示)

(1)仪器A的名称是
(2)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是
Ⅱ.制备乳酸亚铁
向纯净的FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应。
(3)为防止乳酸亚铁变质,在上述体系中还应加入
(4)为证明乳酸亚铁中含有Fe2+,选择的检验试剂为
Ⅲ. 乳酸亚铁晶体纯度的测量
经过过滤、隔绝空气低温蒸发、冷却结晶、过滤、洗涤、干燥等操作,获得乳酸亚铁晶体后
(5)两位同学分别用不同的方案进行测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度,所得纯度总是大于100%,其原因可能是
②乙同学经查阅文献后改用(NH4)4Ce(SO4)4滴定法测定样品中Fe2+的含量计算样品纯度(反应中Ce4+被还原为Ce3+),称取6.00g样品配成250.00mL溶液,取25mL,用0.1 mol•L—1(NH4)4Ce(SO4)4标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为
您最近一年使用:0次
2019-03-07更新
|
791次组卷
|
3卷引用:黑龙江省大庆实验中学2020届高三5月综合训练(一)理综化学试题
黑龙江省大庆实验中学2020届高三5月综合训练(一)理综化学试题【校级联考】江西省南康中学、于都中学2019届高三下学期第二次联考化学试题(已下线)《2019年高考总复习巅峰冲刺》专题10 化学实验基础应试策略
名校
10 . 下列实验操作、实验现象和实验结论均正确的是
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 将少量浓硝酸分多次加入Cu和稀硫酸的混合物中 | 产生红棕色气体 | 硝酸的还原产物为NO2 |
| B | 将少量Fe(NO3)2试样加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液 | 溶液变成血红色 | Fe(NO3)2试样无法确定是否变质 |
| C | 2滴0.1mol·L-1 MgCl2溶液中滴加2ml 1mol·L-1 NaOH溶液,再滴加2滴0.1 mol·L-1 FeCl3溶液 | 先生成白色沉淀,后生成红褐色沉淀 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| D | 将溴乙烷和NaOH乙醇溶液混合加热,产生的气体通入酸性KMnO4溶液 | 酸性KMnO4溶液褪色 | 产生了乙烯 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-06-29更新
|
213次组卷
|
3卷引用:黑龙江省哈尔滨市第六中学2020-2021学年高二6月月考化学试题



