解题方法
1 . 铁酸锌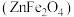 是一种性能优良的软磁材料,可作烯类有机化合物氧化脱氢的催化剂。实验室制备铁酸锌可采用如下步骤:
是一种性能优良的软磁材料,可作烯类有机化合物氧化脱氢的催化剂。实验室制备铁酸锌可采用如下步骤:
Ⅰ.制备前驱物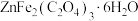
①分别配制 溶液和
溶液和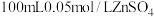 溶液,并将二者混合备用。
溶液,并将二者混合备用。
②另外称取 溶于
溶于 蒸馏水中。
蒸馏水中。
③将①和②所得溶液混合加热到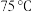 ,并在
,并在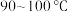 加热搅拌
加热搅拌 ;待溶液冷却后进行减压过滤、洗涤,干燥,得到前驱物。
;待溶液冷却后进行减压过滤、洗涤,干燥,得到前驱物。
Ⅱ.制备铁酸锌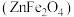
将步骤Ⅰ所得前驱物在 灼烧
灼烧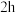 ,冷却后称量质量为
,冷却后称量质量为 ,计算产率。
,计算产率。
回答下列问题:
(1)步骤Ⅰ中配制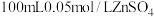 溶液需要的玻璃仪器有烧杯、量筒、胶头滴管、
溶液需要的玻璃仪器有烧杯、量筒、胶头滴管、 容量瓶和
容量瓶和___________ 。下列关于容量瓶的操作,正确的是___________ (填标号)。 晶体,加水溶解,滴加
晶体,加水溶解,滴加___________ (填写试剂名称),无明显现象,由此可知样品___________ (填“已”或“未”)变质。
(3)步骤Ⅰ中检验沉淀是否洗涤干净的操作是___________ 。
(4)步骤Ⅱ中“灼烧”发生的反应属于分解反应,其化学方程式为___________ 。
(5)该实验的总产率为___________ 。
(6)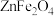 晶体的一种晶胞结构如图所示,晶胞可看成由A、B单元按C方式交替排布构成,“○”表示
晶体的一种晶胞结构如图所示,晶胞可看成由A、B单元按C方式交替排布构成,“○”表示 。则“●”表示的微粒是
。则“●”表示的微粒是___________ (填符号),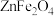 晶体的密度为
晶体的密度为___________  (已知晶胞参数为
(已知晶胞参数为 ,列出计算式)。
,列出计算式)。
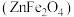 是一种性能优良的软磁材料,可作烯类有机化合物氧化脱氢的催化剂。实验室制备铁酸锌可采用如下步骤:
是一种性能优良的软磁材料,可作烯类有机化合物氧化脱氢的催化剂。实验室制备铁酸锌可采用如下步骤:Ⅰ.制备前驱物
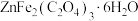
①分别配制
 溶液和
溶液和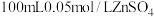 溶液,并将二者混合备用。
溶液,并将二者混合备用。②另外称取
 溶于
溶于 蒸馏水中。
蒸馏水中。③将①和②所得溶液混合加热到
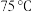 ,并在
,并在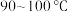 加热搅拌
加热搅拌 ;待溶液冷却后进行减压过滤、洗涤,干燥,得到前驱物。
;待溶液冷却后进行减压过滤、洗涤,干燥,得到前驱物。Ⅱ.制备铁酸锌
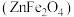
将步骤Ⅰ所得前驱物在
 灼烧
灼烧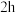 ,冷却后称量质量为
,冷却后称量质量为 ,计算产率。
,计算产率。回答下列问题:
(1)步骤Ⅰ中配制
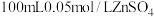 溶液需要的玻璃仪器有烧杯、量筒、胶头滴管、
溶液需要的玻璃仪器有烧杯、量筒、胶头滴管、 容量瓶和
容量瓶和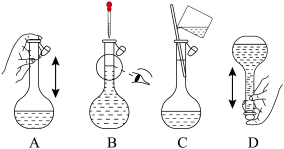
 晶体,加水溶解,滴加
晶体,加水溶解,滴加(3)步骤Ⅰ中检验沉淀是否洗涤干净的操作是
(4)步骤Ⅱ中“灼烧”发生的反应属于分解反应,其化学方程式为
(5)该实验的总产率为
(6)
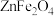 晶体的一种晶胞结构如图所示,晶胞可看成由A、B单元按C方式交替排布构成,“○”表示
晶体的一种晶胞结构如图所示,晶胞可看成由A、B单元按C方式交替排布构成,“○”表示 。则“●”表示的微粒是
。则“●”表示的微粒是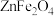 晶体的密度为
晶体的密度为 (已知晶胞参数为
(已知晶胞参数为 ,列出计算式)。
,列出计算式)。
您最近一年使用:0次
2 . 焦亚硫酸钠( )可用作食品添加剂,其实验室制备的装置如下图所示。回答下列问题:
)可用作食品添加剂,其实验室制备的装置如下图所示。回答下列问题:___________ ,其作用为___________ 。
(2)圆底烧瓶中发生反应的化学方程式为___________ 。
(3)焦亚硫酸钠易被氧化而变质,选用下列试剂设计实验方案,检验焦亚硫酸钠样品氧化变质的程度。
试剂:稀盐酸、稀 、稀
、稀 、
、 溶液、酸性
溶液、酸性 溶液、
溶液、 溶液
溶液
(4)某小组利用下列装置测定空气中 的含量。
的含量。___________ (填A或B)连接到导管末端。
②已知:该反应的化学方程式为: ,若空气流速为
,若空气流速为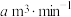 ,当观察到
,当观察到___________ 时,结束计时,测定耗时t min,假定样品中的 可被溶液充分吸收,该空气样品中
可被溶液充分吸收,该空气样品中 的含量是
的含量是___________ 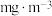 。
。
 )可用作食品添加剂,其实验室制备的装置如下图所示。回答下列问题:
)可用作食品添加剂,其实验室制备的装置如下图所示。回答下列问题: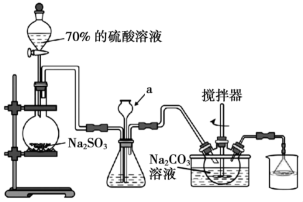
(2)圆底烧瓶中发生反应的化学方程式为
(3)焦亚硫酸钠易被氧化而变质,选用下列试剂设计实验方案,检验焦亚硫酸钠样品氧化变质的程度。
试剂:稀盐酸、稀
 、稀
、稀 、
、 溶液、酸性
溶液、酸性 溶液、
溶液、 溶液
溶液| 实验编号 | 实验步骤 | 现象 | 结论 |
| Ⅰ | 取少量样品,加入除氧蒸馏水,溶解完后平均分装到两支相同的小试管中 | 固体完全溶解得到无色溶液 | / |
| Ⅱ | 取实验I的溶液, | 出现白色沉淀 | 样品已氧化变质 |
| Ⅲ | 另取实验Ⅰ的溶液,加入酸性 溶液,充分振荡 溶液,充分振荡 | 溶液褪色 | 样品未完全氧化变质 |
 的含量。
的含量。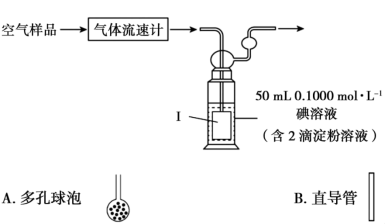
②已知:该反应的化学方程式为:
 ,若空气流速为
,若空气流速为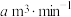 ,当观察到
,当观察到 可被溶液充分吸收,该空气样品中
可被溶液充分吸收,该空气样品中 的含量是
的含量是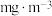 。
。
您最近一年使用:0次
3 . 下列实验设计能达到相应实验目的的是
| 选项 | 实验目的 | 实验方法或操作 |
| A | 探究亚硫酸钠已氧化变质 | 将样品溶于水,先加入 溶液,再加入稀盐酸,有白色沉淀产生 溶液,再加入稀盐酸,有白色沉淀产生 |
| B | 检验溴乙烷中含有溴元素 | 向溴乙烷中加入 溶液共热,冷却后滴加稀 溶液共热,冷却后滴加稀 酸化,再加入 酸化,再加入 溶液,有浅黄色沉淀产生 溶液,有浅黄色沉淀产生 |
| C | 验证淀粉已完全水解 | 向淀粉溶液中滴加稀硫酸,水浴加热一段时间后,再加入新制 悬浊液中,加热,产生砖红色沉淀 悬浊液中,加热,产生砖红色沉淀 |
| D | 证明压强影响平衡移动 | 对 反应容器压缩容积,混合气体的颜色变深 反应容器压缩容积,混合气体的颜色变深 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 植物缺铁是缺亚铁离子。如果施用硫酸亚铁,亚铁离子容易被氧化,一般采用施用摩尔盐 (
(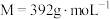 )。摩尔盐是浅蓝绿色晶体,溶于水,但在水中溶解度比硫酸亚铁和硫酸铵都要小,几乎不溶于乙醇,在空气中比硫酸亚铁稳定。以下是摩尔盐的制备步骤。
)。摩尔盐是浅蓝绿色晶体,溶于水,但在水中溶解度比硫酸亚铁和硫酸铵都要小,几乎不溶于乙醇,在空气中比硫酸亚铁稳定。以下是摩尔盐的制备步骤。
Ⅰ.把30% 溶液和废铁屑混合、煮沸、冷却,将洗涤铁屑后的
溶液和废铁屑混合、煮沸、冷却,将洗涤铁屑后的 溶液装入右边广口瓶中。
溶液装入右边广口瓶中。
Ⅱ.在锥形瓶中用处理过的铁屑和稀 反应制取
反应制取 。
。
Ⅲ.将硫酸亚铁溶液与硫酸铵溶液混合,结晶,过滤,用乙醇洗涤后再低温烘干,得到摩尔盐。
(1)装硫酸的仪器的名称是___________ 。
(2)用 溶液洗涤废铁屑的目的是
溶液洗涤废铁屑的目的是___________ 。
(3)Fe屑和稀 反应产生的氢气可赶走装置中的氧气及
反应产生的氢气可赶走装置中的氧气及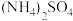 溶液中的溶解氧,操作时应先关闭活塞
溶液中的溶解氧,操作时应先关闭活塞___________ (填A、B或C,下同),并同时打开活塞___________ 。
(4)摩尔盐中铵离子检验方法是___________ 。
(5)步骤Ⅲ过滤后用乙醇洗涤后再低温烘干。用乙醇洗涤的原因是___________ 。
(6)取10.00g所制得的固体于小烧杯中,加入适量稀硫酸,溶解后在 容量瓶中定容。取定容后溶液
容量瓶中定容。取定容后溶液 于锥形瓶中,用
于锥形瓶中,用 的
的 溶液滴定至终点。平行操作三次,消耗
溶液滴定至终点。平行操作三次,消耗 溶液的体积分别为
溶液的体积分别为 、
、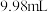 、
、 。此样品中
。此样品中 含量最接近
含量最接近___________ 。
A.11% B.12% C.13% D.14%
导致该测定结果比理论值偏低的可能原因是___________ 。
A.配摩尔盐溶液定容时俯视刻度线 B.取摩尔盐溶液的滴定管没有润洗
C.滴定用的锥形瓶洗净后未干燥 D.高锰酸钾部分变质
(7)将摩尔盐隔绝空气加热到773K时会分解,分解产物有氧化铁、硫的氧化物、氨气和水。写出该反应的化学方程式___________ 。
 (
(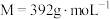 )。摩尔盐是浅蓝绿色晶体,溶于水,但在水中溶解度比硫酸亚铁和硫酸铵都要小,几乎不溶于乙醇,在空气中比硫酸亚铁稳定。以下是摩尔盐的制备步骤。
)。摩尔盐是浅蓝绿色晶体,溶于水,但在水中溶解度比硫酸亚铁和硫酸铵都要小,几乎不溶于乙醇,在空气中比硫酸亚铁稳定。以下是摩尔盐的制备步骤。Ⅰ.把30%
 溶液和废铁屑混合、煮沸、冷却,将洗涤铁屑后的
溶液和废铁屑混合、煮沸、冷却,将洗涤铁屑后的 溶液装入右边广口瓶中。
溶液装入右边广口瓶中。Ⅱ.在锥形瓶中用处理过的铁屑和稀
 反应制取
反应制取 。
。Ⅲ.将硫酸亚铁溶液与硫酸铵溶液混合,结晶,过滤,用乙醇洗涤后再低温烘干,得到摩尔盐。

(1)装硫酸的仪器的名称是
(2)用
 溶液洗涤废铁屑的目的是
溶液洗涤废铁屑的目的是(3)Fe屑和稀
 反应产生的氢气可赶走装置中的氧气及
反应产生的氢气可赶走装置中的氧气及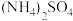 溶液中的溶解氧,操作时应先关闭活塞
溶液中的溶解氧,操作时应先关闭活塞(4)摩尔盐中铵离子检验方法是
(5)步骤Ⅲ过滤后用乙醇洗涤后再低温烘干。用乙醇洗涤的原因是
(6)取10.00g所制得的固体于小烧杯中,加入适量稀硫酸,溶解后在
 容量瓶中定容。取定容后溶液
容量瓶中定容。取定容后溶液 于锥形瓶中,用
于锥形瓶中,用 的
的 溶液滴定至终点。平行操作三次,消耗
溶液滴定至终点。平行操作三次,消耗 溶液的体积分别为
溶液的体积分别为 、
、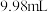 、
、 。此样品中
。此样品中 含量最接近
含量最接近A.11% B.12% C.13% D.14%
导致该测定结果比理论值偏低的可能原因是
A.配摩尔盐溶液定容时俯视刻度线 B.取摩尔盐溶液的滴定管没有润洗
C.滴定用的锥形瓶洗净后未干燥 D.高锰酸钾部分变质
(7)将摩尔盐隔绝空气加热到773K时会分解,分解产物有氧化铁、硫的氧化物、氨气和水。写出该反应的化学方程式
您最近一年使用:0次
2024-04-01更新
|
185次组卷
|
2卷引用:安徽省池州市2024届高三教学质量统一监测(二模)化学试题
5 . 下列实验根据现象能得出相应结论的是
| 选项 | 实验 | 现象 | 结论 |
| A | 向FeI2溶液中滴加少量酸性 KMnO4溶液 | 酸性 KMnO4溶液褪色 | Fe2+具有还原性 |
| B | 在25℃和50℃时,分别测量0.1 mol·L-1Na2CO3溶液的pH | 升高温度,溶液的pH下降 | pH 变化是KW的改变与水解平衡移动共同作用的结果 |
| C | 向盛有2 mL 0.1 mol·L-1 AgNO3溶液的试管中先滴加2滴0.1 mol·L-1 NaCl溶液,再滴加2滴0.1 mol·L-1 NaBr 溶液 | 先生成白色沉淀,后产生淡黄色沉淀 | Ksp(AgBr) <Ksp(AgCl) |
| D | 向久置的Na2SO3样品中加入足量 Ba(NO3) 2溶液,再加入足量稀盐酸 | 出现白色沉淀,沉淀不溶解 | Na2SO3样品完全变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-02更新
|
806次组卷
|
3卷引用:安徽省示范高中皖北协作区2024届高三联考化学试题
安徽省示范高中皖北协作区2024届高三联考化学试题安徽省部分学校2023-2024学年高三下学期3月联考化学试题(已下线)题型6 元素及其化合物 化学实验基础(25题)-2024年高考化学常考点必杀300题(新高考通用)
名校
解题方法
6 . 氧钒(IV)碱式碳酸铵化学式为(NH4)5[(VO)6(CO3)4(OH)9]•10H2O,它是制备热敏材料VO2的原料,已知VO2+在酸性条件下易被氧化,氧钒(IV)碱式碳酸铵的制备流程如图:
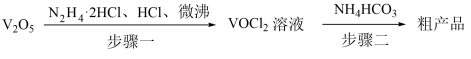
回答下列问题:
(1)步骤一盐酸不宜过量,原因可能_______ ;生成VOCl2的同时,还生成一种无色无污染的气体,该反应的化学方程式为_______ 。
(2)步骤二可在如图装置中进行。

①接口的连接顺序为a→_______ 。
②实验开始时,先关闭K2,打开K1,当_______ 时(写实验现象),再关闭K1,打开K2,充分反应,静置,得到固体。
(3)测定产品纯度
称取mg样品用稀硫酸溶解后,加入50.0mL0.02mol•L-1KMnO4溶液,VO2+转化成VO ,向反应后溶液中滴加0.025mol•L-1Na2SO3标准液,至剩余的KMnO4溶液恰好反应完全,消耗Na2SO3标准液40.00mL。
,向反应后溶液中滴加0.025mol•L-1Na2SO3标准液,至剩余的KMnO4溶液恰好反应完全,消耗Na2SO3标准液40.00mL。
①滴定至反应终点的现象为_______ ;
②样品中氧钒(IV)碱式碳酸铵(摩尔质量为Mg•mol-1)的质量分数为_______ %;
③下列情况会导致产品纯度偏大的是_______ (填标号)。
A.Na2SO3溶液部分变质
B.滴定达终点时,俯视刻度线读数
C.用标准液润洗滴定管后,液体从上口倒出
D.滴定达终点时,发现滴定管尖嘴内有气泡生成
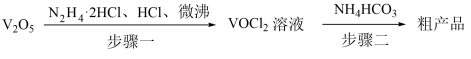
回答下列问题:
(1)步骤一盐酸不宜过量,原因可能
(2)步骤二可在如图装置中进行。

①接口的连接顺序为a→
②实验开始时,先关闭K2,打开K1,当
(3)测定产品纯度
称取mg样品用稀硫酸溶解后,加入50.0mL0.02mol•L-1KMnO4溶液,VO2+转化成VO
 ,向反应后溶液中滴加0.025mol•L-1Na2SO3标准液,至剩余的KMnO4溶液恰好反应完全,消耗Na2SO3标准液40.00mL。
,向反应后溶液中滴加0.025mol•L-1Na2SO3标准液,至剩余的KMnO4溶液恰好反应完全,消耗Na2SO3标准液40.00mL。①滴定至反应终点的现象为
②样品中氧钒(IV)碱式碳酸铵(摩尔质量为Mg•mol-1)的质量分数为
③下列情况会导致产品纯度偏大的是
A.Na2SO3溶液部分变质
B.滴定达终点时,俯视刻度线读数
C.用标准液润洗滴定管后,液体从上口倒出
D.滴定达终点时,发现滴定管尖嘴内有气泡生成
您最近一年使用:0次
2023-06-18更新
|
375次组卷
|
3卷引用:安徽省合肥一六八中学2023届高三下学期最后一卷理科综合化学试题
7 . 矾是一类含硫化合物,在生活和生产中有着重要应用。
(1)蓝矾(CuSO4•5H2O)属于的物质类别有___ (填序号)。
a.混合物 b.电解质 c.氧化物 d.离子化合物
(2)绿矾(FeSO4•7H2O)溶于水后水溶液显__ 性,绿矾水溶液在空气中久置出现红褐色沉淀,写出相关的离子方程式___ ,绿矾水溶液保存时防止变质可加入试剂为___ (填化学式)。
(3)黄矾[FexSyO9•zH2O]中Fe、S的化合价分别为+3、+6。y=2时,x=__ ,采用热重分析法测定该黄矾样品所含结晶水数,将样品加热到110℃时,只失掉2个结晶水,失重7.2%,黄矾的化学式为___ 。
(1)蓝矾(CuSO4•5H2O)属于的物质类别有
a.混合物 b.电解质 c.氧化物 d.离子化合物
(2)绿矾(FeSO4•7H2O)溶于水后水溶液显
(3)黄矾[FexSyO9•zH2O]中Fe、S的化合价分别为+3、+6。y=2时,x=
您最近一年使用:0次
解题方法
8 . 下列实验操作、实验现象和实验结论均正确的是( )
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 常温下,向含溶解足量NH3的饱和食盐水中通入过量CO2 | 析出白色固体 | 溶解性:NaHCO3<NH4Cl |
B | 将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液 | 溶液不变红 | Fe(NO3)2样品没有变质 |
C | 室温下,用pH试纸分别测定等物质的量浓度的 NaClO溶液和CH3COONa溶液的pH | NaClO溶液对应的pH试纸蓝色更深 | 酸性:HClO< CH3COOH |
D | 向2mL0.1mol·L–1AgNO3溶液中滴加1~2滴NaCl溶液,再滴加2滴Na2S溶液 | 开始有白色沉淀生成,后有黑色沉淀生成 | Ksp(Ag2S)<Ksp(AgCl) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
9 . 氨基甲酸铵(NH2COONH4)是一种易分解、易水解的白色固体、难溶于CCl4。实验室可将干燥二氧化碳和氨气通入CCl4中进行制备,反应原理为2NH3(g)+CO2(g)=NH2COONH4(s) △H<0,回答下列问题:
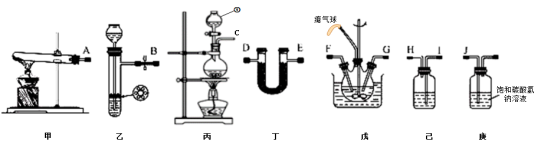
(1)仪器①的名称为_____ ,装置己中盛放的试剂为_____ 。
(2)简述检验装置乙气密性的操作_____ 。
(3)氨气的发生装置可以选择上图中的_____ ,制取氨气的化学方程式为_____ 。
(4)预制备产品,选择上图中必要的装置,其连接顺序为:发生装置→_____ →FG←_____ ←KJ←_____ (按气流方向,用大写字母表示)。
(5)为了提高氨基甲酸铵的产率.对三颈瓶采取的控温方法是_____ ,反应结束后,从反应后的混合物中分离出产品的实验操作是_____ ,戊中气球的作用是_____ 。
(6)氨基甲酸铵容易变质生成碳酸氢铵,现取长期存放的样品19.550g,用足量石灰水处理后,使样品中碳元素完全转化为碳酸钙,通过系列操作得纯净碳酸钙25.000g,则该样品的纯度为_____ %。(计算结果保留三位有效数字;有关物质的相对式量:氨基甲酸铵78、碳酸氢铵79、碳酸钙100) 。

(1)仪器①的名称为
(2)简述检验装置乙气密性的操作
(3)氨气的发生装置可以选择上图中的
(4)预制备产品,选择上图中必要的装置,其连接顺序为:发生装置→
(5)为了提高氨基甲酸铵的产率.对三颈瓶采取的控温方法是
(6)氨基甲酸铵容易变质生成碳酸氢铵,现取长期存放的样品19.550g,用足量石灰水处理后,使样品中碳元素完全转化为碳酸钙,通过系列操作得纯净碳酸钙25.000g,则该样品的纯度为
您最近一年使用:0次
10 . 下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 蘸有浓氨水的玻璃棒靠近溶液X | 有白烟产生 | 溶液X是浓盐酸 |
| B | 用玻璃棒蘸取溶液Y进行焰色反应实验 | 火焰呈黄色 | 溶液Y中含Na+ |
| C | 用煮沸过的蒸馏水将Na2SO3固体样品溶解,加稀盐酸酸化,再加入氯化钡溶液 | 有白色沉淀产生 | Na2SO3样品已变质 |
| D | 向Fe(NO3)2溶液中滴加硫酸酸化的H2O2溶液 | 溶液变黄 | 氧化性:H2O2:>Fe3+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2017-10-11更新
|
171次组卷
|
2卷引用:安徽省滁州市2018届高三9月联合质量检测化学试题



