解题方法
1 . 下列实验操作、现象和结论都正确的是
| 实验操作 | 现象和结论 | |
| A | 向分别盛有苯和甲苯的两支试管中滴入少量酸性高锰酸钾溶液,振荡并观察现象 | 盛有苯的试管中溶液无明显现象,而盛有甲苯的试管中溶液紫红色褪去,则甲苯中的甲基对苯环有影响 |
| B | 取二氧化硅与少量焦炭,在高温条件下反应 | 产生灰黑色固体硅单质,则非金属性: |
| C | 加热2mL0.5mol/L CuCl2溶液 | 溶液由蓝色变为绿色,[Cu(H2O)4]2++4Cl- [CuCl4]2-+4H2O正向移动 [CuCl4]2-+4H2O正向移动 |
| D | 取少量硫代硫酸钠样品溶于水,滴加过量稀盐酸,再滴加Ba(NO3)2溶液 | 有沉淀生成,则硫代硫酸钠变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . 由下列实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向某溶液中加入适量 溶液,产生白色沉淀;将该白色沉淀加入到足量稀盐酸中,产生能使品红溶液褪色的气体 溶液,产生白色沉淀;将该白色沉淀加入到足量稀盐酸中,产生能使品红溶液褪色的气体 | 原溶液中一定含有大量的 |
| B | 向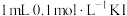 溶液中加入 溶液中加入 溶液,充分反应后,用 溶液,充分反应后,用 萃取分液, 萃取分液, 层呈紫红色;向水层中滴加KSCN溶液,溶液呈红色 层呈紫红色;向水层中滴加KSCN溶液,溶液呈红色 |  与 与 的反应是可逆反应 的反应是可逆反应 |
| C | 向蔗糖溶液中加入少量稀硫酸,水浴加热5min,加氢氧化钠溶液至溶液呈碱性,再加入少量新制的 ;继续加热5min,生成砖红色沉淀 ;继续加热5min,生成砖红色沉淀 | 蔗糖完全水解 |
| D | 取少量实验室保存的 固体溶于蒸馏水,加入过量稀盐酸,再加入 固体溶于蒸馏水,加入过量稀盐酸,再加入 溶液,有白色沉淀产生 溶液,有白色沉淀产生 |  固体样品已经变质 固体样品已经变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-03-10更新
|
521次组卷
|
2卷引用:湖南省名校联盟2023届高三下学期3月调研考试化学试题
名校
解题方法
3 .  和焦亚硫酸钠
和焦亚硫酸钠 可用作食品添加剂。回答下列问题:
可用作食品添加剂。回答下列问题:
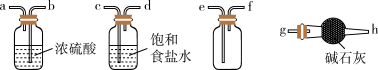
(1)实验室用 和
和 制取
制取 的化学方程式为
的化学方程式为_______ 。欲净化与收集 ,选择必要装置,按气流方向连接顺序为
,选择必要装置,按气流方向连接顺序为_______ (填仪器接口的字母编号)。
(2)①焦亚硫酸钠易被氧化而变质,选用下列试剂设计实验方案,检验焦亚硫酸钠样品氧化变质的程度。已知: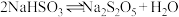 。
。
试剂:稀盐酸、稀 、稀
、稀 、
、 溶液、酸性
溶液、酸性 溶液、
溶液、 溶液
溶液
② 是常用的食品添加剂,常用于葡萄酒、果脯、拉面等食品中。为检验某白葡萄酒中是否含有
是常用的食品添加剂,常用于葡萄酒、果脯、拉面等食品中。为检验某白葡萄酒中是否含有 能否用酸性
能否用酸性 溶液检验?作出判断并说明理由
溶液检验?作出判断并说明理由_______ 。
(3)某小组利用下列装置测定空气中 的含量。
的含量。
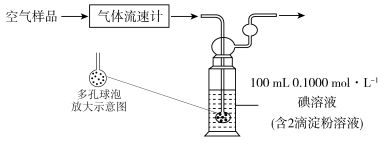
通空气样品的导管末端是带许多小孔的玻璃球泡,其主要作用是_______ ;该装置中发生的离子方程式为:_______ 。若空气流速为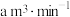 ,当观察到
,当观察到_______ 时,结束计时,测定耗时t min。假定样品中的 可被溶液充分吸收,该空气样品中
可被溶液充分吸收,该空气样品中 的含量是
的含量是_______ 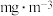 。
。
 和焦亚硫酸钠
和焦亚硫酸钠 可用作食品添加剂。回答下列问题:
可用作食品添加剂。回答下列问题:(1)实验室用
 和
和 制取
制取 的化学方程式为
的化学方程式为 ,选择必要装置,按气流方向连接顺序为
,选择必要装置,按气流方向连接顺序为
(2)①焦亚硫酸钠易被氧化而变质,选用下列试剂设计实验方案,检验焦亚硫酸钠样品氧化变质的程度。已知:
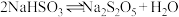 。
。试剂:稀盐酸、稀
 、稀
、稀 、
、 溶液、酸性
溶液、酸性 溶液、
溶液、 溶液
溶液| 实验编号 | 实验步骤 | 现象 | 结论 |
| Ⅰ | 取少量样品,加入除氧蒸馏水 | 固体完全溶解得到无色溶液 | / |
| Ⅱ | 取实验Ⅰ的溶液, | 样品已氧化变质 | |
| Ⅲ | 另取实验Ⅰ的溶液,加入酸性KMnO4溶液 | 溶液褪色 | 样品未完全氧化变质 |
 是常用的食品添加剂,常用于葡萄酒、果脯、拉面等食品中。为检验某白葡萄酒中是否含有
是常用的食品添加剂,常用于葡萄酒、果脯、拉面等食品中。为检验某白葡萄酒中是否含有 能否用酸性
能否用酸性 溶液检验?作出判断并说明理由
溶液检验?作出判断并说明理由(3)某小组利用下列装置测定空气中
 的含量。
的含量。
通空气样品的导管末端是带许多小孔的玻璃球泡,其主要作用是
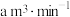 ,当观察到
,当观察到 可被溶液充分吸收,该空气样品中
可被溶液充分吸收,该空气样品中 的含量是
的含量是 。
。
您最近一年使用:0次
2022-05-23更新
|
452次组卷
|
4卷引用:湖南省娄底市新化县第一中学2021-2022学年高三下学期模拟考试化学试题
湖南省娄底市新化县第一中学2021-2022学年高三下学期模拟考试化学试题天津市滨海新区2022届普通高考模拟试卷化学试题天津市高三九校2022届高三第二次模拟考试化学试题(已下线)专题16 化学实验综合题-2022年高考真题模拟题分项汇编
4 . 新冠肺炎疫情期间,含氯消毒剂在环境杀菌消毒方面发挥了重要的作用。其中二氯异氰尿酸钠(简称DCCNa)是一种高效、安全的消毒剂,常温下性质稳定,受热易分解,难溶于冰水。实验室通过以下原理和装置(夹持仪器已略去)可以制取DCCNa。

 +2NaClO(浓)→
+2NaClO(浓)→ +NaOH+H2O
+NaOH+H2O
实验步骤如下:
I.制备高浓度NaClO溶液。
从进料口加入10mL30%NaOH溶液,在10℃左右水浴,搅拌条件下通入Cl2至溶液pH约为8;再加入10mL40%NaOH溶液,继续通入Cl2至溶液pH约为8。
(1)用烧碱固体配制40%的NaOH溶液,下列仪器中不需要的是____ (写名称)。

(2)已知:[Ka(HClO)=5.0×10-8,lg2≈0.3],常温下0.2mol·L-1NaClO溶液的pH范围是____ (填标号)。
A.7.0~8.0 B.10.0~11.0 C.13.0~14.0
(3)水浴降温可以减少NaClO3副产物的生成,该副反应的离子方程式为____ 。
(4)通过改进实验装置,可以提高B中NaOH的利用率,可行的方法是____ (写一种)。
II.制备二氯异氰尿酸钠。
步骤I结束后,从进料口加入异氰尿酸,在搅拌状态下继续通入Cl2,在10℃左右下反应30min,此时三颈瓶内有DCCNa白色晶体析出,停止反应。
(5)继续通入Cl2的目的是____ 。
III.二氯异氰尿酸钠有效氯含量测定。
称取0.1000g样品,用100mL蒸馏水于碘量瓶中溶解后,依次加入20mL0.3mol·L-1醋酸溶液和过量的KI溶液。用0.1000mol·L-1Na2S2O3溶液滴定至溶液呈浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗Na2S2O3溶液16.00mL。
(已知: +CH3COOH+2H2O→
+CH3COOH+2H2O→ +2HClO+CH3COONa,I2+2Na2S2O3=Na2S4O6+2NaI)
+2HClO+CH3COONa,I2+2Na2S2O3=Na2S4O6+2NaI)
(6)滴定终点的现象为____ 。若实验中使用的Na2S2O3标准溶液部分因被氧气氧化而变质,则实验结果____ (填“偏高”“偏低”或“无影响”)。
(7)样品有效氯=____ (样品有效氯=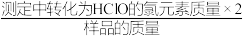 ×100%)。
×100%)。

 +2NaClO(浓)→
+2NaClO(浓)→ +NaOH+H2O
+NaOH+H2O实验步骤如下:
I.制备高浓度NaClO溶液。
从进料口加入10mL30%NaOH溶液,在10℃左右水浴,搅拌条件下通入Cl2至溶液pH约为8;再加入10mL40%NaOH溶液,继续通入Cl2至溶液pH约为8。
(1)用烧碱固体配制40%的NaOH溶液,下列仪器中不需要的是

(2)已知:[Ka(HClO)=5.0×10-8,lg2≈0.3],常温下0.2mol·L-1NaClO溶液的pH范围是
A.7.0~8.0 B.10.0~11.0 C.13.0~14.0
(3)水浴降温可以减少NaClO3副产物的生成,该副反应的离子方程式为
(4)通过改进实验装置,可以提高B中NaOH的利用率,可行的方法是
II.制备二氯异氰尿酸钠。
步骤I结束后,从进料口加入异氰尿酸,在搅拌状态下继续通入Cl2,在10℃左右下反应30min,此时三颈瓶内有DCCNa白色晶体析出,停止反应。
(5)继续通入Cl2的目的是
III.二氯异氰尿酸钠有效氯含量测定。
称取0.1000g样品,用100mL蒸馏水于碘量瓶中溶解后,依次加入20mL0.3mol·L-1醋酸溶液和过量的KI溶液。用0.1000mol·L-1Na2S2O3溶液滴定至溶液呈浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗Na2S2O3溶液16.00mL。
(已知:
 +CH3COOH+2H2O→
+CH3COOH+2H2O→ +2HClO+CH3COONa,I2+2Na2S2O3=Na2S4O6+2NaI)
+2HClO+CH3COONa,I2+2Na2S2O3=Na2S4O6+2NaI)(6)滴定终点的现象为
(7)样品有效氯=
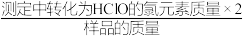 ×100%)。
×100%)。
您最近一年使用:0次
2022-05-11更新
|
319次组卷
|
2卷引用:湖南省长沙市雅礼中学2021-2022学年高三第九次月考(一模)化学试题
5 . [CH3CH(OH)COO]2Fe(乳酸亚铁)是一种广泛应用于食品的铁强化剂,可由乳酸与FeCO3反应制得。兴趣小组在实验室按下列步骤制备乳酸亚铁晶体并进行含量测定。回答下列问题:
I.制备FeCO3:
兴趣小组利用FeSO4(用废铁屑和稀硫酸反应制得)和NH4HCO3在如图装置制备FeCO3:

(1)植物油的作用_______ 。
(2)实验过程中,将生成的FeSO4溶液和NH4HCO3溶液混合的操作是_______ 。
(3)经过滤、洗涤得到FeCO3,久置后,发现在盛有FeCO3试剂瓶的瓶口有红褐色物质,其原因是_______ (用化学方程式解释)。
Ⅱ.制备乳酸亚铁:
(4)兴趣小组向FeCO3固体中加入乳酸溶液,在一定条件下搅拌使之充分反应,并测得反应溶液的pH、温度对乳酸亚铁产率的影响如图所示,

①溶液pH控制在5~6之间乳酸亚铁产率较高的主要原因是_______ 。
②在最适宜的条件下,该反应的化学方程式为:_______
为防止乳酸亚铁变质,在上述体系中还应加入适量铁粉。反应结束后,将所得溶液隔绝空气低温蒸发,_______ (一系列操作)得到乳酸亚铁晶体。该晶体存放时应注意_______ 。
Ⅲ.测定乳酸亚铁的纯度:
(5)兴趣小组通过用硫酸铈铵(NH4)4Ce(SO4)4滴定法测定样品中Fe2+的含量来计算乳酸亚铁固体样品纯度(反应中Ce元素被还原为Ce3+)。称取2.5g样品配制成100.00mL溶液,取该溶液25.00mL,将0.1000mol/L(NH4)4Ce(SO4)4标准溶液装入_______ 中(填A或B),反复滴定2~3次,平均消耗(NH4)4Ce(SO4)4标准溶液25.00mL,则样品中乳酸亚铁的纯度为_______ 。
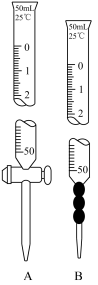
I.制备FeCO3:
兴趣小组利用FeSO4(用废铁屑和稀硫酸反应制得)和NH4HCO3在如图装置制备FeCO3:

(1)植物油的作用
(2)实验过程中,将生成的FeSO4溶液和NH4HCO3溶液混合的操作是
(3)经过滤、洗涤得到FeCO3,久置后,发现在盛有FeCO3试剂瓶的瓶口有红褐色物质,其原因是
Ⅱ.制备乳酸亚铁:
(4)兴趣小组向FeCO3固体中加入乳酸溶液,在一定条件下搅拌使之充分反应,并测得反应溶液的pH、温度对乳酸亚铁产率的影响如图所示,

①溶液pH控制在5~6之间乳酸亚铁产率较高的主要原因是
②在最适宜的条件下,该反应的化学方程式为:
为防止乳酸亚铁变质,在上述体系中还应加入适量铁粉。反应结束后,将所得溶液隔绝空气低温蒸发,
Ⅲ.测定乳酸亚铁的纯度:
(5)兴趣小组通过用硫酸铈铵(NH4)4Ce(SO4)4滴定法测定样品中Fe2+的含量来计算乳酸亚铁固体样品纯度(反应中Ce元素被还原为Ce3+)。称取2.5g样品配制成100.00mL溶液,取该溶液25.00mL,将0.1000mol/L(NH4)4Ce(SO4)4标准溶液装入

您最近一年使用:0次
2022-08-24更新
|
226次组卷
|
3卷引用:湖南省邵阳市第二中学2022届高三下学期全真模拟考试化学试题
名校
解题方法
6 .  俗称大苏打、海波,易溶于水,在中性或碱性环境中能稳定存在,食品工业用作螯合剂、抗氧化剂,医药工业用作洗涤剂、消毒剂。下列说法中根据实验目的、实验操作或现象得到的相关离子方程式正确的是
俗称大苏打、海波,易溶于水,在中性或碱性环境中能稳定存在,食品工业用作螯合剂、抗氧化剂,医药工业用作洗涤剂、消毒剂。下列说法中根据实验目的、实验操作或现象得到的相关离子方程式正确的是
 俗称大苏打、海波,易溶于水,在中性或碱性环境中能稳定存在,食品工业用作螯合剂、抗氧化剂,医药工业用作洗涤剂、消毒剂。下列说法中根据实验目的、实验操作或现象得到的相关离子方程式正确的是
俗称大苏打、海波,易溶于水,在中性或碱性环境中能稳定存在,食品工业用作螯合剂、抗氧化剂,医药工业用作洗涤剂、消毒剂。下列说法中根据实验目的、实验操作或现象得到的相关离子方程式正确的是| 选项 | 实验目的 | 实验操作或现象 | 相关离子方程式 |
| A | 制备 | 实验室用 通入 通入 和 和 的混合溶液中来制备 的混合溶液中来制备 | 4SO2+2S2-+CO =3S2O =3S2O +CO2 +CO2 |
| B | 检验硫代硫酸钠氧化变质可能混有的 | 取少量样品溶于水,先加入过量稀盐酸,再滴加 溶液,有沉淀生成 溶液,有沉淀生成 | SO +Ba2+=BaSO4↓ +Ba2+=BaSO4↓ |
| C | 探究温度对硫代硫酸钠与硫酸反应速率的影响 | 分别将两种反应溶液先混合,再水浴加热至反应要求温度,测得该温度下的反应速率 | 2S2O +2H+=S↓+SO +2H+=S↓+SO +2H2O +2H2O |
| D | 用过量硫代硫酸钠除去水中溶解的氯气 | 黄绿色褪去 | S2O +4Cl2+5H2O=2SO +4Cl2+5H2O=2SO +8Cl-+10H+ +8Cl-+10H+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-02-11更新
|
2449次组卷
|
7卷引用:湖南省四大名校名师团队2022-2023学年高三下学期2月模拟冲刺卷(1)化学试题
湖南省四大名校名师团队2022-2023学年高三下学期2月模拟冲刺卷(1)化学试题湖南省部分学校2022-2023学年高三下学期开学考试化学试题湖南省衡阳市第八中学2023-2024学年高三上学期开学(暑假检测)化学试题(已下线)素养卷09 微型原理验证方案设计-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)专题04 离子反应江苏省靖江高级中学、华罗庚中学2023-2024学年高三上学期第一次阶段考试化学试题江西省新余市第一中学2023-2024学年高三上学期开学考试化学试题
7 . 下列实验方案中,可以达到实验目的的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 检验亚硫酸钠是否变质 | 先将亚硫酸钠样品溶于水配成溶液,然后加入足量稀盐酸酸化,再加入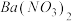 溶液,观察是否生成白色沉淀 溶液,观察是否生成白色沉淀 |
| B | 除去苯中混有的苯酚 | 加入适量的溴水,充分反应后过滤,弃去沉淀 |
| C | 除去NaCl晶体中混有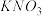 杂质 杂质 | 先将晶体溶于水配成溶液,然后蒸发结晶并趁热过滤弃去滤液 |
| D | 检验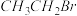 中存在溴元素 中存在溴元素 | 将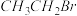 与NaOH溶液共热,冷却后,取出上层水溶液,加入 与NaOH溶液共热,冷却后,取出上层水溶液,加入 溶液,观察是否产生淡黄色沉淀 溶液,观察是否产生淡黄色沉淀 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-08-20更新
|
137次组卷
|
6卷引用:2016届湖南省怀化市高三第一次模拟理综化学试卷
2016届湖南省怀化市高三第一次模拟理综化学试卷决胜2020届有机化学高考对题必练——酚类百所名校联考-化学实验综合题型(已下线)考点32 化学实验方案设计与评价-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点35 化学实验方案的设计与评价-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)
8 . 化学是一门以实验为基础的学科。通过分析下列实验现象,得出的结论中正确的是
| 选项 | 实验操作 | 结论 |
| A | 将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液,观察到溶液变红 | Fe(NO3)2样品已氧化变质 |
| B | 向2mL ZnSO4 和CuSO4的混合溶液中逐滴加入0.01mol/LNa2S溶液,先出现白色沉淀 | 相同温度下,Ksp(ZnS)<Ksp(CuS) |
| C | 取少量酸催化后的淀粉水解液于试管中,先加入过量氢氧化钠溶液中和酸,再加少量碘水,溶液未变蓝 | 淀粉已经完全水解 |
| D | 向NaAlO2的试管中滴加碳酸氢钠溶液,产生白色沉淀 | AlO2-结合氢离子的能力比碳酸根强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-03-18更新
|
1995次组卷
|
4卷引用:【省级联考】四省名校2019届高三下学期第三次大联考理科综合化学试题
【省级联考】四省名校2019届高三下学期第三次大联考理科综合化学试题【懂做原理题】2020届高三化学选修4二轮专题练——沉淀溶解平衡【精编25题】2020届高三化学化学二轮复习——常考题型:沉淀溶解平衡及其影响因素【精编24题】(已下线)第3章 金属及其化合物 单元测试(测)——2020年高考化学一轮复习讲练测
9 . 下列根据实验操作和现象所得出的结论,正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 某亚硫酸钠样品溶于水,加入氯化钡溶液,再加稀硝酸 | 加入氯化钡溶液产生白色沉淀,加硝酸不溶。 | 该亚硫酸钠已变质 |
| B | 向Na2S溶液中滴加盐酸 | 产生臭鸡蛋气味的气体 | 氯的非金属性比硫强 |
| C | 将Zn粒加入pH相同的HA和HB两种酸溶液中 | 产生气泡的速率:HA﹥HB | HA的酸性比HB强 |
| D | CO还原Fe2O3得到的黑色固体加入盐酸溶解后,再加入KSCN溶液 | 溶液不显红色 | 不能确定黑色固体中有无Fe3O4 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
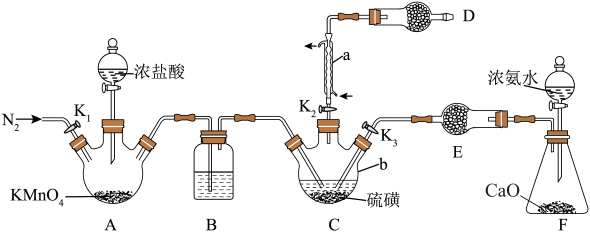
10 .  是最重要的硫氮二元化合物之一,室温下为橙黄色固体,
是最重要的硫氮二元化合物之一,室温下为橙黄色固体,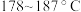 熔化并分解。实验室利用
熔化并分解。实验室利用 和
和 制备
制备 的装置如图所示(加热及夹持装置略)。已知
的装置如图所示(加热及夹持装置略)。已知 易水解,熔点为
易水解,熔点为 ,沸点为
,沸点为 。
。
Ⅰ.制备
(1)操作步骤的先后顺序为_________ 。
①组装仪器并检验装置气密性,加入药品②通入 ,通冷凝水,一段时间后,关闭
,通冷凝水,一段时间后,关闭
③加热装置C使其中的硫磺熔化 ④打开 ,关闭
,关闭
⑤充分反应后停止滴加浓盐酸 ⑥向装置A中滴加浓盐酸,加热装置C至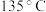 左右
左右
(2)仪器b的名称为_________ ,装置B中盛放的试剂为_________ (填试剂名称)。
(3)装置D的作用为_____________ 。
Ⅱ.制备
打开止水夹 ,向装置F中滴入浓氨水,待装置C中充分反应后停止滴加浓氨水,冷却后停止通冷凝水。
,向装置F中滴入浓氨水,待装置C中充分反应后停止滴加浓氨水,冷却后停止通冷凝水。
(4)生成 的同时还生成一种常见固体单质和一种盐,反应的化学方程式为
的同时还生成一种常见固体单质和一种盐,反应的化学方程式为_________ 。
Ⅲ.分离产物后测定产品纯度
称取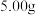 样品,加入
样品,加入 溶液加热,使氮元素(杂质中不含氮元素)完全转化为
溶液加热,使氮元素(杂质中不含氮元素)完全转化为 ,用足量硼酸溶液吸收。将吸收液配成
,用足量硼酸溶液吸收。将吸收液配成 溶液,用移液管移取
溶液,用移液管移取 ,以甲基红-亚甲蓝为指示剂用
,以甲基红-亚甲蓝为指示剂用 盐酸进行滴定,重复3次实验,平均消耗
盐酸进行滴定,重复3次实验,平均消耗 盐酸。已知滴定反应为
盐酸。已知滴定反应为
 。
。
(5)所制得的产品中 的纯度为
的纯度为_________ 。下列实验操作会导致测定结果偏大的是_________ 。
A.定容时俯视刻度线 B.移液管用蒸馏水洗涤后未用吸收液润洗
C.滴定前滴定管尖嘴处有气泡,滴定后无气泡 D.滴定前仰视滴定管读数,滴定后俯视读数
 是最重要的硫氮二元化合物之一,室温下为橙黄色固体,
是最重要的硫氮二元化合物之一,室温下为橙黄色固体,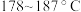 熔化并分解。实验室利用
熔化并分解。实验室利用 和
和 制备
制备 的装置如图所示(加热及夹持装置略)。已知
的装置如图所示(加热及夹持装置略)。已知 易水解,熔点为
易水解,熔点为 ,沸点为
,沸点为 。
。
Ⅰ.制备

(1)操作步骤的先后顺序为
①组装仪器并检验装置气密性,加入药品②通入
 ,通冷凝水,一段时间后,关闭
,通冷凝水,一段时间后,关闭
③加热装置C使其中的硫磺熔化 ④打开
 ,关闭
,关闭
⑤充分反应后停止滴加浓盐酸 ⑥向装置A中滴加浓盐酸,加热装置C至
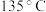 左右
左右(2)仪器b的名称为
(3)装置D的作用为
Ⅱ.制备
打开止水夹
 ,向装置F中滴入浓氨水,待装置C中充分反应后停止滴加浓氨水,冷却后停止通冷凝水。
,向装置F中滴入浓氨水,待装置C中充分反应后停止滴加浓氨水,冷却后停止通冷凝水。(4)生成
 的同时还生成一种常见固体单质和一种盐,反应的化学方程式为
的同时还生成一种常见固体单质和一种盐,反应的化学方程式为Ⅲ.分离产物后测定产品纯度
称取
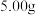 样品,加入
样品,加入 溶液加热,使氮元素(杂质中不含氮元素)完全转化为
溶液加热,使氮元素(杂质中不含氮元素)完全转化为 ,用足量硼酸溶液吸收。将吸收液配成
,用足量硼酸溶液吸收。将吸收液配成 溶液,用移液管移取
溶液,用移液管移取 ,以甲基红-亚甲蓝为指示剂用
,以甲基红-亚甲蓝为指示剂用 盐酸进行滴定,重复3次实验,平均消耗
盐酸进行滴定,重复3次实验,平均消耗 盐酸。已知滴定反应为
盐酸。已知滴定反应为 。
。(5)所制得的产品中
 的纯度为
的纯度为A.定容时俯视刻度线 B.移液管用蒸馏水洗涤后未用吸收液润洗
C.滴定前滴定管尖嘴处有气泡,滴定后无气泡 D.滴定前仰视滴定管读数,滴定后俯视读数
您最近一年使用:0次



