解题方法
1 . 苯乙烯(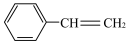 )是合成橡胶和塑料的重要单体,也是生产某些药物、农药的中间体。化合物E是一种昆虫信息素,可以通过以下流程制备。
)是合成橡胶和塑料的重要单体,也是生产某些药物、农药的中间体。化合物E是一种昆虫信息素,可以通过以下流程制备。
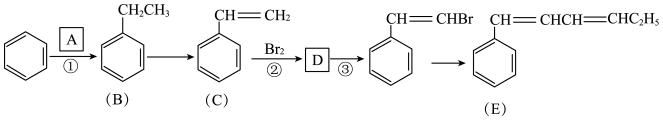
完成下列填空:
(1)反应②的反应类型__________ ;上述流程中的物质,与B互为同分异构体是__________ 。写出B的属于芳香烃的一种同分异构体的结构简式__________ ,该物质的名称为_________ 。
(2)反应①中,A和苯按摩尔比1:1完全反应,产物只有B。写出A的结构简式___________ 。
(3)写出反应③的化学方程式____________________________________ 。
(4)以B为原料制取C的反应是可逆反应,分离C、B混合物的实验操作为____________ 。
(5)苯乙烯露置于空气中可被氧化为苯甲醛和甲醛。设计实验方案检验苯乙烯样品是否被氧化变质______________________________________ 。
(6)参照上述合成路线的表示方法,设计以苯乙烯为原料经过三步反应制备新型高分子导电材料PPA( )的合成路线,并注明必要的反应条件。(无机物任选)
)的合成路线,并注明必要的反应条件。(无机物任选)_____________
 )是合成橡胶和塑料的重要单体,也是生产某些药物、农药的中间体。化合物E是一种昆虫信息素,可以通过以下流程制备。
)是合成橡胶和塑料的重要单体,也是生产某些药物、农药的中间体。化合物E是一种昆虫信息素,可以通过以下流程制备。
完成下列填空:
(1)反应②的反应类型
(2)反应①中,A和苯按摩尔比1:1完全反应,产物只有B。写出A的结构简式
(3)写出反应③的化学方程式
(4)以B为原料制取C的反应是可逆反应,分离C、B混合物的实验操作为
(5)苯乙烯露置于空气中可被氧化为苯甲醛和甲醛。设计实验方案检验苯乙烯样品是否被氧化变质
(6)参照上述合成路线的表示方法,设计以苯乙烯为原料经过三步反应制备新型高分子导电材料PPA(
 )的合成路线,并注明必要的反应条件。(无机物任选)
)的合成路线,并注明必要的反应条件。(无机物任选)
您最近一年使用:0次
解题方法
2 . 一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s) KCl(l)+NaAlSi3O8(s),完成下列填空:
KCl(l)+NaAlSi3O8(s),完成下列填空:
(1)上述反应涉及的第三周期元素中,离子半径最小的是___ ;Cl原子与Si原子可构成有5个原子核的分子,其分子的空间构型为____ 。
(2)用最详尽描述核外电子运动状态的方式,表示氧离子核外电子的运动状态_____ 。
(3)Na和O2反应形成Na2O和Na2O2的混合物,阴阳离子的个数比为__ ;NaAlSi3O8改写成氧化物形式是___ 。
(4)某兴趣小组为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量分数)与温度的关系,进行实验(保持其它条件不变),获得如下数据:
分析数据可以得出,氯化钠熔浸钾长石是__________ 反应(填“放热”或“吸热”);在950℃时,欲提高熔出钾的速率可以采取的一种措施是_______ 。
(5)Na(l)+KCl(l) NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法可行的原因是
NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法可行的原因是___ 。
(6)铝可用于冶炼难熔金属,利用铝的亲氧性,还可用于制取耐高温的金属陶瓷。例如将铝粉、石墨和二氧化钛按一定比例混合均匀,涂在金属表面上,然后在高温下煅烧,可在金属表面形成耐高温的涂层TiC,该反应的化学方程式为_____ 。
 KCl(l)+NaAlSi3O8(s),完成下列填空:
KCl(l)+NaAlSi3O8(s),完成下列填空:(1)上述反应涉及的第三周期元素中,离子半径最小的是
(2)用最详尽描述核外电子运动状态的方式,表示氧离子核外电子的运动状态
(3)Na和O2反应形成Na2O和Na2O2的混合物,阴阳离子的个数比为
(4)某兴趣小组为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量分数)与温度的关系,进行实验(保持其它条件不变),获得如下数据:
| 1.5 | 2.5 | 3.0 | 3.5 | 4.0 | |
| 800℃ | 0.054 | 0.091 | 0.127 | 0.149 | 0.165 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 |
| 860℃ | 0.515 | 0.624 | 0.671 | 0.690 | 0.689 |
| 950℃ | 0.669 | 0.711 | 0.713 | 0.714 | 0.714 |
(5)Na(l)+KCl(l)
 NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法可行的原因是
NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法可行的原因是(6)铝可用于冶炼难熔金属,利用铝的亲氧性,还可用于制取耐高温的金属陶瓷。例如将铝粉、石墨和二氧化钛按一定比例混合均匀,涂在金属表面上,然后在高温下煅烧,可在金属表面形成耐高温的涂层TiC,该反应的化学方程式为
您最近一年使用:0次
3 . 我国提出力争于2030年前实现碳达峰,2060年前实现碳中和,因此碳的捕集和利用成了研究的重点。
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,原理为:CO2(g)+4H2(g)Ru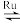 CH4(g)+2H2O(g)。已知H2的体积分数随温度的升高而增加。若温度从300℃升至400℃,重新达到平衡,判断下列各物理量的变化。(选填“增大”、“减小”或“不变”)υ正
CH4(g)+2H2O(g)。已知H2的体积分数随温度的升高而增加。若温度从300℃升至400℃,重新达到平衡,判断下列各物理量的变化。(选填“增大”、“减小”或“不变”)υ正_______ ,υ逆_______ ,平衡常数(K)_______ ;
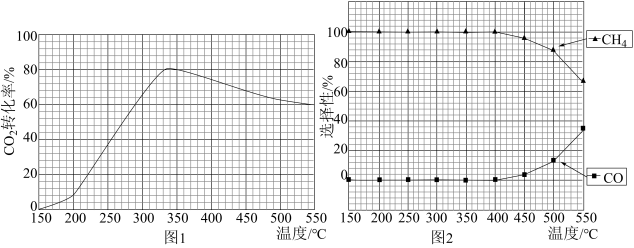
在一定条件下,CO2和H2混和气体共0.5mol(体积比1:4),在2L恒容密闭容器中进行的反应可能有下列反应I和II,经反应相同时间测得“CO2转化率”、CH4和CO“选择性”随温度变化情况分别如图1和图2所示(选择性即转化的CO2中生成CH4或CO的百分比)。
反应I:CO2(g)+4H2(g) CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
反应II:CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
(2)380℃时,容器内发生的反应是_______ (选填I、II或I和II);150℃~300℃,CO2的转化率随温度升高而增大,其原因是_______ ;
(3)①下列说法不正确的是_______ ;
a.反应I是放热反应
b.温度可影响产物的选择性
c.CO2平衡转化率随温度升高先增大后减少
d.其他条件不变,将CO2和H2的初始体积比改变为1:3,可提高CO2平衡转化率
②350℃时,反应I经10min达到平衡,则从起始到平衡,υ(CO2)=_______ mol·L-1·min-1;
(4)常温下,也可用NaOH溶液作CO2的捕捉剂。经测定某次捕捉所得溶液中,Na和C两种元素物质的量比值为5:2,则所得溶液中溶质成份为_______ (填化学式),若NaOH吸收了等物质的量的CO2,则所得溶液中微粒浓度关系为:c(OH-)-c(H+)=_______ (填含碳元素微粒浓度的数学表达式)。
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,原理为:CO2(g)+4H2(g)Ru
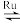 CH4(g)+2H2O(g)。已知H2的体积分数随温度的升高而增加。若温度从300℃升至400℃,重新达到平衡,判断下列各物理量的变化。(选填“增大”、“减小”或“不变”)υ正
CH4(g)+2H2O(g)。已知H2的体积分数随温度的升高而增加。若温度从300℃升至400℃,重新达到平衡,判断下列各物理量的变化。(选填“增大”、“减小”或“不变”)υ正在一定条件下,CO2和H2混和气体共0.5mol(体积比1:4),在2L恒容密闭容器中进行的反应可能有下列反应I和II,经反应相同时间测得“CO2转化率”、CH4和CO“选择性”随温度变化情况分别如图1和图2所示(选择性即转化的CO2中生成CH4或CO的百分比)。

反应I:CO2(g)+4H2(g)
 CH4(g)+2H2O(g)
CH4(g)+2H2O(g)反应II:CO2(g)+H2(g)
 CO(g)+H2O(g)
CO(g)+H2O(g)(2)380℃时,容器内发生的反应是
(3)①下列说法不正确的是
a.反应I是放热反应
b.温度可影响产物的选择性
c.CO2平衡转化率随温度升高先增大后减少
d.其他条件不变,将CO2和H2的初始体积比改变为1:3,可提高CO2平衡转化率
②350℃时,反应I经10min达到平衡,则从起始到平衡,υ(CO2)=
(4)常温下,也可用NaOH溶液作CO2的捕捉剂。经测定某次捕捉所得溶液中,Na和C两种元素物质的量比值为5:2,则所得溶液中溶质成份为
您最近一年使用:0次
2022-06-16更新
|
210次组卷
|
2卷引用:上海市崇明区2022届高三等级考 二模化学试题
4 . Ⅰ.高铁酸钾(K2FeO4) 是一种高效、无毒的强氧化剂,常温下为紫色固体,微溶于浓KOH溶液,能溶于水,且能与水反应放出氧气,并生成Fe(OH)3胶体。稳定性随pH的下降而减弱,酸性条件下易分解。
(1)下列有关铁及其化合物的性质与用途具有对应关系的是___________
Ⅱ.K2FeO4的净水原理如图所示:
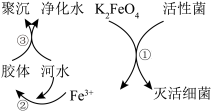
(2)下列说法错误的是___________
(3)写出K2FeO4与水反应的化学方程式___________ 。
Ⅲ.已知可用Cl2与Fe(NO3)3制备K2FeO4(含副产品KCl、KNO3),查阅资料得知高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图所示:
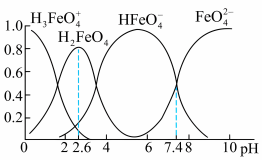
(4)①为获得尽可能纯净的高铁酸盐,pH应控制在___________ 。
②写出在此条件下,反应的离子方程式:___________ ;每生成39.6g K2FeO4,转移的电子数目为___________ ;
(5)已知溶液的酸碱性及离子浓度会对反应试剂的氧化性、还原性产生影响。
某实验小组研究不同反应试剂对K2FeO4产率的影响,对比实验如下:
注:上述实验中,溶液总体积、FeCl3和Fe(NO3)3的物质的量、Cl2的通入量均相同。
①由实验I、II的现象可知,Fe3+的还原性随溶液碱性的增强而___________ (填“增强”、“减弱”或“不变”);
②实验II中K2FeO4的产率比实验III低,试解释其可能的原因:___________ ;
③向实验II所得紫色溶液中继续通入Cl2,观察到溶液紫色变浅,试解释其可能的原因:___________ 。
(6)实验室测定含少量杂质的K2FeO4样品的纯度:称取0.1500g K2FeO4样品溶于碱性KI溶液中,调节pH至弱酸性使混合液充分反应。用0.1000 mol·L−1的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液25.00 mL。滴定时,发生反应的离子方程式:FeO + 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O
+ 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O = S4O
= S4O + 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:
+ 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:___________ (写出计算过程)。
(1)下列有关铁及其化合物的性质与用途具有对应关系的是___________
| A.铁粉具有还原性,可防止食物氧化变质 | B.高铁酸钾能溶于水,可作氧化剂 |
| C.氢氧化铁胶体具有碱性,可用于净水 | D.纯铁无杂质,可用作建筑材料 |
Ⅱ.K2FeO4的净水原理如图所示:

(2)下列说法错误的是___________
| A.K2FeO4中铁元素显+6价 |
| B.过程①中K2FeO4被细菌还原 |
| C.过程②中的Fe(OH)3胶体粒子带正电荷 |
| D.过程③中聚沉是由于胶体发生了渗析 |
(3)写出K2FeO4与水反应的化学方程式
Ⅲ.已知可用Cl2与Fe(NO3)3制备K2FeO4(含副产品KCl、KNO3),查阅资料得知高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图所示:

(4)①为获得尽可能纯净的高铁酸盐,pH应控制在
②写出在此条件下,反应的离子方程式:
(5)已知溶液的酸碱性及离子浓度会对反应试剂的氧化性、还原性产生影响。
某实验小组研究不同反应试剂对K2FeO4产率的影响,对比实验如下:
| 实验编号 | 反应试剂 | 实验现象 |
| Ⅰ | Cl2、FeCl3和少量KOH | 无明显现象 |
| Ⅱ | Cl2、FeCl3和过量KOH | 得到紫色溶液,无紫色固体 |
| Ⅲ | Cl2、Fe(NO3)3和过量KOH | 得到紫色溶液(颜色比Ⅱ深),有紫色固体 |
①由实验I、II的现象可知,Fe3+的还原性随溶液碱性的增强而
②实验II中K2FeO4的产率比实验III低,试解释其可能的原因:
③向实验II所得紫色溶液中继续通入Cl2,观察到溶液紫色变浅,试解释其可能的原因:
(6)实验室测定含少量杂质的K2FeO4样品的纯度:称取0.1500g K2FeO4样品溶于碱性KI溶液中,调节pH至弱酸性使混合液充分反应。用0.1000 mol·L−1的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液25.00 mL。滴定时,发生反应的离子方程式:FeO
 + 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O
+ 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O = S4O
= S4O + 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:
+ 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:
您最近一年使用:0次
5 . 利用下列药品进行实验,能达到实验目的的是
| 实验目的 | 实验药品 | |
| A | 证明烧碱部分变质 | 样品溶液、酚酞、 溶液 溶液 |
| B | 层析法分离微量 和 和 | 样品溶液、丙酮、 溶液 溶液 |
| C | 检验溴乙烷中的溴原子 | 溴乙烷、 溶液、 溶液、 溶液 溶液 |
| D | 除去己烷中的己烯 | 样品、溴水 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
6 . “绿色化学”是化工生产中的重要理念。下图为利用尿素工厂废气以及磷肥工厂废渣(液)联合生产硫酸铵的工艺流程。
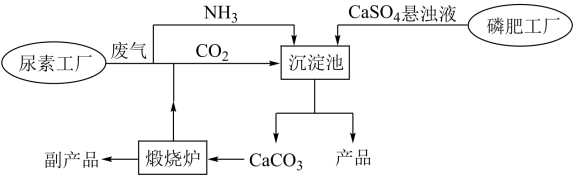
完成下列填空:
(1)沉淀池中发生反应的化学方程式为___________ 。已知硫酸铵溶解度变化趋势与氯化钠相似,则从沉淀池中获得产品的操作包含___________ 、___________ 、洗涤、烘干等。
(2)流程中体现“绿色化学”理念的设计有___________ 、___________ 等。
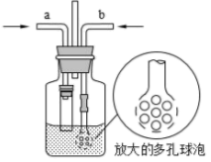
(3)为在实验室模拟沉淀池中的反应,设计了如图所示的装置,导管a下端连接粗管的目的是___________ ;导管b下端使用多孔球泡的目的是___________ 。
可用甲醛法测定所得 样品中氮的质量分数。其反应原理可以表示为:
样品中氮的质量分数。其反应原理可以表示为:
 [已知:
[已知: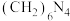 不与NaOH反应]
不与NaOH反应]
实验过程:称取样品1.500g,溶解配制成250mL溶液,取25.00mL样品溶液于锥形瓶中,加入过量的甲醛溶液,摇匀、静置5min后,加入1~2滴甲基橙试液,用NaOH标准溶液滴定至终点。
(4)终点的判断依据是___________ 。
(5)已知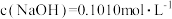 ,消耗氢氧化钠溶液20.00mL,则所得硫酸铵样品中氮的质量分数为
,消耗氢氧化钠溶液20.00mL,则所得硫酸铵样品中氮的质量分数为___________ 。(保留4位小数),实验测得硫酸铵样品中氮的质量分数略高,原因可能是___________ 。
a.甲醛被氧化 b.没有进行平行实验
c.氢氧化钠溶液久置变质 d.锥形瓶没有用待测液润洗

完成下列填空:
(1)沉淀池中发生反应的化学方程式为
(2)流程中体现“绿色化学”理念的设计有
(3)为在实验室模拟沉淀池中的反应,设计了如图所示的装置,导管a下端连接粗管的目的是

可用甲醛法测定所得
 样品中氮的质量分数。其反应原理可以表示为:
样品中氮的质量分数。其反应原理可以表示为: [已知:
[已知: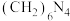 不与NaOH反应]
不与NaOH反应]实验过程:称取样品1.500g,溶解配制成250mL溶液,取25.00mL样品溶液于锥形瓶中,加入过量的甲醛溶液,摇匀、静置5min后,加入1~2滴甲基橙试液,用NaOH标准溶液滴定至终点。
(4)终点的判断依据是
(5)已知
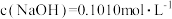 ,消耗氢氧化钠溶液20.00mL,则所得硫酸铵样品中氮的质量分数为
,消耗氢氧化钠溶液20.00mL,则所得硫酸铵样品中氮的质量分数为a.甲醛被氧化 b.没有进行平行实验
c.氢氧化钠溶液久置变质 d.锥形瓶没有用待测液润洗
您最近一年使用:0次
2021-04-20更新
|
351次组卷
|
4卷引用:上海市浦东新区2021届高三二模化学试题
上海市浦东新区2021届高三二模化学试题(已下线)化学-2022年高考押题预测卷02(上海卷)(含考试版、全解全析、参考答案、答题卡)上海市宝山区行知中学-2021-2022学年高三下学期3月月考化学试题(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)
7 . 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由实验现象可推知:____________ 。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①将补全下列实验操作步骤正确排序da_____ e(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2 d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
②缓缓通入N2的目的是_________ 。
③根据实验记录,计算绿矾化学式中结晶水数目x=_________ (列式表示)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A(取出a g后)接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为BaCl2、品红。C、D中可观察到的现象分别为________ 、________ 。
②写出硫酸亚铁高温分解反应的化学方程式________ 。
(4)为了测定A中样品的纯度,将取出a g样品溶于水,配制成500 mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00 mL,实验结果记录如下:
上表中第一次实验中记录数据明显大于后两次,其原因可能是___________ (填字母)。
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由实验现象可推知:
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①将补全下列实验操作步骤正确排序da
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2 d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
②缓缓通入N2的目的是
③根据实验记录,计算绿矾化学式中结晶水数目x=
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A(取出a g后)接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为BaCl2、品红。C、D中可观察到的现象分别为
②写出硫酸亚铁高温分解反应的化学方程式
(4)为了测定A中样品的纯度,将取出a g样品溶于水,配制成500 mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00 mL,实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
您最近一年使用:0次
2020-12-29更新
|
429次组卷
|
2卷引用:上海市嘉定区2021届高三一模化学试题
2012·上海闵行·三模
解题方法
8 . 有一Na2SO3固体因部分被氧化而变质。为测定样品纯度,甲、乙两位同学分别设计了如下实验方案:
甲同学:称取mg样品溶于水,加入过量的BaCl2溶液。过滤,向沉淀中加入过量盐酸,再过滤,将残留固体洗涤后进行烘干,冷却后称得质量为m1g。
(1)BaCl2溶液必须过量的原因是___ 。在滤液中滴加___ 溶液,若没有白色沉淀生成,则证明BaCl2溶液不足,还需继续在滤液中加入BaCl2溶液后进行过滤。
(2)洗涤残留固体的方法是___ ;在洗出液中滴加___ 溶液,可以判断残留固体是否洗涤干净。
(3)判断残留固体质量m1g能够作为实验测定值代入计算式,推算样品纯度,必须补充的实验操作是___ 。
乙同学:称取mg样品溶于水,配成溶液,用滴定管取VmL于锥形瓶中,用浓度为cmol/L的标准酸性高锰酸钾溶液滴定至终点。反应关系为:SO32-+MnO4-SO42-+Mn2+(未配平)
(4)配制样品溶液时,不一定 需要的实验仪器是___ (选填答案编号)。
a.容量瓶 b.玻璃棒 c.滴定管 d.烧杯
(5)滴定终点的判断依据是___ 。
(6)上述滴定中,滴定管在注入酸性高锰酸钾溶液之前,先用蒸馏水洗净,再用___ 。滴定管液面变化如图所示,从图Ⅰ图Ⅱ显示消耗的高锰酸钾溶液体积为___ 。

甲同学:称取mg样品溶于水,加入过量的BaCl2溶液。过滤,向沉淀中加入过量盐酸,再过滤,将残留固体洗涤后进行烘干,冷却后称得质量为m1g。
(1)BaCl2溶液必须过量的原因是
(2)洗涤残留固体的方法是
(3)判断残留固体质量m1g能够作为实验测定值代入计算式,推算样品纯度,必须补充的实验操作是
乙同学:称取mg样品溶于水,配成溶液,用滴定管取VmL于锥形瓶中,用浓度为cmol/L的标准酸性高锰酸钾溶液滴定至终点。反应关系为:SO32-+MnO4-SO42-+Mn2+(未配平)
(4)配制样品溶液时,
a.容量瓶 b.玻璃棒 c.滴定管 d.烧杯
(5)滴定终点的判断依据是
(6)上述滴定中,滴定管在注入酸性高锰酸钾溶液之前,先用蒸馏水洗净,再用

您最近一年使用:0次
名校
9 . 下图的实验装置可用于研究SO2转化为SO3的转化率。已知:SO3的熔点是16.8℃,沸点是44.8℃。A处为SO2气体发生装置,C处为SO2与O2反应的装置。
(1).A处的化学反应方程式为__________________ ,仪器F的名称为___________________________ 。
(2).根据实验需要,应该在D、E处连接合适的装置。请从下图中选择,将所选装置的序号填入相应的空格,D:________________ ,E:______________ 。_____ %(用含a、b的代数式表示)。
(4).若Na2SO3变质,会影响到SO2的转化。现欲检验某Na2SO3样品是否变质,你的方法是____________________________________________________________________________________________ 。
(5).实验结束后,如果将收集了SO3的装置敞口露置于空气中,可看到装置出口处产生大量白雾,其原因是___________________________ 。

(1).A处的化学反应方程式为
(2).根据实验需要,应该在D、E处连接合适的装置。请从下图中选择,将所选装置的序号填入相应的空格,D:
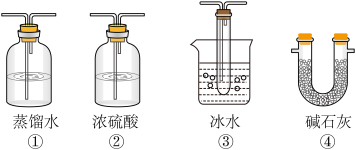
(4).若Na2SO3变质,会影响到SO2的转化。现欲检验某Na2SO3样品是否变质,你的方法是
(5).实验结束后,如果将收集了SO3的装置敞口露置于空气中,可看到装置出口处产生大量白雾,其原因是
您最近一年使用:0次
2018-03-27更新
|
651次组卷
|
4卷引用:上海市静安区七一中学2018届高考一模化学试题
10 . 纳米硫化亚铁是一种很有潜在价值的新材料,值得深入研究。
1.关于铁元素的认识正确的是_________。
2.可用于检验FeSO4溶液是否变质的是_________。
3.高铁酸钠( Na2FeO4) 可用作净水剂,其原因是_________。
4.Fe、Co、Ni三种元素二价氧化物的晶胞类型相同,其熔点最高的是____ 。
A. FeO B. CoO C. NiO
纳米FeS可去除水中微量六价铬[Cr(Ⅵ)]。在pH=4~7的水溶液中,纳米FeS颗粒表面带正电荷,Cr(Ⅵ)主要以CrO 等形式存在,纳米FeS去除水中Cr(Ⅵ)主要经过“吸附→反应→沉淀”的过程。已知: Ksp(FeS)=6.5×10-18,Ksp[Fe(OH)2]=5.0×10-17;H2S的电离常数分别为Ka1=1.1×10-7、Ka2=1.3×10-13。
等形式存在,纳米FeS去除水中Cr(Ⅵ)主要经过“吸附→反应→沉淀”的过程。已知: Ksp(FeS)=6.5×10-18,Ksp[Fe(OH)2]=5.0×10-17;H2S的电离常数分别为Ka1=1.1×10-7、Ka2=1.3×10-13。
5.在弱酸性溶液中,反应FeS+H+ Fe2++HS-的平衡常数K的数值为
Fe2++HS-的平衡常数K的数值为____ 。
在pH=4~7溶液中,pH越大,FeS去除水中Cr(Ⅵ)的速率越慢,原因是____________ 。
6.FeS2的一种晶体与NaCl晶体的结构相似,该FeS2晶体的一个晶胞中S 的数目为_________。
的数目为_________。
7.在FeS2晶体中,每个S原子与三个Fe2+紧邻,且Fe—S间距相等,如图给出了FeS2晶胞中的Fe2+和位于晶胞体心的S (S
(S 中的S—S键位于晶胞体对角线上,晶胞中的其他S
中的S—S键位于晶胞体对角线上,晶胞中的其他S 已省略)。图1中用“—”将其中一个S原子与紧邻的Fe2+连接起来
已省略)。图1中用“—”将其中一个S原子与紧邻的Fe2+连接起来_________ 。

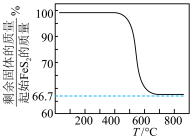
8.FeS2、FeS在空气中易被氧化。将FeS2在空气中氧化,测得氧化过程中剩余固体的质量与起始FeS2的质量的比值随温度变化的曲线如图所示。800℃时,FeS2氧化成含有两种元素的固体产物_______ 。
1.关于铁元素的认识正确的是_________。
| A.能存在于人体的血红蛋白中 | B.是地壳中含量最多的金属元素 |
| C.单质是人类最早使用的金属 | D.铁的氧化物都具有致密的结构 |
| A.稀盐酸 | B.酚酞试液 | C.KSCN溶液 | D.苯酚 |
| A.能吸附水中杂质,氧化产物能消毒杀菌 |
| B.可消毒杀菌,氧化产物能吸附水中杂质 |
| C.能吸附水中杂质,还原产物能消毒杀菌 |
| D.可消毒杀菌,还原产物能吸附水中杂质 |
A. FeO B. CoO C. NiO
纳米FeS可去除水中微量六价铬[Cr(Ⅵ)]。在pH=4~7的水溶液中,纳米FeS颗粒表面带正电荷,Cr(Ⅵ)主要以CrO
 等形式存在,纳米FeS去除水中Cr(Ⅵ)主要经过“吸附→反应→沉淀”的过程。已知: Ksp(FeS)=6.5×10-18,Ksp[Fe(OH)2]=5.0×10-17;H2S的电离常数分别为Ka1=1.1×10-7、Ka2=1.3×10-13。
等形式存在,纳米FeS去除水中Cr(Ⅵ)主要经过“吸附→反应→沉淀”的过程。已知: Ksp(FeS)=6.5×10-18,Ksp[Fe(OH)2]=5.0×10-17;H2S的电离常数分别为Ka1=1.1×10-7、Ka2=1.3×10-13。5.在弱酸性溶液中,反应FeS+H+
 Fe2++HS-的平衡常数K的数值为
Fe2++HS-的平衡常数K的数值为在pH=4~7溶液中,pH越大,FeS去除水中Cr(Ⅵ)的速率越慢,原因是
6.FeS2的一种晶体与NaCl晶体的结构相似,该FeS2晶体的一个晶胞中S
 的数目为_________。
的数目为_________。| A.2 | B.4 | C.6 | D.8 |
 (S
(S 中的S—S键位于晶胞体对角线上,晶胞中的其他S
中的S—S键位于晶胞体对角线上,晶胞中的其他S 已省略)。图1中用“—”将其中一个S原子与紧邻的Fe2+连接起来
已省略)。图1中用“—”将其中一个S原子与紧邻的Fe2+连接起来
8.FeS2、FeS在空气中易被氧化。将FeS2在空气中氧化,测得氧化过程中剩余固体的质量与起始FeS2的质量的比值随温度变化的曲线如图所示。800℃时,FeS2氧化成含有两种元素的固体产物

您最近一年使用:0次



