1 . 证据推理是学习化学的重要方法,下列证据与推理的关系错误的是
| 选项 | 证据 | 推理 |
| A | 向过氧化钠样品中滴加过量的盐酸,将生成的气体通入Ba(OH)2溶液中,有白色沉淀生成 | 样品已变质 |
| B | 向盛有Fe(NO3)3溶液的试管中加入0.1mol/LH2SO4溶液,试管口出现红棕色气体 | 溶液中的Fe2+被 氧化 氧化 |
| C | 向乙醇中加入浓硫酸,加热,溶液变黑,将产生的气体通入酸性KMnO4溶液,溶液褪色 | 该气体可能是乙烯 |
| D | 向淀粉溶液中加适量20%H2SO4溶液,加热冷却后加NaOH溶液至中性,再滴加少量碘水,溶液变蓝 | 淀粉未发生水解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
2 . 下列实验操作、现象与结论相匹配的是
| 选项 | 操作 | 现象 | 结论 |
| A | 向 溶液中加入 溶液中加入 溶液 溶液 | 有白色沉淀生成 |  结合 结合 的能力比 的能力比 弱 弱 |
| B | 将 溶液和 溶液和 溶液分别加入 溶液分别加入 溶液中 溶液中 | 均出现白色沉淀 |  溶液和 溶液和 溶液均可使 溶液均可使 的水解平衡正向移动 的水解平衡正向移动 |
| C | 常温下,将 苯与 苯与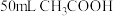 混合 混合 | 所得混合溶液的体积为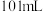 | 混合过程中削弱了 分子间的氢键,且苯与 分子间的氢键,且苯与 分子间的作用弱于氢键 分子间的作用弱于氢键 |
| D | 将 样品溶于稀 样品溶于稀 后,滴加 后,滴加 溶液 溶液 | 溶液显红色 |  晶体已氧化变质 晶体已氧化变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 食品级焦亚硫酸钠 常用作食品的抗氧化剂,在空气中易氧化、受热易分解。实验室可通过制备
常用作食品的抗氧化剂,在空气中易氧化、受热易分解。实验室可通过制备 的过饱和溶液经结晶制得。回答下列问题:
的过饱和溶液经结晶制得。回答下列问题:
(1)实验室制备少量 的装置如图1所示:打开磁力搅拌器,将装有
的装置如图1所示:打开磁力搅拌器,将装有 过饱和溶液的锥形瓶置于40℃水浴中,通入
过饱和溶液的锥形瓶置于40℃水浴中,通入 ,当
,当 数字采集器测得溶液的
数字采集器测得溶液的 为
为___________ 时,停止反应,装置甲中生成 的过饱和溶液,在20℃左右静置结晶脱水制得焦亚硫酸钠。从装置甲中获得已析出的晶体,可采取的分离方法是
的过饱和溶液,在20℃左右静置结晶脱水制得焦亚硫酸钠。从装置甲中获得已析出的晶体,可采取的分离方法是___________ 。 转化成
转化成 的化学方程式为
的化学方程式为___________ 。
(2)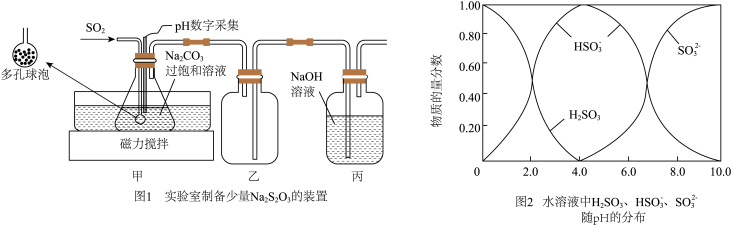
通 气体的导管末端是带许多小孔的玻璃球泡,其主要作用是
气体的导管末端是带许多小孔的玻璃球泡,其主要作用是___________ 。
(3)析出固体的反应液经减压蒸发、冷却结晶、减压抽滤、洗涤、25℃~30℃干燥,可进一步获得 固体。其中减压蒸发是为了
固体。其中减压蒸发是为了___________ 。
(4)长期放置的 晶体会部分氧化而发生变质,验证产品是否变质时所需的试剂是
晶体会部分氧化而发生变质,验证产品是否变质时所需的试剂是___________ 。(已知: 溶于水即生成
溶于水即生成 )
)
(5)某机构通过下述方法检测变质样品中抗氧化剂 残留的含量,步骤如下:
残留的含量,步骤如下:
步骤一:取配制后的样品溶液 于锥形瓶中(假设其他杂质不反应)。
于锥形瓶中(假设其他杂质不反应)。
步骤二:用 的碘标准液滴定至终点,消耗碘标准液
的碘标准液滴定至终点,消耗碘标准液 。
。
滴定反应的离子方程式为___________ ,该样品中 的残留量为
的残留量为___________  。
。
 常用作食品的抗氧化剂,在空气中易氧化、受热易分解。实验室可通过制备
常用作食品的抗氧化剂,在空气中易氧化、受热易分解。实验室可通过制备 的过饱和溶液经结晶制得。回答下列问题:
的过饱和溶液经结晶制得。回答下列问题:(1)实验室制备少量
 的装置如图1所示:打开磁力搅拌器,将装有
的装置如图1所示:打开磁力搅拌器,将装有 过饱和溶液的锥形瓶置于40℃水浴中,通入
过饱和溶液的锥形瓶置于40℃水浴中,通入 ,当
,当 数字采集器测得溶液的
数字采集器测得溶液的 为
为 的过饱和溶液,在20℃左右静置结晶脱水制得焦亚硫酸钠。从装置甲中获得已析出的晶体,可采取的分离方法是
的过饱和溶液,在20℃左右静置结晶脱水制得焦亚硫酸钠。从装置甲中获得已析出的晶体,可采取的分离方法是 转化成
转化成 的化学方程式为
的化学方程式为(2)

通
 气体的导管末端是带许多小孔的玻璃球泡,其主要作用是
气体的导管末端是带许多小孔的玻璃球泡,其主要作用是(3)析出固体的反应液经减压蒸发、冷却结晶、减压抽滤、洗涤、25℃~30℃干燥,可进一步获得
 固体。其中减压蒸发是为了
固体。其中减压蒸发是为了(4)长期放置的
 晶体会部分氧化而发生变质,验证产品是否变质时所需的试剂是
晶体会部分氧化而发生变质,验证产品是否变质时所需的试剂是 溶于水即生成
溶于水即生成 )
)(5)某机构通过下述方法检测变质样品中抗氧化剂
 残留的含量,步骤如下:
残留的含量,步骤如下:步骤一:取配制后的样品溶液
 于锥形瓶中(假设其他杂质不反应)。
于锥形瓶中(假设其他杂质不反应)。步骤二:用
 的碘标准液滴定至终点,消耗碘标准液
的碘标准液滴定至终点,消耗碘标准液 。
。滴定反应的离子方程式为
 的残留量为
的残留量为 。
。
您最近一年使用:0次
4 . 下列实验设计可以达到实验目的的是
选项 | 实验目的 | 实验设计 |
A | 检验 | 将少量 |
B | 检验待测液中含有 | 用玻璃棒蘸取待测液在无色火焰上灼烧观察现象 |
C | 制备 | 将5~6滴饱和 |
D | 室温下,用pH试纸测定浓度均为0.1mol/L的NaClO溶液和 | 比较HClO和 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
5 . 富马酸亚铁(结构简式为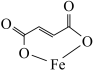 ,M=170)常用于治疗缺铁性贫血,也可作食品营养强化剂。某化学兴趣小组用富马酸(HOOCCH=CHCOOH)和FeSO4制备富马酸亚铁,并对其纯度进行测定,过程如下:
,M=170)常用于治疗缺铁性贫血,也可作食品营养强化剂。某化学兴趣小组用富马酸(HOOCCH=CHCOOH)和FeSO4制备富马酸亚铁,并对其纯度进行测定,过程如下:
步骤I:富马酸亚铁晶体的制备
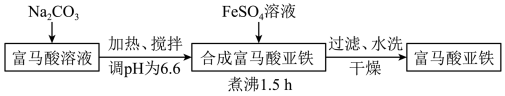
(1)合成富马酸亚铁时使用如图所示装置(加热和夹持装置略去)。仪器A的名称是_______ ,球形冷凝管的作用为_______ 。

(2)调pH时最好选用的酸为_______ 。
a.盐酸 b.硫酸 c.硝酸
(3)合成富马酸亚铁的化学方程式为_______ 。
(4)煮沸过程中会持续通入氮气,其目的是_______ 。
(5)水洗环节中,判断富马酸亚铁产品已洗净的实验方法是_______ 。
步骤Ⅱ:产品纯度的测定
取0.4000g样品置于250mL锥形瓶中,加入15.00mL硫酸,加热溶解后冷却,再加入50.00mL新煮沸过的冷水和2滴邻二氮菲指示液,此时溶液星红色;立即用0.1000mol/L的硫酸铈铵(NH4)2Ce(SO4)3标准液滴定(还原产物为Ce3+),滴定终点溶液变为浅蓝色。平行测定三次,平均消耗22.00mL标准液。
(6)滴定过程的硫酸铈铵[(NH4)2Ce(SO4)3]标准液应装入_______ (填“酸式”或“碱式”)滴定管。根据上述实验数据,测得产品的纯度是_______ %。
 ,M=170)常用于治疗缺铁性贫血,也可作食品营养强化剂。某化学兴趣小组用富马酸(HOOCCH=CHCOOH)和FeSO4制备富马酸亚铁,并对其纯度进行测定,过程如下:
,M=170)常用于治疗缺铁性贫血,也可作食品营养强化剂。某化学兴趣小组用富马酸(HOOCCH=CHCOOH)和FeSO4制备富马酸亚铁,并对其纯度进行测定,过程如下:步骤I:富马酸亚铁晶体的制备

(1)合成富马酸亚铁时使用如图所示装置(加热和夹持装置略去)。仪器A的名称是

(2)调pH时最好选用的酸为
a.盐酸 b.硫酸 c.硝酸
(3)合成富马酸亚铁的化学方程式为
(4)煮沸过程中会持续通入氮气,其目的是
(5)水洗环节中,判断富马酸亚铁产品已洗净的实验方法是
步骤Ⅱ:产品纯度的测定
取0.4000g样品置于250mL锥形瓶中,加入15.00mL硫酸,加热溶解后冷却,再加入50.00mL新煮沸过的冷水和2滴邻二氮菲指示液,此时溶液星红色;立即用0.1000mol/L的硫酸铈铵(NH4)2Ce(SO4)3标准液滴定(还原产物为Ce3+),滴定终点溶液变为浅蓝色。平行测定三次,平均消耗22.00mL标准液。
(6)滴定过程的硫酸铈铵[(NH4)2Ce(SO4)3]标准液应装入
您最近一年使用:0次
2024-03-08更新
|
77次组卷
|
2卷引用:贵州省贵阳市白云区第二高级中学2023-2024学年高三上学期质量监测化学试卷
6 . 高氯酸铵 为白色晶体,分解时产生大量气体,是复合火箭推进剂的重要成分。
为白色晶体,分解时产生大量气体,是复合火箭推进剂的重要成分。
 高氯酸铵中氯元素的化合价为
高氯酸铵中氯元素的化合价为_____________ 。
 高氯酸铵在高温条件下分解会产生H
高氯酸铵在高温条件下分解会产生H 和三种单质气体,请写出该分解反应的化学方程式
和三种单质气体,请写出该分解反应的化学方程式____________________________ 。
 某研究小组在实验室设计如下装置检验高氯酸铵分解的产物。该小组连接好装置后,依次检查装置的气密性、装入试剂、通干燥的惰性气体排尽装置内的空气、将导管末端移入盛满水的试管E、通入气体产物。
某研究小组在实验室设计如下装置检验高氯酸铵分解的产物。该小组连接好装置后,依次检查装置的气密性、装入试剂、通干燥的惰性气体排尽装置内的空气、将导管末端移入盛满水的试管E、通入气体产物。 已知:焦性没食子酸溶液用于吸收氧气
已知:焦性没食子酸溶液用于吸收氧气
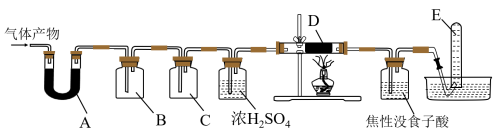
 装置A、B、C、D中盛放的药品可以依次为
装置A、B、C、D中盛放的药品可以依次为__________  选填序号:Ⅰ、Ⅱ或Ⅲ
选填序号:Ⅰ、Ⅱ或Ⅲ 。
。
Ⅰ 碱石灰、湿润的淀粉KI试纸、氢氧化钠溶液、Cu
碱石灰、湿润的淀粉KI试纸、氢氧化钠溶液、Cu
Ⅱ 无水硫酸铜、湿润的红色布条、氢氧化钠溶液、Cu
无水硫酸铜、湿润的红色布条、氢氧化钠溶液、Cu
Ⅲ 无水硫酸铜、湿润的淀粉KI试纸、饱和食盐水、Cu
无水硫酸铜、湿润的淀粉KI试纸、饱和食盐水、Cu
 装置E收集到的气体可能是
装置E收集到的气体可能是_____________  填化学式
填化学式 。
。
 经查阅资料,该小组利用反应NaClO4(aq)+NH4Cl(aq)
经查阅资料,该小组利用反应NaClO4(aq)+NH4Cl(aq) NH4ClO4(aq)+NaCl(aq)在实验室制取
NH4ClO4(aq)+NaCl(aq)在实验室制取 ,该反应中各物质的溶解度随温度的变化曲线如图。
,该反应中各物质的溶解度随温度的变化曲线如图。
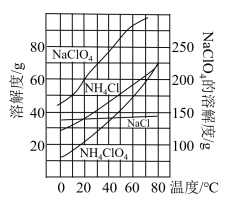
 从混合溶液中获得较多粗NH
从混合溶液中获得较多粗NH ClO
ClO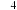 晶体的实验操作依次为
晶体的实验操作依次为________ 、_________ 和过滤、洗涤、干燥。
 研究小组分析认为,若用氨气和浓盐酸代替NH
研究小组分析认为,若用氨气和浓盐酸代替NH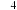 Cl,则上述反应不需要外界供热就能进行,其原因是
Cl,则上述反应不需要外界供热就能进行,其原因是_______________________________ 。
 研究小组通过甲醛法测定所得产品NH
研究小组通过甲醛法测定所得产品NH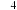 ClO
ClO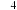 的质量分数。
的质量分数。 已知:NH
已知:NH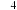 ClO
ClO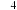 的相对分子质量为
的相对分子质量为 ;NH
;NH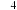 ClO
ClO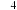 与甲醛反应的离子方程式为
与甲醛反应的离子方程式为 ,
, N
N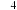 H
H

 N
N

实验步骤:
步骤Ⅰ 称取
称取 样品。
样品。
步骤Ⅱ 将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取
移取 样品溶液于250mL锥形瓶中,加入
样品溶液于250mL锥形瓶中,加入 的中性甲醛溶液
的中性甲醛溶液 过量
过量 ,摇匀、静置5min后,加入
,摇匀、静置5min后,加入 滴酚酞试液,用NaOH标准溶液滴定至终点。记录数据。重复
滴酚酞试液,用NaOH标准溶液滴定至终点。记录数据。重复 滴定
滴定 操作2次。
操作2次。
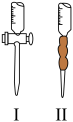
 标准液应盛放在上图装置
标准液应盛放在上图装置_________  填“Ⅰ”或“Ⅱ”
填“Ⅰ”或“Ⅱ” 中,判断达到滴定终点的现象是
中,判断达到滴定终点的现象是__________ 。
 滴定结果如下表所示:
滴定结果如下表所示:
则所用标准溶液的体积为___________ mL,若NaOH标准溶液的浓度为 ,则该产品中
,则该产品中 的质量分数为
的质量分数为_____________ 。
 为白色晶体,分解时产生大量气体,是复合火箭推进剂的重要成分。
为白色晶体,分解时产生大量气体,是复合火箭推进剂的重要成分。  高氯酸铵中氯元素的化合价为
高氯酸铵中氯元素的化合价为 高氯酸铵在高温条件下分解会产生H
高氯酸铵在高温条件下分解会产生H 和三种单质气体,请写出该分解反应的化学方程式
和三种单质气体,请写出该分解反应的化学方程式 某研究小组在实验室设计如下装置检验高氯酸铵分解的产物。该小组连接好装置后,依次检查装置的气密性、装入试剂、通干燥的惰性气体排尽装置内的空气、将导管末端移入盛满水的试管E、通入气体产物。
某研究小组在实验室设计如下装置检验高氯酸铵分解的产物。该小组连接好装置后,依次检查装置的气密性、装入试剂、通干燥的惰性气体排尽装置内的空气、将导管末端移入盛满水的试管E、通入气体产物。 已知:焦性没食子酸溶液用于吸收氧气
已知:焦性没食子酸溶液用于吸收氧气

 装置A、B、C、D中盛放的药品可以依次为
装置A、B、C、D中盛放的药品可以依次为 选填序号:Ⅰ、Ⅱ或Ⅲ
选填序号:Ⅰ、Ⅱ或Ⅲ 。
。Ⅰ
 碱石灰、湿润的淀粉KI试纸、氢氧化钠溶液、Cu
碱石灰、湿润的淀粉KI试纸、氢氧化钠溶液、CuⅡ
 无水硫酸铜、湿润的红色布条、氢氧化钠溶液、Cu
无水硫酸铜、湿润的红色布条、氢氧化钠溶液、CuⅢ
 无水硫酸铜、湿润的淀粉KI试纸、饱和食盐水、Cu
无水硫酸铜、湿润的淀粉KI试纸、饱和食盐水、Cu 装置E收集到的气体可能是
装置E收集到的气体可能是 填化学式
填化学式 。
。 经查阅资料,该小组利用反应NaClO4(aq)+NH4Cl(aq)
经查阅资料,该小组利用反应NaClO4(aq)+NH4Cl(aq) NH4ClO4(aq)+NaCl(aq)在实验室制取
NH4ClO4(aq)+NaCl(aq)在实验室制取 ,该反应中各物质的溶解度随温度的变化曲线如图。
,该反应中各物质的溶解度随温度的变化曲线如图。
 从混合溶液中获得较多粗NH
从混合溶液中获得较多粗NH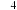 ClO
ClO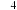 晶体的实验操作依次为
晶体的实验操作依次为 研究小组分析认为,若用氨气和浓盐酸代替NH
研究小组分析认为,若用氨气和浓盐酸代替NH Cl,则上述反应不需要外界供热就能进行,其原因是
Cl,则上述反应不需要外界供热就能进行,其原因是 研究小组通过甲醛法测定所得产品NH
研究小组通过甲醛法测定所得产品NH ClO
ClO 的质量分数。
的质量分数。 已知:NH
已知:NH ClO
ClO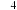 的相对分子质量为
的相对分子质量为 ;NH
;NH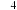 ClO
ClO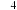 与甲醛反应的离子方程式为
与甲醛反应的离子方程式为 ,
, N
N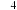 H
H

 N
N

实验步骤:
步骤Ⅰ
 称取
称取 样品。
样品。步骤Ⅱ
 将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。步骤Ⅲ
 移取
移取 样品溶液于250mL锥形瓶中,加入
样品溶液于250mL锥形瓶中,加入 的中性甲醛溶液
的中性甲醛溶液 过量
过量 ,摇匀、静置5min后,加入
,摇匀、静置5min后,加入 滴酚酞试液,用NaOH标准溶液滴定至终点。记录数据。重复
滴酚酞试液,用NaOH标准溶液滴定至终点。记录数据。重复 滴定
滴定 操作2次。
操作2次。
 标准液应盛放在上图装置
标准液应盛放在上图装置 填“Ⅰ”或“Ⅱ”
填“Ⅰ”或“Ⅱ” 中,判断达到滴定终点的现象是
中,判断达到滴定终点的现象是 滴定结果如下表所示:
滴定结果如下表所示: | 滴定次数 | 标准溶液的体积 | |
滴定前刻度 | 滴定后刻度 | |
| 1 |  |  |
| 2 |  |  |
| 3 |  |  |
 ,则该产品中
,则该产品中 的质量分数为
的质量分数为
您最近一年使用:0次
2020-02-04更新
|
461次组卷
|
2卷引用:贵州省贵阳市2019届高三第二次模化学试卷
7 . I.常温下,HNO2电离反应的平衡常数值为2.6×10-4。NaNO2是一种重要的食品添加剂,由于其外观及味道都与食盐非常相似,误食工业用盐造成食物中毒的事件时有发生。
(1)某活动小组同学设计实验方案鉴别 NaCl溶液和NaNO2溶液,请填写下列表格。
(2)亚硝酸钠有毒,不能随意排放,实验室一般将其与饱和氯化铵溶液共热使之转化成无毒无公害的物质,其产物之一为无色无味气体,则该气体为____________ (填化学式)。
II.活动小组同学采用如下装置制备并测定所得固体中亚硝酸钠(NaNO2)的质量分数(装置可重复使用,部分夹持仪器已省略)。
已知:①2NO + Na2O2 =2NaNO2;
②酸性条件下,NO、NO2都能与MnO4-反应生成NO3-和Mn2+;NaNO2能使酸性高锰酸钾溶液褪色。
(1)实验装置的连接顺序为____________ ;
(2)C瓶内发生反应的离子方程式为____________ 。
(3)为了测定亚硝酸钠的含量,称取4.0g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.10 mol·L-1的酸性KMnO4溶液进行滴定,实验所得数据如下表。
①第一组实验数据出现较明显异常,造成异常的原因可能是__________ (填字母序号)。
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶用蒸馏水洗净后未干燥
c.观察滴定终点时仰视读数
②根据表中数据进行计算,所制得的固体中亚硝酸钠的质量分数为____________ 。
(4)设计实验,比较0.1mol·L-1NaNO2溶液中NO2-的水解程度和0.1mol·L-1HNO2溶液中HNO2电离程度的相对大小_______ (简要说明实验步骤、现象和结论,仪器和药品自选)。
(1)某活动小组同学设计实验方案鉴别 NaCl溶液和NaNO2溶液,请填写下列表格。
| 选用药品 | 实验现象 | 利用NaNO2的性质 |
| ①酚酞试液 | ||
| ②淀粉-KI试纸 |
(2)亚硝酸钠有毒,不能随意排放,实验室一般将其与饱和氯化铵溶液共热使之转化成无毒无公害的物质,其产物之一为无色无味气体,则该气体为
II.活动小组同学采用如下装置制备并测定所得固体中亚硝酸钠(NaNO2)的质量分数(装置可重复使用,部分夹持仪器已省略)。

已知:①2NO + Na2O2 =2NaNO2;
②酸性条件下,NO、NO2都能与MnO4-反应生成NO3-和Mn2+;NaNO2能使酸性高锰酸钾溶液褪色。
(1)实验装置的连接顺序为
(2)C瓶内发生反应的离子方程式为
(3)为了测定亚硝酸钠的含量,称取4.0g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.10 mol·L-1的酸性KMnO4溶液进行滴定,实验所得数据如下表。
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
①第一组实验数据出现较明显异常,造成异常的原因可能是
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶用蒸馏水洗净后未干燥
c.观察滴定终点时仰视读数
②根据表中数据进行计算,所制得的固体中亚硝酸钠的质量分数为
(4)设计实验,比较0.1mol·L-1NaNO2溶液中NO2-的水解程度和0.1mol·L-1HNO2溶液中HNO2电离程度的相对大小
您最近一年使用:0次
2017-04-17更新
|
660次组卷
|
5卷引用:贵州省遵义航天高级中学2017届高三第十一次模拟(5月)理科综合化学试题
贵州省遵义航天高级中学2017届高三第十一次模拟(5月)理科综合化学试题2017届重庆市万州区高三下学期“二诊”模拟考试化学试卷(已下线)《2020年新高考政策解读与配套资源》模拟试题04-2020年北京新高考化学模拟试题湖南省常德市2020届高三第一次模拟考试理综化学试题安徽省淮北市第一中学2017-2018学年高二下学期期中考试化学试题


 胶体
胶体 溶液滴加到煮沸的蒸馏水中,继续煮沸至液体呈红褐色为止
溶液滴加到煮沸的蒸馏水中,继续煮沸至液体呈红褐色为止 溶液的pH
溶液的pH

