名校
1 . 根据下列实验操作和现象,得出的实验结论正确的是
| 选项 | 实验操作和现象 | 实验结论 |
| A | 取铝热反应(Al和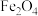 反应)后的固体,溶于足量稀硫酸,滴加KSCN溶液,溶液不变红 反应)后的固体,溶于足量稀硫酸,滴加KSCN溶液,溶液不变红 | 说明该固体中不含 |
| B | 向 溶液中加入等浓度等体积的 溶液中加入等浓度等体积的 溶液,出现白色沉淀 溶液,出现白色沉淀 |  比 比 更容易结合 更容易结合 |
| C | 取少量 样品溶于水,加入 样品溶于水,加入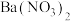 溶液,再加入足量盐酸,产生白色沉淀 溶液,再加入足量盐酸,产生白色沉淀 | 原样品已变质 |
| D | 向麦芽糖溶液中加入少量稀硫酸,加热,滴加NaOH溶液调至碱性,再加入银氨溶液,水浴加热,可观察到产生银镜 | 麦芽糖水解产物具有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-05-30更新
|
196次组卷
|
2卷引用:河北省保定市九校2024届高三下学期二模化学试题
名校
解题方法
2 . 植物缺铁是缺亚铁离子。如果施用硫酸亚铁,亚铁离子容易被氧化,一般采用施用摩尔盐 (
(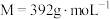 )。摩尔盐是浅蓝绿色晶体,溶于水,但在水中溶解度比硫酸亚铁和硫酸铵都要小,几乎不溶于乙醇,在空气中比硫酸亚铁稳定。以下是摩尔盐的制备步骤。
)。摩尔盐是浅蓝绿色晶体,溶于水,但在水中溶解度比硫酸亚铁和硫酸铵都要小,几乎不溶于乙醇,在空气中比硫酸亚铁稳定。以下是摩尔盐的制备步骤。
Ⅰ.把30% 溶液和废铁屑混合、煮沸、冷却,将洗涤铁屑后的
溶液和废铁屑混合、煮沸、冷却,将洗涤铁屑后的 溶液装入右边广口瓶中。
溶液装入右边广口瓶中。
Ⅱ.在锥形瓶中用处理过的铁屑和稀 反应制取
反应制取 。
。
Ⅲ.将硫酸亚铁溶液与硫酸铵溶液混合,结晶,过滤,用乙醇洗涤后再低温烘干,得到摩尔盐。
(1)装硫酸的仪器的名称是___________ 。
(2)用 溶液洗涤废铁屑的目的是
溶液洗涤废铁屑的目的是___________ 。
(3)Fe屑和稀 反应产生的氢气可赶走装置中的氧气及
反应产生的氢气可赶走装置中的氧气及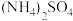 溶液中的溶解氧,操作时应先关闭活塞
溶液中的溶解氧,操作时应先关闭活塞___________ (填A、B或C,下同),并同时打开活塞___________ 。
(4)摩尔盐中铵离子检验方法是___________ 。
(5)步骤Ⅲ过滤后用乙醇洗涤后再低温烘干。用乙醇洗涤的原因是___________ 。
(6)取10.00g所制得的固体于小烧杯中,加入适量稀硫酸,溶解后在 容量瓶中定容。取定容后溶液
容量瓶中定容。取定容后溶液 于锥形瓶中,用
于锥形瓶中,用 的
的 溶液滴定至终点。平行操作三次,消耗
溶液滴定至终点。平行操作三次,消耗 溶液的体积分别为
溶液的体积分别为 、
、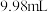 、
、 。此样品中
。此样品中 含量最接近
含量最接近___________ 。
A.11% B.12% C.13% D.14%
导致该测定结果比理论值偏低的可能原因是___________ 。
A.配摩尔盐溶液定容时俯视刻度线 B.取摩尔盐溶液的滴定管没有润洗
C.滴定用的锥形瓶洗净后未干燥 D.高锰酸钾部分变质
(7)将摩尔盐隔绝空气加热到773K时会分解,分解产物有氧化铁、硫的氧化物、氨气和水。写出该反应的化学方程式___________ 。
 (
(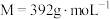 )。摩尔盐是浅蓝绿色晶体,溶于水,但在水中溶解度比硫酸亚铁和硫酸铵都要小,几乎不溶于乙醇,在空气中比硫酸亚铁稳定。以下是摩尔盐的制备步骤。
)。摩尔盐是浅蓝绿色晶体,溶于水,但在水中溶解度比硫酸亚铁和硫酸铵都要小,几乎不溶于乙醇,在空气中比硫酸亚铁稳定。以下是摩尔盐的制备步骤。Ⅰ.把30%
 溶液和废铁屑混合、煮沸、冷却,将洗涤铁屑后的
溶液和废铁屑混合、煮沸、冷却,将洗涤铁屑后的 溶液装入右边广口瓶中。
溶液装入右边广口瓶中。Ⅱ.在锥形瓶中用处理过的铁屑和稀
 反应制取
反应制取 。
。Ⅲ.将硫酸亚铁溶液与硫酸铵溶液混合,结晶,过滤,用乙醇洗涤后再低温烘干,得到摩尔盐。

(1)装硫酸的仪器的名称是
(2)用
 溶液洗涤废铁屑的目的是
溶液洗涤废铁屑的目的是(3)Fe屑和稀
 反应产生的氢气可赶走装置中的氧气及
反应产生的氢气可赶走装置中的氧气及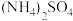 溶液中的溶解氧,操作时应先关闭活塞
溶液中的溶解氧,操作时应先关闭活塞(4)摩尔盐中铵离子检验方法是
(5)步骤Ⅲ过滤后用乙醇洗涤后再低温烘干。用乙醇洗涤的原因是
(6)取10.00g所制得的固体于小烧杯中,加入适量稀硫酸,溶解后在
 容量瓶中定容。取定容后溶液
容量瓶中定容。取定容后溶液 于锥形瓶中,用
于锥形瓶中,用 的
的 溶液滴定至终点。平行操作三次,消耗
溶液滴定至终点。平行操作三次,消耗 溶液的体积分别为
溶液的体积分别为 、
、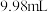 、
、 。此样品中
。此样品中 含量最接近
含量最接近A.11% B.12% C.13% D.14%
导致该测定结果比理论值偏低的可能原因是
A.配摩尔盐溶液定容时俯视刻度线 B.取摩尔盐溶液的滴定管没有润洗
C.滴定用的锥形瓶洗净后未干燥 D.高锰酸钾部分变质
(7)将摩尔盐隔绝空气加热到773K时会分解,分解产物有氧化铁、硫的氧化物、氨气和水。写出该反应的化学方程式
您最近一年使用:0次
2024-04-01更新
|
184次组卷
|
2卷引用:河北省张家口市尚义县第一中学等校2023-2024学年高三下学期模拟演练化学试题
名校
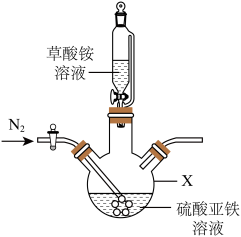
3 . 草酸亚铁晶体(FeC2O4·2H2O,难溶于水)是电池磷酸铁锂正极材料所需的主要原材料。某同学在实验室,利用废铁屑制备草酸亚铁晶体(FeC2O4·2H2O)。回答下列问题:
(1)利用废铁屑制备硫酸亚铁溶液。废铁屑在使用前需要用热的饱和碳酸钠溶液进行洗涤,目的是___________ ;为了防止硫酸亚铁变质,制备过程中应采取的措施是___________ 。
(2)草酸亚铁晶体制备,实验装置如图所示。___________ 。
②实验过程中不断通入N2,其目的除了提供无氧环境,另一个目的是___________ (结合实验装置回答)。
③反应完全后,用蒸馏水和无水乙醇多次洗涤,进行固液分离,在60℃下干燥12h,得到淡黄色的草酸亚铁晶体产品。检验草酸亚铁晶体洗涤干净的方法是___________ ;写出制备草酸亚铁晶体的离子方程式:___________ 。
(3)产品中FeC2O4·2H2O的质量分数测定[假设产品中杂质仅为FeSO4和(NH4)2SO4]
Ⅰ.将准确称量的ag草酸亚铁晶体样品置于250mL锥形瓶内,加入适量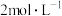 的H2SO4溶解,加热至70℃左右,立即用浓度为
的H2SO4溶解,加热至70℃左右,立即用浓度为 的高锰酸钾标准溶液滴定至终点,重复2~3次,平均消耗高锰酸钾溶液bmL;
的高锰酸钾标准溶液滴定至终点,重复2~3次,平均消耗高锰酸钾溶液bmL;
Ⅱ.向上述滴定混合液中加入适量的Zn粉和过量的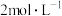 的H2SO4溶液,煮沸(不含Fe3+),继续用
的H2SO4溶液,煮沸(不含Fe3+),继续用 的高锰酸钾标准溶液滴定至终点,平均消耗高锰酸钾溶液cmL。
的高锰酸钾标准溶液滴定至终点,平均消耗高锰酸钾溶液cmL。
①步骤Ⅱ中检验溶液不含Fe3+的操作:取一滴煮沸后的溶液滴入装有___________ (填化学式)溶液的试管中,若___________ ,则说明溶液不含Fe3+。
②产品中FeC2O4·2H2O的质量分数为___________ %(用含a、b、c的式子表示)。
已知 。
。
(1)利用废铁屑制备硫酸亚铁溶液。废铁屑在使用前需要用热的饱和碳酸钠溶液进行洗涤,目的是
(2)草酸亚铁晶体制备,实验装置如图所示。
②实验过程中不断通入N2,其目的除了提供无氧环境,另一个目的是
③反应完全后,用蒸馏水和无水乙醇多次洗涤,进行固液分离,在60℃下干燥12h,得到淡黄色的草酸亚铁晶体产品。检验草酸亚铁晶体洗涤干净的方法是
(3)产品中FeC2O4·2H2O的质量分数测定[假设产品中杂质仅为FeSO4和(NH4)2SO4]
Ⅰ.将准确称量的ag草酸亚铁晶体样品置于250mL锥形瓶内,加入适量
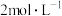 的H2SO4溶解,加热至70℃左右,立即用浓度为
的H2SO4溶解,加热至70℃左右,立即用浓度为 的高锰酸钾标准溶液滴定至终点,重复2~3次,平均消耗高锰酸钾溶液bmL;
的高锰酸钾标准溶液滴定至终点,重复2~3次,平均消耗高锰酸钾溶液bmL;Ⅱ.向上述滴定混合液中加入适量的Zn粉和过量的
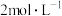 的H2SO4溶液,煮沸(不含Fe3+),继续用
的H2SO4溶液,煮沸(不含Fe3+),继续用 的高锰酸钾标准溶液滴定至终点,平均消耗高锰酸钾溶液cmL。
的高锰酸钾标准溶液滴定至终点,平均消耗高锰酸钾溶液cmL。①步骤Ⅱ中检验溶液不含Fe3+的操作:取一滴煮沸后的溶液滴入装有
②产品中FeC2O4·2H2O的质量分数为
已知
 。
。
您最近一年使用:0次
2023-08-14更新
|
475次组卷
|
2卷引用:河北省部分学校2023届高三4月大联考二模化学试题
4 . 下列实验方案中,能达到实验目的的是
| 选项 | 实验方案 | 实验目的 |
| A | 取少量待测样品溶于蒸馏水,加入足量 溶液 溶液 | 检验 固体是否变质 固体是否变质 |
| B | 向盛有 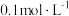  溶液的试管中滴加10滴 溶液的试管中滴加10滴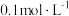  溶液,有白色沉淀生成,向其中继续滴加 溶液,有白色沉淀生成,向其中继续滴加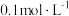  溶液,有黄色沉淀产生 溶液,有黄色沉淀产生 | 验证: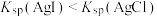 |
| C | 将 通入 通入 溶液后,将混合气体依次通入酸性 溶液后,将混合气体依次通入酸性 溶液、品红溶液、澄清石灰水 溶液、品红溶液、澄清石灰水 | 验证非金属性: |
| D | 相同条件下,在两个试管中各加入3mL6%的 溶液,再向 溶液,再向 溶液中分别滴入1mL 溶液中分别滴入1mL 和1mL 和1mL  溶液,观察并比较 溶液,观察并比较 的分解速率 的分解速率 | 探究催化剂对 分解速率的影响 分解速率的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
5 . 亚铁氰化钾晶体,化学式为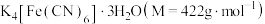 ,俗名黄血盐,可溶于水,不溶于乙醇,在电镀、食品添加剂等方面有广泛用途。用含NaCN的废液合成黄血盐的主要工艺流程如下:
,俗名黄血盐,可溶于水,不溶于乙醇,在电镀、食品添加剂等方面有广泛用途。用含NaCN的废液合成黄血盐的主要工艺流程如下:
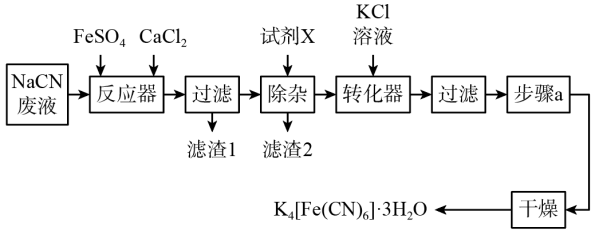
(1)实验室用绿矾晶体配制硫酸亚铁溶液时,为了防止其变质需要添加的试剂为___________ 。
(2)反应器中发生的主要反应的化学方程式为___________ 。
(3)在“除杂”步骤中,向体系中加入适量的试剂X为___________ (填字母)。
a.NaCl b. c.
c.
(4)转化器中发生反应的离子方程式___________ 。
(5)实验室进行步骤a的操作为___________ 。
(6)对所得样品进行纯度测定:
步骤1:准确称取8.884g黄血盐样品加入水中充分溶解,将所得溶液转移至容量瓶并配制成100.00mL溶液。
步骤2:量取25.00mL上述溶液,用 酸性
酸性 溶液滴定,达到滴定终点时,共消耗
溶液滴定,达到滴定终点时,共消耗 溶液30.50mL。该实验中所发生的反应如下:
溶液30.50mL。该实验中所发生的反应如下:
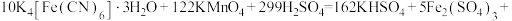
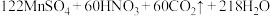
①通过计算确定该样品的纯度是___________ (保留3位有效数字)。
②下列操作会使测定结果偏高的是___________ (填字母)。
A.步骤1过程中黄血盐所含亚铁在空气中部分氧化
B.滴定前仰视滴定管读数,滴定后读数正确
C.滴定结束后,滴定管内壁附着液滴
D.滴定前滴定管尖嘴部分有气泡,滴定后尖嘴部分无气泡
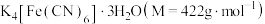 ,俗名黄血盐,可溶于水,不溶于乙醇,在电镀、食品添加剂等方面有广泛用途。用含NaCN的废液合成黄血盐的主要工艺流程如下:
,俗名黄血盐,可溶于水,不溶于乙醇,在电镀、食品添加剂等方面有广泛用途。用含NaCN的废液合成黄血盐的主要工艺流程如下:
(1)实验室用绿矾晶体配制硫酸亚铁溶液时,为了防止其变质需要添加的试剂为
(2)反应器中发生的主要反应的化学方程式为
(3)在“除杂”步骤中,向体系中加入适量的试剂X为
a.NaCl b.
 c.
c.
(4)转化器中发生反应的离子方程式
(5)实验室进行步骤a的操作为
(6)对所得样品进行纯度测定:
步骤1:准确称取8.884g黄血盐样品加入水中充分溶解,将所得溶液转移至容量瓶并配制成100.00mL溶液。
步骤2:量取25.00mL上述溶液,用
 酸性
酸性 溶液滴定,达到滴定终点时,共消耗
溶液滴定,达到滴定终点时,共消耗 溶液30.50mL。该实验中所发生的反应如下:
溶液30.50mL。该实验中所发生的反应如下: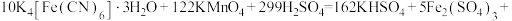
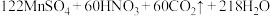
①通过计算确定该样品的纯度是
②下列操作会使测定结果偏高的是
A.步骤1过程中黄血盐所含亚铁在空气中部分氧化
B.滴定前仰视滴定管读数,滴定后读数正确
C.滴定结束后,滴定管内壁附着液滴
D.滴定前滴定管尖嘴部分有气泡,滴定后尖嘴部分无气泡
您最近一年使用:0次
2022-03-18更新
|
860次组卷
|
4卷引用:河北省衡水中学2022-2023学年高三上学期四调考试化学试题
河北省衡水中学2022-2023学年高三上学期四调考试化学试题山东省泰安市2021-2022学年高三下学期3月一模考试化学试题(已下线)必刷卷03-2022年高考化学考前信息必刷卷(山东专用)陕西省西安中学2023-2024学年高三上学期期末考试理综试题-高中化学
未知-未知
|
较易(0.85)
|
名校
6 . 下列实验操作所得的现象及结论均正确的是
| 选项 | 实验操作 | 现象及结论 |
| A | 将AlCl3溶液加热蒸干 | 得到白色固体,成分为纯净的AlCl3 |
| B | 将少量Na2SO3样品溶于水,滴加足量盐酸酸化的Ba(NO3)2溶液 | 有白色沉淀产生,则Na2SO3已变质 |
| C | 用量筒量取一定体积的浓硫酸时,仰视读数 | 所量取的浓硫酸体积偏大 |
| D | 向FeI2溶液中通入少量Cl2 | 溶液变黄,则Cl2的氧化性强于Fe3+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
7 . 下列有关实验的描述正确的是
| A.向碘化钠稀溶液中加入新制氯水立即生成大量紫黑色固体 |
| B.向分别装有1g Na2CO3和NaHCO3固体的试管中滴入几滴水,温度高的为Na2CO3 |
| C.将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,变红,说明样品变质 |
| D.中和热测定时环形玻璃搅拌棒要不断顺时针搅拌,目的是为了混合均匀,充分反应 |
您最近一年使用:0次
2017-05-08更新
|
781次组卷
|
7卷引用:河北省石家庄市2017届高三毕业班第二次模拟考试理科综合化学试题
解题方法
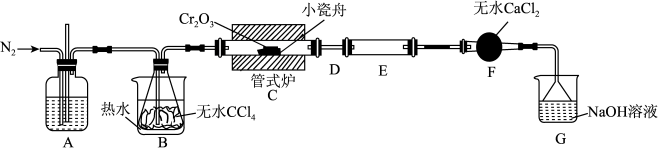
8 . 三氯化铬( )是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取
)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取 的反应为:
的反应为: ,其实验装置如下图所示:
,其实验装置如下图所示:
已知:① (俗称光气)有毒,遇水发生水解:
(俗称光气)有毒,遇水发生水解: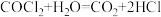 ;
;
②碱性条件下, 可将
可将 氧化为
氧化为 (黄色);酸性条件下,
(黄色);酸性条件下, 将
将 (橙色)还原为
(橙色)还原为 (绿色)。
(绿色)。
(1)A装置用于干燥 和观察其流速,A中的试剂是
和观察其流速,A中的试剂是_______ ;无水 的作用是
的作用是_______ ;反应结束后要继续通入一段时间氮气,主要目的是_______ 。
(2)装置E用来收集产物。实验过程中若D处因发生凝华出现堵塞,A装置中可观察到的现象是_______ ;可通过_______ (填操作)使实验继续进行。
(3)尾气与装置G中过量的 溶液发生反应的离子方程式是
溶液发生反应的离子方程式是_______ 。
(4)测定产品中 ,质量分数的实验步骤如下:
,质量分数的实验步骤如下:
Ⅰ.取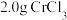 产品,在强碱性条件下,加入过量
产品,在强碱性条件下,加入过量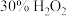 溶液,小火加热使
溶液,小火加热使 完全转化为
完全转化为 ,再继续加热一段时间。
,再继续加热一段时间。
Ⅱ.冷却后加适量的蒸馏水,再滴入适量的稀硫酸和浓磷酸(浓磷酸作用是防止指示剂提前变色),使 转化为
转化为 。
。
Ⅲ.在溶液中加入适量浓 混合均匀,滴入3滴试亚铁灵做指示剂,用新配制的
混合均匀,滴入3滴试亚铁灵做指示剂,用新配制的 标准溶液滴定,溶液由黄色经蓝绿色至红褐色即为终点,消耗
标准溶液滴定,溶液由黄色经蓝绿色至红褐色即为终点,消耗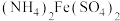 标准溶液
标准溶液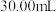 (滴定中
(滴定中 被
被 还原为
还原为 )。
)。
①计算产品中 质量分数为
质量分数为_______ 。
②下列操作将导致产品中 质量分数测定值偏低的是
质量分数测定值偏低的是_______ (填字母标号)。
A.步骤Ⅰ中未继续加热一段时间
B.步骤Ⅱ用盐酸替代硫酸
C.步骤Ⅲ中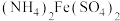 溶液部分变质
溶液部分变质
D.步骤Ⅲ中读数时,滴定前俯视,滴定后平视
 )是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取
)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取 的反应为:
的反应为: ,其实验装置如下图所示:
,其实验装置如下图所示:
已知:①
 (俗称光气)有毒,遇水发生水解:
(俗称光气)有毒,遇水发生水解: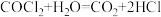 ;
;②碱性条件下,
 可将
可将 氧化为
氧化为 (黄色);酸性条件下,
(黄色);酸性条件下, 将
将 (橙色)还原为
(橙色)还原为 (绿色)。
(绿色)。(1)A装置用于干燥
 和观察其流速,A中的试剂是
和观察其流速,A中的试剂是 的作用是
的作用是(2)装置E用来收集产物。实验过程中若D处因发生凝华出现堵塞,A装置中可观察到的现象是
(3)尾气与装置G中过量的
 溶液发生反应的离子方程式是
溶液发生反应的离子方程式是(4)测定产品中
 ,质量分数的实验步骤如下:
,质量分数的实验步骤如下:Ⅰ.取
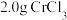 产品,在强碱性条件下,加入过量
产品,在强碱性条件下,加入过量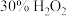 溶液,小火加热使
溶液,小火加热使 完全转化为
完全转化为 ,再继续加热一段时间。
,再继续加热一段时间。Ⅱ.冷却后加适量的蒸馏水,再滴入适量的稀硫酸和浓磷酸(浓磷酸作用是防止指示剂提前变色),使
 转化为
转化为 。
。Ⅲ.在溶液中加入适量浓
 混合均匀,滴入3滴试亚铁灵做指示剂,用新配制的
混合均匀,滴入3滴试亚铁灵做指示剂,用新配制的 标准溶液滴定,溶液由黄色经蓝绿色至红褐色即为终点,消耗
标准溶液滴定,溶液由黄色经蓝绿色至红褐色即为终点,消耗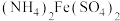 标准溶液
标准溶液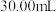 (滴定中
(滴定中 被
被 还原为
还原为 )。
)。①计算产品中
 质量分数为
质量分数为②下列操作将导致产品中
 质量分数测定值偏低的是
质量分数测定值偏低的是A.步骤Ⅰ中未继续加热一段时间
B.步骤Ⅱ用盐酸替代硫酸
C.步骤Ⅲ中
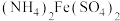 溶液部分变质
溶液部分变质D.步骤Ⅲ中读数时,滴定前俯视,滴定后平视
您最近一年使用:0次
2022-03-29更新
|
663次组卷
|
3卷引用:必刷卷05-2022年高考化学考前信息必刷卷(河北专用)
9 . 实验室利用如图装置探究SO2还原CuO,并进一步检测产物含量。已知Cu2O+2H+=Cu+Cu2++H2O。回答下列相关问题:

Ⅰ.SO2还原CuO的探究
(1)装置B中宜放入的试剂为___ ,消膜泡的作用是__ 。
(2)使用98%的H2SO4溶液制备SO2的速率明显小于使用65%的H2SO4溶液制备SO2,原因是__ 。
(3)充分反应后,黑色固体变为红色。取C中适量的产物,加水后溶液显蓝色并有红色沉淀物,取红色沉淀物滴加盐酸,溶液又呈蓝色并仍有少量红色不溶物,由此可以得出SO2与CuO反应的方程式为__ 。
Ⅱ.生成物中CuSO4含量检测
(4)用“碘量法”测定产物中CuSO4含量。取mg固体溶解于水配制为250mL溶液,取20.00mL溶液滴加几滴稀硫酸,再加入过量KI溶液,以淀粉为指示剂用Na2S2O3标准溶液滴定,相关化学反应为2Cu2++4I-=2CuI↓+I2,I2+I- I3-,I2+2S2O32-=S4O62-+2I-。
I3-,I2+2S2O32-=S4O62-+2I-。
①Na2S2O3标准溶液易变质,滴定前需要标定。配制该溶液时需要的玻璃仪器有烧杯、___ 、玻璃棒和试剂瓶。
②若消耗0.1000mol/LNa2S2O3标准溶液VmL,则产物中CuSO4质量分数为____ (写表达式)。
③CuI沉淀物对I3-具有强的吸附能力,由此会造成CuSO4质量分数测定值____ (填“偏大”或“偏小”)。为减少实验误差,滴定过程中,常常在接近终点时加入KSCN,使CuI转化为溶解度更小的CuSCN,该沉淀物对I3-吸附能力极弱,KSCN加入太早,I2的浓度较大,I2会将SCN-氧化生成SO42-和ICN,该反应的离子方程式为___ 。

Ⅰ.SO2还原CuO的探究
(1)装置B中宜放入的试剂为
(2)使用98%的H2SO4溶液制备SO2的速率明显小于使用65%的H2SO4溶液制备SO2,原因是
(3)充分反应后,黑色固体变为红色。取C中适量的产物,加水后溶液显蓝色并有红色沉淀物,取红色沉淀物滴加盐酸,溶液又呈蓝色并仍有少量红色不溶物,由此可以得出SO2与CuO反应的方程式为
Ⅱ.生成物中CuSO4含量检测
(4)用“碘量法”测定产物中CuSO4含量。取mg固体溶解于水配制为250mL溶液,取20.00mL溶液滴加几滴稀硫酸,再加入过量KI溶液,以淀粉为指示剂用Na2S2O3标准溶液滴定,相关化学反应为2Cu2++4I-=2CuI↓+I2,I2+I-
 I3-,I2+2S2O32-=S4O62-+2I-。
I3-,I2+2S2O32-=S4O62-+2I-。①Na2S2O3标准溶液易变质,滴定前需要标定。配制该溶液时需要的玻璃仪器有烧杯、
②若消耗0.1000mol/LNa2S2O3标准溶液VmL,则产物中CuSO4质量分数为
③CuI沉淀物对I3-具有强的吸附能力,由此会造成CuSO4质量分数测定值
您最近一年使用:0次
2020-05-27更新
|
635次组卷
|
7卷引用:河北省武邑中学2021届高三二模化学试题
河北省武邑中学2021届高三二模化学试题安徽省合肥市2020届高三下学期“停课不停学”线上考试化学试题广东省执信中学2020届高三2月月考理科综合化学试题(已下线)专题16 化学实验综合题-2020年高考真题和模拟题化学分项汇编四川省成都市树德中学2021届高三上学期10月阶段性测理综化学试题四川省眉山市仁寿第二中学2021届高三上学期第四次诊断化学试题(已下线)专题10 化学实验基础——备战2021年高考化学纠错笔记
10 . (NH4)2Fe(SO4)2·6H2O(莫尔盐,浅绿色,式量392)在定量分析中常用作标定高锰酸钾、重铬酸钾等溶液的标准物质,还用作化学试剂、医药以及用于冶金、电镀等。
回答下列问题:
(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质,检验莫尔盐是否变质的试剂是_______________。
(2)准确称取mg纯净的莫尔盐,在锥形瓶中加入20mL水充分溶解,用某酸性K2Cr2O7溶液滴定至终点。重复进行3次,测得有关数据如下:
①K2Cr2O7溶液应该放在______________式滴定管中。
②写出滴定过程中反应的离子方程式:______________;
③所测K2Cr2O7溶液的物质的量浓度为______________mol/L(用含M的代数式表示)。
(3)某课题组通过实验检验莫尔盐晶体加热时的分解产物。
①甲同学提出猜想:分解产物可能是N2、Fe2O3,SO3、H2O四种物质。你是否同意并说明理由:______________。
②乙同学设计了如图装置,其中A装置中的固体变为红棕色,则固体产物中含有______________;C装置中红色褪去,说明气体产物中含有______________;
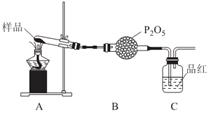
C装置后应连接尾气吸收装置D,D中盛有的试剂可以是______________(写一种即可)。
③丙同学想利用上述装置证明分解产物中含有氨气.只需更换B,C中的试剂即可,则更换后的试剂为B______________、C______________。
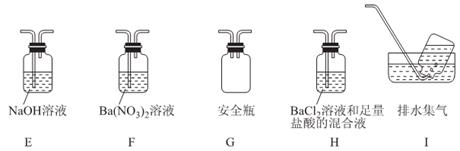
④丁同学认为莫尔盐分解可能会生成N2,SO3,拟从下列装置中选择必要的装置加以证明。则正确的连接顺序从左到右依次是A、______________。
回答下列问题:
(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质,检验莫尔盐是否变质的试剂是_______________。
(2)准确称取mg纯净的莫尔盐,在锥形瓶中加入20mL水充分溶解,用某酸性K2Cr2O7溶液滴定至终点。重复进行3次,测得有关数据如下:
| 实验序号 | 起始读数/mL | 终点读数/mL |
| I | 2.50 | 22.58 |
| Ⅱ | 1.00 | 23.12 |
| Ⅲ | 0.00 | 19.92 |
①K2Cr2O7溶液应该放在______________式滴定管中。
②写出滴定过程中反应的离子方程式:______________;
③所测K2Cr2O7溶液的物质的量浓度为______________mol/L(用含M的代数式表示)。
(3)某课题组通过实验检验莫尔盐晶体加热时的分解产物。
①甲同学提出猜想:分解产物可能是N2、Fe2O3,SO3、H2O四种物质。你是否同意并说明理由:______________。
②乙同学设计了如图装置,其中A装置中的固体变为红棕色,则固体产物中含有______________;C装置中红色褪去,说明气体产物中含有______________;

C装置后应连接尾气吸收装置D,D中盛有的试剂可以是______________(写一种即可)。
③丙同学想利用上述装置证明分解产物中含有氨气.只需更换B,C中的试剂即可,则更换后的试剂为B______________、C______________。
④丁同学认为莫尔盐分解可能会生成N2,SO3,拟从下列装置中选择必要的装置加以证明。则正确的连接顺序从左到右依次是A、______________。

您最近一年使用:0次



