解题方法
1 . 小组同学探究+3价铬元素和+6价铬元素的相互转化。
资料: (绿色)、
(绿色)、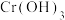 (灰绿色,不溶于水)、
(灰绿色,不溶于水)、 (橙色)、
(橙色)、 (黄色)、
(黄色)、 (砖红色,难溶于水)
(砖红色,难溶于水)
实验Ⅰ:向2mL0.1mol/L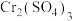 溶液中滴入2mL3%
溶液中滴入2mL3% 溶液,无明显变化,得到溶液a.取少量溶液a,加入
溶液,无明显变化,得到溶液a.取少量溶液a,加入 溶液,未观察到砖红色沉淀。
溶液,未观察到砖红色沉淀。
实验Ⅱ:向溶液a中加入2mL10%NaOH溶液,产生少量气泡,水浴加热,有大量气泡产生,经检验气体为 ,溶液最终变为黄色。取少量黄色溶液,加入稀硫酸调节溶液的pH约为3,再加入
,溶液最终变为黄色。取少量黄色溶液,加入稀硫酸调节溶液的pH约为3,再加入 溶液,有砖红色沉淀生成。
溶液,有砖红色沉淀生成。
(1)实验Ⅱ中加入稀硫酸的目的是___________ 。
(2)甲同学认为实验Ⅱ中溶液变黄生成 的原因是
的原因是 将+3价铬元素氧化为
将+3价铬元素氧化为 ,乙同学认为该说法不严谨。
,乙同学认为该说法不严谨。
①乙的理由是___________ 。
②设计实验否定了乙的猜想,___________ (填操作),溶液未变成黄色。
(3)对比实验I和Ⅱ,小组同学研究碱性环境对+3价铬元素或 性质的影响。
性质的影响。
①提出假设:
假设a:碱性增强, 的氧化性增强
的氧化性增强
假设b:___________ 。
② 参与的电极反应式是
参与的电极反应式是___________ ,据此分析,假设a不成立。
③设计实验证实假设b,画出实验装置图(注明试剂)并写出实验操作和现象___________ 。
实验Ⅲ:向实验Ⅱ中的黄色溶液中加入稀硫酸,溶液变为橙色,再加入3% 溶液,溶液最终变为绿色,有气泡生成。
溶液,溶液最终变为绿色,有气泡生成。
(4)实验Ⅲ中溶液由橙色变为绿色的离子方程式是___________ 。
(5)综上, 在+3价铬元素和+6价铬元素相互转化中的作用是
在+3价铬元素和+6价铬元素相互转化中的作用是___________ 。
资料:
 (绿色)、
(绿色)、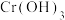 (灰绿色,不溶于水)、
(灰绿色,不溶于水)、 (橙色)、
(橙色)、 (黄色)、
(黄色)、 (砖红色,难溶于水)
(砖红色,难溶于水)实验Ⅰ:向2mL0.1mol/L
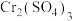 溶液中滴入2mL3%
溶液中滴入2mL3% 溶液,无明显变化,得到溶液a.取少量溶液a,加入
溶液,无明显变化,得到溶液a.取少量溶液a,加入 溶液,未观察到砖红色沉淀。
溶液,未观察到砖红色沉淀。实验Ⅱ:向溶液a中加入2mL10%NaOH溶液,产生少量气泡,水浴加热,有大量气泡产生,经检验气体为
 ,溶液最终变为黄色。取少量黄色溶液,加入稀硫酸调节溶液的pH约为3,再加入
,溶液最终变为黄色。取少量黄色溶液,加入稀硫酸调节溶液的pH约为3,再加入 溶液,有砖红色沉淀生成。
溶液,有砖红色沉淀生成。(1)实验Ⅱ中加入稀硫酸的目的是
(2)甲同学认为实验Ⅱ中溶液变黄生成
 的原因是
的原因是 将+3价铬元素氧化为
将+3价铬元素氧化为 ,乙同学认为该说法不严谨。
,乙同学认为该说法不严谨。①乙的理由是
②设计实验否定了乙的猜想,
(3)对比实验I和Ⅱ,小组同学研究碱性环境对+3价铬元素或
 性质的影响。
性质的影响。①提出假设:
假设a:碱性增强,
 的氧化性增强
的氧化性增强假设b:
②
 参与的电极反应式是
参与的电极反应式是③设计实验证实假设b,画出实验装置图(注明试剂)并写出实验操作和现象
实验Ⅲ:向实验Ⅱ中的黄色溶液中加入稀硫酸,溶液变为橙色,再加入3%
 溶液,溶液最终变为绿色,有气泡生成。
溶液,溶液最终变为绿色,有气泡生成。(4)实验Ⅲ中溶液由橙色变为绿色的离子方程式是
(5)综上,
 在+3价铬元素和+6价铬元素相互转化中的作用是
在+3价铬元素和+6价铬元素相互转化中的作用是
您最近一年使用:0次
2 . 海淀黄庄某中学化学小组为探究 的性质,进行了下列实验。
的性质,进行了下列实验。
[实验一]探究 的还原性,波波做了下列实验:
的还原性,波波做了下列实验:
(1)对比实验ⅰ与ⅱ,关于盐酸的作用,珊珊提出两个假设:
假设一:c(H+)增大,提高了 的氧化性或
的氧化性或 的还原性;
的还原性;
假设二: c(Cl-)增大,降低了还原产物的浓度,提高了 的氧化性。
的氧化性。
小雨设计实验方案,确认假设一不正确,实验方案是_______ 。
睿睿查阅资料: (白色沉淀)
(白色沉淀)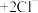 。
。
设计实验方案,确认了假设二正确,实验方案是_______ 。
(2)写出ⅱ中反应的离子方程式_______ 。
(3)对比实验ⅱ与ⅲ,针对反应速率的差异,进行了以下探究:
瑛瑛进行理论预测:依据_______ 反应(写离子方程式),氧化性: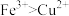 ,ⅲ的反应速率快于ⅱ的。
,ⅲ的反应速率快于ⅱ的。
萌萌查阅资料: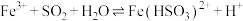 。
。
结合资料,解释实验ⅱ与ⅲ的速率差异_______ 。
[实验二]探究 的氧化性,邹邹做了下列实验:
的氧化性,邹邹做了下列实验:
(4)博博借助仪器检验黑色沉淀是 ,溶液中没有
,溶液中没有 。写出ⅴ中反应的离子方程式
。写出ⅴ中反应的离子方程式_______ 。
(5)反应ⅴ能发生,可能是因为Cu2S的生成提高了Cu的还原性或 的氧化性,
的氧化性, 的生成提高了Cu的还原性。对比实验ⅳ、ⅴ与ⅵ,昊昊得出结论:起主要作用的是
的生成提高了Cu的还原性。对比实验ⅳ、ⅴ与ⅵ,昊昊得出结论:起主要作用的是_______ 。
通过以上实验, 既有氧化性又有还原性,条件改变会影响其性质。
既有氧化性又有还原性,条件改变会影响其性质。
 的性质,进行了下列实验。
的性质,进行了下列实验。[实验一]探究
 的还原性,波波做了下列实验:
的还原性,波波做了下列实验:| 实验 | ⅰ | ⅱ | ⅲ |
| 实验操作 | 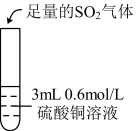 |  | 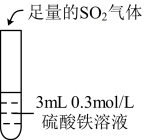 |
| 实验现象 | 无明显现象 | 通入 后溶液迅速变为棕色 后溶液迅速变为棕色 | 溶液迅速变成红棕色。两天后,溶液变浅绿色 |
假设一:c(H+)增大,提高了
 的氧化性或
的氧化性或 的还原性;
的还原性;假设二: c(Cl-)增大,降低了还原产物的浓度,提高了
 的氧化性。
的氧化性。小雨设计实验方案,确认假设一不正确,实验方案是
睿睿查阅资料:
 (白色沉淀)
(白色沉淀)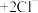 。
。设计实验方案,确认了假设二正确,实验方案是
(2)写出ⅱ中反应的离子方程式
(3)对比实验ⅱ与ⅲ,针对反应速率的差异,进行了以下探究:
瑛瑛进行理论预测:依据
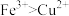 ,ⅲ的反应速率快于ⅱ的。
,ⅲ的反应速率快于ⅱ的。萌萌查阅资料:
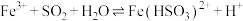 。
。结合资料,解释实验ⅱ与ⅲ的速率差异
[实验二]探究
 的氧化性,邹邹做了下列实验:
的氧化性,邹邹做了下列实验:| 实验 | ⅳ | ⅴ | ⅵ |
| 实验操作 | 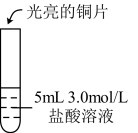 | 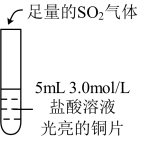 | 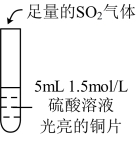 |
| 实验现象 | 无明显现象 | 光亮的紫红色铜片很快变暗,并有黑色沉淀生成,溶液变为棕色 | 无明显现象 |
 ,溶液中没有
,溶液中没有 。写出ⅴ中反应的离子方程式
。写出ⅴ中反应的离子方程式(5)反应ⅴ能发生,可能是因为Cu2S的生成提高了Cu的还原性或
 的氧化性,
的氧化性, 的生成提高了Cu的还原性。对比实验ⅳ、ⅴ与ⅵ,昊昊得出结论:起主要作用的是
的生成提高了Cu的还原性。对比实验ⅳ、ⅴ与ⅵ,昊昊得出结论:起主要作用的是通过以上实验,
 既有氧化性又有还原性,条件改变会影响其性质。
既有氧化性又有还原性,条件改变会影响其性质。
您最近一年使用:0次
2022-05-28更新
|
681次组卷
|
5卷引用:考点10 硫及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)
(已下线)考点10 硫及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)突破超重点 高效突破综合实验 实验4 创新探究实验热点1物质性质探究类实验(已下线)考点10 硫及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)北京市中国人民大学附属中学2022届高三下学期第三次适应性练习化学试题
解题方法
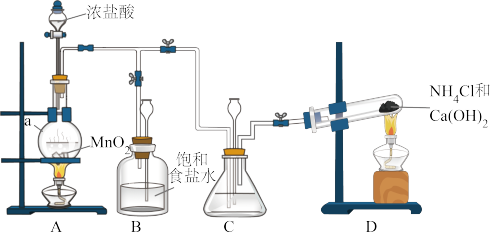
3 . 某小组用MnO2与浓盐酸混合共热制备氯气。
(1)反应的离子方程式是_______ 。
(2)为净化与收集Cl2,选用下图所示的部分装置进行实验,装置的接口连接顺序为_______ 。
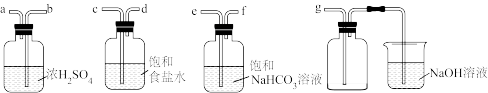
(3)当Cl2不再生成时,反应容器中仍存在MnO2和盐酸,该小组进行以下实验探究。
①实验任务 探究反应后的容器中仍存在MnO2和盐酸,却不再产生Cl2的原因。
②查阅资料 物质氧化性和还原性变化的一般规律是:还原反应中,增大反应物浓度或降低生成物浓度,氧化剂的氧化性增强;氧化反应中,增大反应物浓度或降低生成物浓度,还原剂的还原性增强。
③提出猜想 猜想a:在此反应中,随H+浓度降低,氧化剂_______ (填氧化剂化学式)氧化性减弱。
猜想b:在此反应中,_______ 减弱。
猜想c:在此反应中,随Mn2+浓度升高,氧化剂氧化性减弱。
④设计实验、验证猜想 向反应后的固液混合物中加入试剂,观察并记录有无氯气生成(Na+对各物质的氧化性与还原性均无影响)。请在答题线上完成表中内容。
⑤数据分析,得出结论 猜想a、猜想b和猜想c均正确。
⑥迁移应用 25℃时,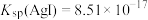 。一般情况下,在金属活动性顺序里,位于氢前面的金属能置换出酸中的氢,资料显示Ag也可以与HI发生置换反应生成H2,依据②中信息,可能的原因是:
。一般情况下,在金属活动性顺序里,位于氢前面的金属能置换出酸中的氢,资料显示Ag也可以与HI发生置换反应生成H2,依据②中信息,可能的原因是:_______ 。
(1)反应的离子方程式是
(2)为净化与收集Cl2,选用下图所示的部分装置进行实验,装置的接口连接顺序为
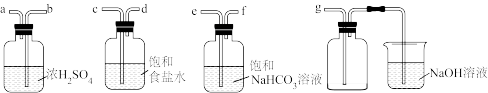
(3)当Cl2不再生成时,反应容器中仍存在MnO2和盐酸,该小组进行以下实验探究。
①实验任务 探究反应后的容器中仍存在MnO2和盐酸,却不再产生Cl2的原因。
②查阅资料 物质氧化性和还原性变化的一般规律是:还原反应中,增大反应物浓度或降低生成物浓度,氧化剂的氧化性增强;氧化反应中,增大反应物浓度或降低生成物浓度,还原剂的还原性增强。
③提出猜想 猜想a:在此反应中,随H+浓度降低,氧化剂
猜想b:在此反应中,
猜想c:在此反应中,随Mn2+浓度升高,氧化剂氧化性减弱。
④设计实验、验证猜想 向反应后的固液混合物中加入试剂,观察并记录有无氯气生成(Na+对各物质的氧化性与还原性均无影响)。请在答题线上完成表中内容。
| 实验序号 | 操作 | 有无氯气生成 |
| 1 | 加入较浓硫酸,使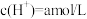 , ,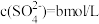 | 有氯气 |
| 2 | 加入NaCl固体,使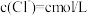 | 有氯气 |
| 3 | 无氯气 |
⑥迁移应用 25℃时,
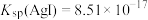 。一般情况下,在金属活动性顺序里,位于氢前面的金属能置换出酸中的氢,资料显示Ag也可以与HI发生置换反应生成H2,依据②中信息,可能的原因是:
。一般情况下,在金属活动性顺序里,位于氢前面的金属能置换出酸中的氢,资料显示Ag也可以与HI发生置换反应生成H2,依据②中信息,可能的原因是:
您最近一年使用:0次
名校
解题方法
4 . 某研究性学习小组设计下列实验探究Zn和FeCl3溶液的反应,回答下列问题:
(1)由FeCl3固体配制未酸化的250mL0.5mol·L-1FeCl3溶液(pH=1.3),不需要使用的实验仪器有___________ (从下列图中选择,写出名称)。

(2)将Zn投入到未酸化的0.5mol·L-1FeCl3溶液(pH=1.3)中,在不同的实验条件下,实验现象如表:
①实验中产生的气体为___________ ,实验ii中产生气体的速率明显快于实验i,可能的原因是___________ (答出两点)。
②“滴加铁氰化钾溶液后,可见蓝色沉淀”说明混合溶液中存在Fe2+。生成Fe2+的离子方程式为___________ 。
(3)实验i和ii均先有气体生成,后有溶液颜色的变化。研究性学习小组猜想,可能是此实验条件下,氧化性:H+>Fe3+。
①为了检验上述猜想是否正确,查阅资料:可利用标准电极电势(用φθ表示)判断氧化性、还原性强弱,且电极电势越小,还原剂的还原性越强,已知(溶液中离子浓度的影响在此忽略不计):φθ(Fe3+ /Fe2+)=0.77 V,φθ (2H+ /H2)=0 V,φθ (Fe2+ /Fe)=—0.417 V,φθ (Zn2+ /Zn) =—0.76 V。则Fe3+、H+、Zn2+、Fe2+的氧化性大小关系为___________ 。
②研究小组进一步分析后,将锌粒改为锌粉,继续进行实验:
对比实验iii和iv,实验iv中“气泡不明显,红褐色褪色明显”的原因可能为___________ 。
③结合实验探究过程及现象分析,影响Zn与FeCl3溶液反应的条件有___________ (答两点即可的)。
(1)由FeCl3固体配制未酸化的250mL0.5mol·L-1FeCl3溶液(pH=1.3),不需要使用的实验仪器有

(2)将Zn投入到未酸化的0.5mol·L-1FeCl3溶液(pH=1.3)中,在不同的实验条件下,实验现象如表:
| 实验编号 | 条件 | 现象 |
| i | 锌粒18℃ | 刚开始无明显气泡,0.5min后有气体产生,一段时间后,溶液颜色加深。向反应后的溶液中滴加铁氰化钾溶液后,可见蓝色沉淀 |
| ii | 锌粒65℃ | 产生气泡较快,大约12 s后,气泡非常明显,溶液很快转为红棕色。较长时间后发现红棕色基本消失,最后产生红棕色沉淀 |
②“滴加铁氰化钾溶液后,可见蓝色沉淀”说明混合溶液中存在Fe2+。生成Fe2+的离子方程式为
(3)实验i和ii均先有气体生成,后有溶液颜色的变化。研究性学习小组猜想,可能是此实验条件下,氧化性:H+>Fe3+。
①为了检验上述猜想是否正确,查阅资料:可利用标准电极电势(用φθ表示)判断氧化性、还原性强弱,且电极电势越小,还原剂的还原性越强,已知(溶液中离子浓度的影响在此忽略不计):φθ(Fe3+ /Fe2+)=0.77 V,φθ (2H+ /H2)=0 V,φθ (Fe2+ /Fe)=—0.417 V,φθ (Zn2+ /Zn) =—0.76 V。则Fe3+、H+、Zn2+、Fe2+的氧化性大小关系为
②研究小组进一步分析后,将锌粒改为锌粉,继续进行实验:
| 实验编号 | 条件 | 现象 |
| iii | 锌粉18℃ 不振荡 | 大约3min可以看到明显的气泡,溶液颜色逐渐变深。向反应后的溶液中滴加铁氰化钾溶液后,可见蓝色沉淀 |
| iv | 锌粉65℃ 振荡 | 气泡不明显,红褐色褪色明显。向反应后的溶液中滴加铁氰化钾溶液后,可见蓝色沉淀 |
③结合实验探究过程及现象分析,影响Zn与FeCl3溶液反应的条件有
您最近一年使用:0次
2022-01-19更新
|
1230次组卷
|
5卷引用:易错点06 铁及其化合物-备战2023年高考化学考试易错题
(已下线)易错点06 铁及其化合物-备战2023年高考化学考试易错题(已下线)专题六 金属元素及其化合物-实战高考·二轮复习核心突破福建省漳州市2022届高三毕业班第一次质量检测化学试题(已下线)一轮巩固卷8-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)福建省永安第九中学2022-2023学年高三上学期期中考试化学试题
名校
解题方法
5 . 实验表明,当乙醛加入到溴水中,溴水会褪色。针对此现象,某小组同学依据乙醛结构进行探究。
【实验假设】
(1)假设Ⅰ:醛基含有不饱和键,可与 发生
发生_________ 反应(填反应类型)。
假设Ⅱ:乙醛具有α-H,可与溴水发生取代反应。一元取代反应如下:

无论是几元取代,参加反应的 与生成的HBr物质的量之比为
与生成的HBr物质的量之比为_________ 。
假设Ⅲ:乙醛具有较强的还原性,可被溴水氧化为乙酸,补全下面反应方程式。
方案Ⅰ:通过对比反应现象判断反应类型。
结论:假设Ⅰ不成立。
(2)试管2中的实验现象为__________ 。
方案Ⅱ:通过测定反应后混合液的pH判断反应类型。
注:苯酚和乙酸的电离及温度变化对混合液pH的影响可忽略。
(3)写出苯酚与溴水反应的化学方程式:____________________________________ 。
(4)若试管2中反应后混合液的pH=1.85,则证明乙醛与溴水的反应类型为______ 反应;若pH接近______ ,则证明为氧化反应(lg2≈0.3);若pH介于两者之间,则证明两种反应类型皆有。
【实验结论与反思】
(5)根据实验数据得出结论:乙醛与溴水发生氧化反应。查阅资料,乙醛并非直接与 发生反应,而是与次溴酸(HBrO)反应,从平衡移动的角度解释乙醛使溴水褪色的原因:
发生反应,而是与次溴酸(HBrO)反应,从平衡移动的角度解释乙醛使溴水褪色的原因:______________ 。
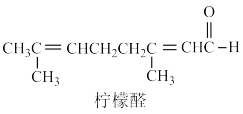
(6)已知柠檬醛的结构如图,结合上述实验,检验柠檬醛分子中存在碳碳双键的合理方法为 (填字母序号)。
【实验假设】
(1)假设Ⅰ:醛基含有不饱和键,可与
 发生
发生假设Ⅱ:乙醛具有α-H,可与溴水发生取代反应。一元取代反应如下:

无论是几元取代,参加反应的
 与生成的HBr物质的量之比为
与生成的HBr物质的量之比为假设Ⅲ:乙醛具有较强的还原性,可被溴水氧化为乙酸,补全下面反应方程式。

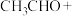



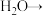



方案Ⅰ:通过对比反应现象判断反应类型。
序号 | 操作 | 现象 |
试管1 | 1mL溴水+1mL乙醛,充分振荡后静置 | 褪色 |
试管2 | 1mL溴的 溶液+1mL乙醛,充分振荡后静置 溶液+1mL乙醛,充分振荡后静置 | ____ |
(2)试管2中的实验现象为
方案Ⅱ:通过测定反应后混合液的pH判断反应类型。
序号 | 操作 | pH |
试管1 | 加入20mL溴水,再加入10mL苯酚溶液,待完全反应后(苯酚过量),测定混合液pH | 1.85 [ |
试管2 | 加入20mL相同浓度的溴水,再加入10mL 20%的乙醛溶液(乙醛过量),3min后完全褪色,测定混合液pH | ____________ |
(3)写出苯酚与溴水反应的化学方程式:
(4)若试管2中反应后混合液的pH=1.85,则证明乙醛与溴水的反应类型为
【实验结论与反思】
(5)根据实验数据得出结论:乙醛与溴水发生氧化反应。查阅资料,乙醛并非直接与
 发生反应,而是与次溴酸(HBrO)反应,从平衡移动的角度解释乙醛使溴水褪色的原因:
发生反应,而是与次溴酸(HBrO)反应,从平衡移动的角度解释乙醛使溴水褪色的原因:(6)已知柠檬醛的结构如图,结合上述实验,检验柠檬醛分子中存在碳碳双键的合理方法为 (填字母序号)。
| A.向酸性高锰酸钾溶液中加适量柠檬醛,观察其是否褪色 |
| B.向溴水中加适量柠檬醛,观察其是否褪色 |
C.向溴的 溶液中加适量柠檬醛,观察其是否褪色 溶液中加适量柠檬醛,观察其是否褪色 |
| D.向新制氢氧化铜悬浊液中加适量柠檬醛,加热,冷却后取上层清液再加溴水,观察其是否褪色 |
您最近一年使用:0次
2022-11-02更新
|
597次组卷
|
7卷引用:北京市海淀区2022届高三一模(实验探究题)
(已下线)北京市海淀区2022届高三一模(实验探究题)(已下线)T28-实验探究题北京市海淀区2022-2023学年高三上学期期中考试化学试题北京市第二中学2022-2023学年高三上学期12月考化学试题北京市第八中学2022-2023学年高二下学期期末考试化学试题北京理工大学附属中学2023-2024学年高二下学期期中考试化学试题 (已下线)题型突破02 有机实验(综合题)-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(北京专用)
6 . KMnO4是一种常用的氧化剂。某实验小组利用氯气氧化K2MnO4制备KMnO4并对其性质进行探究。
资料:①锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:3 +2H2O=2
+2H2O=2 +MnO2↓+4OH-
+MnO2↓+4OH-
②酸性条件下的氧化性:KMnO4>KIO3>I2
I.KMnO4的制备
(1)从A~D中选择合适的装置制备KMnO4,正确的连接顺序是a→______________ (按气流方向,用小写字母表示);装置A中m的作用是_______ 。

(2)若没有使用装置C,造成的影响是_______ 。
II.KMnO4性质探究
取适量制取的KMnO4溶液稀释至约0.01mol/L(用硫酸酸化至pH=1),取配制好的KMnO4溶液2mL于试管中,逐滴滴加0.1mol/LKI溶液,KMnO4紫色溶液迅速变为棕褐色悬浊液,然后沉淀逐渐消失,最终溶液变为棕黄色。
(3)最终溶液呈现棕黄色推测生成了_______ (写化学式)。
(4)实验小组对初始阶段的产物成分进行探究:

①黑色固体是MnO2,试剂X是_______ (写化学式)。
②在“紫色清液"中存在 ,写出生成
,写出生成 的离子方程式
的离子方程式_______ 。
③下列实验方案中,可用于检验“紫色清液"中是否存在 的是
的是_______ (填序号)。
A.用洁净的玻璃棒随取紫色清液滴在淀粉-KI试纸上,观察试纸是否变蓝色。
B.取少量紫色清液于试管中,向其中加入几滴淀粉溶液,溶液不变蓝,再加入过量NaHSO3溶液,观察溶液是否变色。
C.取少量紫色清液于试管中,向其中加入稀硝酸酸化,再加入几滴硝酸银溶液,观察是否生成黄色沉淀。
(5)探究实验II中棕褐色沉淀消失的原因:

用离子方程式解释步骤③中固体消失的原因_______ 。
(6)由上述实验可知,KMnO4的还原产物与_______ 有关。
资料:①锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:3
 +2H2O=2
+2H2O=2 +MnO2↓+4OH-
+MnO2↓+4OH-②酸性条件下的氧化性:KMnO4>KIO3>I2
I.KMnO4的制备
(1)从A~D中选择合适的装置制备KMnO4,正确的连接顺序是a→

(2)若没有使用装置C,造成的影响是
II.KMnO4性质探究
取适量制取的KMnO4溶液稀释至约0.01mol/L(用硫酸酸化至pH=1),取配制好的KMnO4溶液2mL于试管中,逐滴滴加0.1mol/LKI溶液,KMnO4紫色溶液迅速变为棕褐色悬浊液,然后沉淀逐渐消失,最终溶液变为棕黄色。
(3)最终溶液呈现棕黄色推测生成了
(4)实验小组对初始阶段的产物成分进行探究:

①黑色固体是MnO2,试剂X是
②在“紫色清液"中存在
 ,写出生成
,写出生成 的离子方程式
的离子方程式③下列实验方案中,可用于检验“紫色清液"中是否存在
 的是
的是A.用洁净的玻璃棒随取紫色清液滴在淀粉-KI试纸上,观察试纸是否变蓝色。
B.取少量紫色清液于试管中,向其中加入几滴淀粉溶液,溶液不变蓝,再加入过量NaHSO3溶液,观察溶液是否变色。
C.取少量紫色清液于试管中,向其中加入稀硝酸酸化,再加入几滴硝酸银溶液,观察是否生成黄色沉淀。
(5)探究实验II中棕褐色沉淀消失的原因:

用离子方程式解释步骤③中固体消失的原因
(6)由上述实验可知,KMnO4的还原产物与
您最近一年使用:0次
2022-05-03更新
|
933次组卷
|
5卷引用:专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)
(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)(已下线)专题17 化学实验综合题-三年(2020-2022)高考真题分项汇编(已下线)第3讲 氧化还原反应广东省韶关市2022届高三综合测试(二模)化学试题福建省宁德市五校教学联合体2023届高三一模考试化学试题
7 . 某兴趣小组同学探究 酸性溶液与草酸
酸性溶液与草酸 溶液反应速率的影响因素。将
溶液反应速率的影响因素。将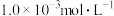 的
的 酸性溶液与
酸性溶液与 草酸溶液按如下比例混合。
草酸溶液按如下比例混合。
【设计实验】
(1)补全 酸性溶液与草酸溶液反应的离子方程式:
酸性溶液与草酸溶液反应的离子方程式:_______ 。

(2)实验①和②的目的是_______ 。
【进行实验】
小组同学进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
Ⅰ.紫色溶液变为青色溶液;Ⅱ.青色溶液逐渐褪至无色溶液。
【查阅资料】
a. 酸性溶液与草酸溶液的反应主要包含如下几个过程:
酸性溶液与草酸溶液的反应主要包含如下几个过程:
反应ⅰ.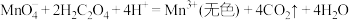
反应ⅱ.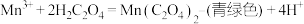
反应ⅲ。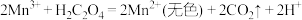
b. 的氧化性较弱,在本实验条件下不能氧化
的氧化性较弱,在本实验条件下不能氧化 。
。
c. 呈绿色,在酸性条件下不稳定,迅速分解为
呈绿色,在酸性条件下不稳定,迅速分解为 和
和 。
。
【继续探究】
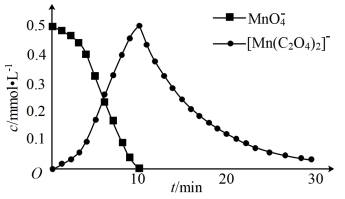
进一步实验证明溶液中含有 ,实验①反应过程中
,实验①反应过程中 和
和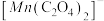 的浓度随时间的变化如下图。
的浓度随时间的变化如下图。
【解释与反思】
(3)本实验中,化学反应速率:反应ⅱ_______ 反应ⅲ(填“>”、“=”或“<”)。
(4)小组同学认为反应ⅱ的离子方程式应该改为: ,结合实验现象,说明其理由
,结合实验现象,说明其理由_______ 。
 酸性溶液与草酸
酸性溶液与草酸 溶液反应速率的影响因素。将
溶液反应速率的影响因素。将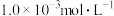 的
的 酸性溶液与
酸性溶液与 草酸溶液按如下比例混合。
草酸溶液按如下比例混合。【设计实验】
| 序号 | V( 酸性溶液)/ 酸性溶液)/ | V(草酸溶液)/ | 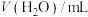 | 反应温度/ |
| ① | 2.0 | 2.0 | 0 | 20 |
| ② | 2.0 | 1.0 | 1.0 | 20 |
 酸性溶液与草酸溶液反应的离子方程式:
酸性溶液与草酸溶液反应的离子方程式:
(2)实验①和②的目的是
【进行实验】
小组同学进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
Ⅰ.紫色溶液变为青色溶液;Ⅱ.青色溶液逐渐褪至无色溶液。
【查阅资料】
a.
 酸性溶液与草酸溶液的反应主要包含如下几个过程:
酸性溶液与草酸溶液的反应主要包含如下几个过程:反应ⅰ.
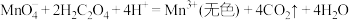
反应ⅱ.
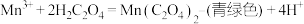
反应ⅲ。
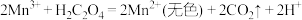
b.
 的氧化性较弱,在本实验条件下不能氧化
的氧化性较弱,在本实验条件下不能氧化 。
。c.
 呈绿色,在酸性条件下不稳定,迅速分解为
呈绿色,在酸性条件下不稳定,迅速分解为 和
和 。
。【继续探究】
进一步实验证明溶液中含有
 ,实验①反应过程中
,实验①反应过程中 和
和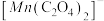 的浓度随时间的变化如下图。
的浓度随时间的变化如下图。
【解释与反思】
(3)本实验中,化学反应速率:反应ⅱ
(4)小组同学认为反应ⅱ的离子方程式应该改为:
 ,结合实验现象,说明其理由
,结合实验现象,说明其理由
您最近一年使用:0次
名校
解题方法
8 . 某兴趣小组同学探究KMnO4溶液与草酸(H2C2O4)溶液反应速率的影响因素。配制1.0×10-3mol/LKMnO4溶液、0.40mol/L草酸溶液。将KMnO4溶液与草酸溶液按如下比例混合。
【设计实验】
(1)实验①和②的目的是___________ 。
(2)甲认为上述实验应控制pH相同,可加入的试剂是___________ (填序号)。
a.盐酸 b.硫酸 c.草酸
【实施实验】
小组同学将溶液pH调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
i.紫色溶液转变为青色溶液,ii.青色溶液逐渐褪至无色溶液。
资料:(a) 无色,在草酸中不能形成配合物;
无色,在草酸中不能形成配合物;
(b) 无色,有强氧化性,发生反应
无色,有强氧化性,发生反应 (青绿色)后氧化性减弱;
(青绿色)后氧化性减弱;
(c) 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。
(3)乙同学从氧化还原角度推测阶段i中可能产生 ,你认为该观点是否合理,并说明理由:
,你认为该观点是否合理,并说明理由:___________ 。
【继续探究】
进一步实验证明溶液中含有 ,反应过程中
,反应过程中 和
和 浓度随时间的变化如下图。
浓度随时间的变化如下图。
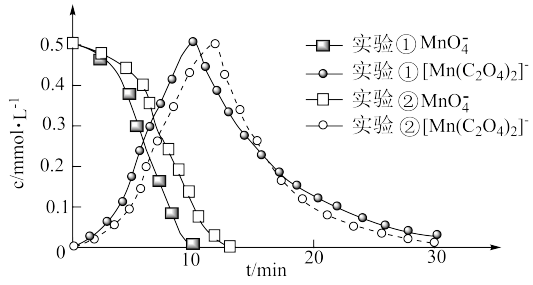
(4)第i阶段中检测到有 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为___________ 。
(5)实验②在第ii阶段的反应速率较大,可能的原因是___________ 。
(6)据此推测,若在第ii阶段将 调节至
调节至 ,溶液褪至无色的时间会
,溶液褪至无色的时间会___________ (填“增加”“减少”或“不变”)。
【结论与反思】
(7)上述实验涉及的反应中,草酸的作用是___________ 。
结论:反应可能是分阶段进行的。草酸浓度的改变对不同阶段反应速率的影响可能不同。
【设计实验】
| 序号 | 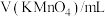 | 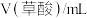 | 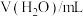 | 反应温度/℃ |
| ① | 2.0 | 2.0 | 0 | 20 |
| ② | 2.0 | 1.0 | 1.0 | 20 |
(2)甲认为上述实验应控制pH相同,可加入的试剂是
a.盐酸 b.硫酸 c.草酸
【实施实验】
小组同学将溶液pH调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
i.紫色溶液转变为青色溶液,ii.青色溶液逐渐褪至无色溶液。
资料:(a)
 无色,在草酸中不能形成配合物;
无色,在草酸中不能形成配合物;(b)
 无色,有强氧化性,发生反应
无色,有强氧化性,发生反应 (青绿色)后氧化性减弱;
(青绿色)后氧化性减弱;(c)
 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。(3)乙同学从氧化还原角度推测阶段i中可能产生
 ,你认为该观点是否合理,并说明理由:
,你认为该观点是否合理,并说明理由:【继续探究】
进一步实验证明溶液中含有
 ,反应过程中
,反应过程中 和
和 浓度随时间的变化如下图。
浓度随时间的变化如下图。
(4)第i阶段中检测到有
 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为(5)实验②在第ii阶段的反应速率较大,可能的原因是
(6)据此推测,若在第ii阶段将
 调节至
调节至 ,溶液褪至无色的时间会
,溶液褪至无色的时间会【结论与反思】
(7)上述实验涉及的反应中,草酸的作用是
结论:反应可能是分阶段进行的。草酸浓度的改变对不同阶段反应速率的影响可能不同。
您最近一年使用:0次
2022-04-01更新
|
1379次组卷
|
8卷引用:超重点8 碳酸盐、草酸盐的创新考查
超重点8 碳酸盐、草酸盐的创新考查(已下线)北京市海淀区2022届高三一模(实验探究题)北京市海淀区2022届高三一模化学试题(已下线)必刷卷03-2022年高考化学考前信息必刷卷(河北专用)北京市第二中学2022-2023学年高二上学期10月月考化学试题北京第一零一中学2023届高三10月月考化学试题北京市第二十中学2022-2023学年高三上学期12月月考化学试题北京师范大学附属中学2022-2023学年高二上学期10月月考化学试题
名校
解题方法
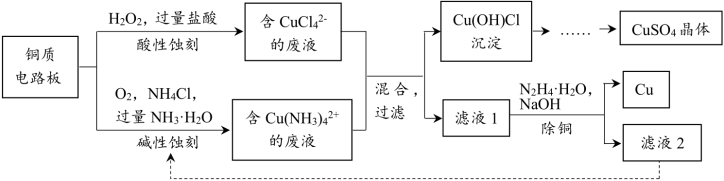
9 . 铜质电路板可采用酸性蚀刻与碱性蚀刻两种方法。将二者的废液混合可实现回收再利用。其主要流程如图:
已知:①水合肼N2H4·H2O具有强还原性,易被氧化为N2
②Cu2++4NH3 Cu(NH3)
Cu(NH3)
(1)蚀刻
①酸性蚀刻铜的离子方程式:___________
②关于蚀刻的下列说法正确的是___________ 。
A.碱性蚀刻和酸性蚀刻分别利用了O2、H2O2的氧化性
B.酸性蚀刻时盐酸的主要作用是增强溶液的酸性
C.用H2O2、H2SO4、NaCl也可以使Cu溶解
(2)滤液1的pH约为5,其中除少量Cu2+外,还大量存在的离子是___________ 。
(3)除铜
①利用水合肼N2H4·H2O还原Cu2+的离子方程式是___________ 。
②已知该反应瞬间完成。滤渣成分只有Cu。测得铜去除率、水合肼还原能力随溶液pH的变化情况如图所示。由图可知。随溶液pH增大,铜去除率先增加后减小,结合图给值息和已知信息分析其原因:___________ 。

已知:①水合肼N2H4·H2O具有强还原性,易被氧化为N2
②Cu2++4NH3
 Cu(NH3)
Cu(NH3)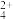
(1)蚀刻
①酸性蚀刻铜的离子方程式:
②关于蚀刻的下列说法正确的是
A.碱性蚀刻和酸性蚀刻分别利用了O2、H2O2的氧化性
B.酸性蚀刻时盐酸的主要作用是增强溶液的酸性
C.用H2O2、H2SO4、NaCl也可以使Cu溶解
(2)滤液1的pH约为5,其中除少量Cu2+外,还大量存在的离子是
(3)除铜
①利用水合肼N2H4·H2O还原Cu2+的离子方程式是
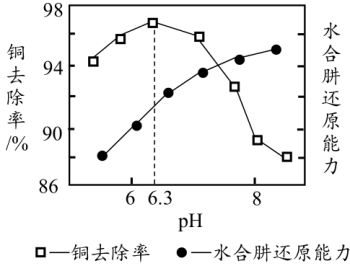
②已知该反应瞬间完成。滤渣成分只有Cu。测得铜去除率、水合肼还原能力随溶液pH的变化情况如图所示。由图可知。随溶液pH增大,铜去除率先增加后减小,结合图给值息和已知信息分析其原因:

您最近一年使用:0次
2021-11-27更新
|
481次组卷
|
3卷引用:解密06 金属及其化合物(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)
(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)黑龙江省牡丹江市第一高级中学2021-2022学年高三上学期期中考试化学试题宁夏石嘴山市平罗中学2022-2023学年高三上学期期中考试(重点班)化学试题
名校
10 . 某小组在实验室用NaClO溶液和NH3反应制备N2H4,并进行相关的性质探究实验。
Ⅰ.制备N2H4
(1)仪器a的名称是___________ 。
(2)装置C中盛放的试剂是___________ 。装置B的作用是___________ 。
(3)制备N2H4的离子方程式为___________ 。
Ⅱ.测定产品中水合肼(N2H4 · H2O)的含量
(4)称取产品6.0 g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右), 加水配成250 mL溶液,移取25.00 mL置于锥形瓶中,并滴加2 ~ 3滴淀粉溶液,用 0.3000 mol • L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2 =N2↑ +4HI+H2O)。
①滴定到达终点的现象是___________ 。
②实验测得消耗碘标准溶液的平均值为20.00 mL,产品中水合腓的质量分数为___________ 。
Ⅲ.探究的还原性与碱性。将制得的耕分离提纯后,进行如图实验。

【查阅资料]AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如下方案,进行实验。
(5)请完成表中的空白部分:①___________ ;②___________ 。
(6)实验表明,黑色固体主要成分是Ag,还有少量氧化银,请解释原因:___________ 。
Ⅰ.制备N2H4

(1)仪器a的名称是
(2)装置C中盛放的试剂是
(3)制备N2H4的离子方程式为
Ⅱ.测定产品中水合肼(N2H4 · H2O)的含量
(4)称取产品6.0 g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右), 加水配成250 mL溶液,移取25.00 mL置于锥形瓶中,并滴加2 ~ 3滴淀粉溶液,用 0.3000 mol • L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2 =N2↑ +4HI+H2O)。
①滴定到达终点的现象是
②实验测得消耗碘标准溶液的平均值为20.00 mL,产品中水合腓的质量分数为
Ⅲ.探究的还原性与碱性。将制得的耕分离提纯后,进行如图实验。

【查阅资料]AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如下方案,进行实验。
| 操作 | 现象 | 实验结论 |
| i.取少量黑色固体于试管中,加入适量①_________ | 黑色固体部分溶解 | 黑色固体有Ag2O |
| ii.取少量黑色固体于试管中加入足量稀硝酸,振荡 | ②_________ | 黑色固体是Ag和Ag2O |
(6)实验表明,黑色固体主要成分是Ag,还有少量氧化银,请解释原因:
您最近一年使用:0次
2022-03-29更新
|
833次组卷
|
6卷引用:专题17化学实验综合题-三年(2020~2022)高考真题汇编(全国卷)
(已下线)专题17化学实验综合题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16化学实验综合题-2022年高考真题+模拟题汇编(全国卷)(已下线)专题17化学实验综合题-五年(2018~2022)高考真题汇编(全国卷)山西省太原市2022届高三下学期模拟考试(一模)理科综合化学试题四川省绵阳南山中学2022-2023学年高三上学期入学考试理综化学试题四川省绵阳市高中2022-2023学年高二下学期理科突击班6月月考化学试题

 ]
]

