名校
解题方法
1 . 移取20.00 两种一元弱酸
两种一元弱酸 和
和 的混合溶液,滴加0.1
的混合溶液,滴加0.1 的
的 至反应终点,消耗25
至反应终点,消耗25 。再取相同的上述溶液,加入50
。再取相同的上述溶液,加入50 ,0.02
,0.02
 的强碱性溶液,待其反应完成后,将溶液酸化,加入30
的强碱性溶液,待其反应完成后,将溶液酸化,加入30 0.2
0.2
 溶液,将剩余的
溶液,将剩余的 和
和 歧化生成的
歧化生成的 和
和 全部还原至
全部还原至 ,剩余的
,剩余的 溶液用上述
溶液用上述 溶液在酸性条件下反应至终点消耗18.5
溶液在酸性条件下反应至终点消耗18.5 。
。
已知:
① 在强碱性条件下还原产物为
在强碱性条件下还原产物为 ;
; 在酸性条件发生歧化反应;
在酸性条件发生歧化反应;
② 具有还原性,酸性条件下被氧化为
具有还原性,酸性条件下被氧化为 ,
, 不能被酸性高锰酸钾氧化
不能被酸性高锰酸钾氧化
(1)加入 的强碱性溶液发生的有电子转移的离子反应方程式为
的强碱性溶液发生的有电子转移的离子反应方程式为_______ 。
(2)酸化后 歧化发生离子反应方程式为
歧化发生离子反应方程式为_______ 。
(3)加入 溶液后发生反应的离子方程式为
溶液后发生反应的离子方程式为_______ 。
(4)则溶液中的 的浓度为
的浓度为_______ ; 的浓度为
的浓度为_______ 。
(5)若溶液酸化后将 过滤除掉,其它操作不变,则测得的
过滤除掉,其它操作不变,则测得的 浓度将
浓度将_______ (填“偏大”、“偏小”或“不变”)。
 两种一元弱酸
两种一元弱酸 和
和 的混合溶液,滴加0.1
的混合溶液,滴加0.1 的
的 至反应终点,消耗25
至反应终点,消耗25 。再取相同的上述溶液,加入50
。再取相同的上述溶液,加入50 ,0.02
,0.02
 的强碱性溶液,待其反应完成后,将溶液酸化,加入30
的强碱性溶液,待其反应完成后,将溶液酸化,加入30 0.2
0.2
 溶液,将剩余的
溶液,将剩余的 和
和 歧化生成的
歧化生成的 和
和 全部还原至
全部还原至 ,剩余的
,剩余的 溶液用上述
溶液用上述 溶液在酸性条件下反应至终点消耗18.5
溶液在酸性条件下反应至终点消耗18.5 。
。已知:
①
 在强碱性条件下还原产物为
在强碱性条件下还原产物为 ;
; 在酸性条件发生歧化反应;
在酸性条件发生歧化反应;②
 具有还原性,酸性条件下被氧化为
具有还原性,酸性条件下被氧化为 ,
, 不能被酸性高锰酸钾氧化
不能被酸性高锰酸钾氧化(1)加入
 的强碱性溶液发生的有电子转移的离子反应方程式为
的强碱性溶液发生的有电子转移的离子反应方程式为(2)酸化后
 歧化发生离子反应方程式为
歧化发生离子反应方程式为(3)加入
 溶液后发生反应的离子方程式为
溶液后发生反应的离子方程式为(4)则溶液中的
 的浓度为
的浓度为 的浓度为
的浓度为(5)若溶液酸化后将
 过滤除掉,其它操作不变,则测得的
过滤除掉,其它操作不变,则测得的 浓度将
浓度将
您最近一年使用:0次
名校
2 . Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是___________________ (填化学式),被2molFeSO4还原的过氧化钠为_________ mol
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO 、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:__________________________
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1molFeI2和2molFeBr2的溶液中通入2molCl2,此时被氧化的离子是____________ ,被氧化的离子的物质的量分别是_____________________________________________
(2)若向含amolFeI2和bmolFeBr2的溶液中通入cmolCl2,当I-、Fe2+被氧化时,c为_____________ (用含a、b的代数式表示)。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO
 、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1molFeI2和2molFeBr2的溶液中通入2molCl2,此时被氧化的离子是
(2)若向含amolFeI2和bmolFeBr2的溶液中通入cmolCl2,当I-、Fe2+被氧化时,c为
您最近一年使用:0次
2018-12-10更新
|
534次组卷
|
2卷引用:吉林省白城市第一中学2018-2019学年高一上学期期中考试化学试题
真题
名校
3 . 臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧: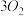


(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为______ g/mol(保留一位小数)。
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为_____________ L。
(3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g。则原混合气中臭氧的体积分数为__________________ 。
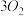


(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为
(3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g。则原混合气中臭氧的体积分数为
您最近一年使用:0次
2019-01-30更新
|
1437次组卷
|
16卷引用:吉林省白城市第一中学2018-2019学年高二6月月考化学试题
吉林省白城市第一中学2018-2019学年高二6月月考化学试题2009年普通高等学校招生统一考试化学试题(上海卷)2009高考真题汇编—氧族元素,环境保护2009高考真题汇编-化学计算(已下线)2011-2012学年武汉二中高一上学期期中考试化学试卷(已下线)2011-2012学年甘肃省天水一中高二第二学段测试化学试卷(已下线)2013-2014学年湖北省武汉二中高一上学期期中考试化学试卷(已下线)2014年高考化学一轮复习课后规范训练1-2练习卷(已下线)2013-2014学年河南省内黄一中高一上学期第一次月考化学试卷2015-2016学年天津市蓟县高一上学期期中化学试卷2018版化学(苏教版)高考总复习专题一课时跟踪训练:物质的量 气体摩尔体积(已下线)2019高考备考一轮复习精品资料 第一章 从实验学化学 第1讲 物质的量、气体摩尔体积【押题专练】(已下线)【备战2019年浙江新高考-考点】——考点02 物质的量(已下线)2019高考热点题型和提分秘籍 第一章 物质的量 第1讲 物质的量 气体摩尔体积( 题型专练)内蒙古赤峰二中人教版高中化学必修1练习:化学计量及其应用(3)(已下线)上海虹口区2011届高三一模化学试题
解题方法
4 . (1)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈________ (填“酸性”“中性”或“碱性”)。
(2)25℃时,将m mol·L-1的醋酸 和n mol·L-1的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中c(CH3COO-)+c(CH3COOH)=
和n mol·L-1的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中c(CH3COO-)+c(CH3COOH)=________ ,m与n的大小关系是m________ n(填“>”“=”或“<”)。
(2)25℃时,将m mol·L-1的醋酸
 和n mol·L-1的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中c(CH3COO-)+c(CH3COOH)=
和n mol·L-1的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中c(CH3COO-)+c(CH3COOH)=
您最近一年使用:0次



