名校
1 . 3.84g Fe和Fe2O3的混合物溶于100mL某浓度的盐酸中,恰好使混合物溶解,生成0.03mol H2,向反应后的溶液中加入KSCN检验,溶液无明显现象,设HCl无挥发,反应后溶液的体积不变.(已知:氧化性Fe3+>H+,还原性Fe>Cl﹣)
(1)求原混合物中Fe和Fe2O3的物质的量分别为多少?
(2)求反应后Cl﹣的物质的量浓度?
(1)求原混合物中Fe和Fe2O3的物质的量分别为多少?
(2)求反应后Cl﹣的物质的量浓度?
您最近一年使用:0次
2018-01-17更新
|
265次组卷
|
2卷引用:四川师范大学附属中学2020-2021学年高一上学期12月月考化学试题
名校
2 . Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是___________________ (填化学式),被2molFeSO4还原的过氧化钠为_________ mol
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO 、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:__________________________
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1molFeI2和2molFeBr2的溶液中通入2molCl2,此时被氧化的离子是____________ ,被氧化的离子的物质的量分别是_____________________________________________
(2)若向含amolFeI2和bmolFeBr2的溶液中通入cmolCl2,当I-、Fe2+被氧化时,c为_____________ (用含a、b的代数式表示)。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO
 、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1molFeI2和2molFeBr2的溶液中通入2molCl2,此时被氧化的离子是
(2)若向含amolFeI2和bmolFeBr2的溶液中通入cmolCl2,当I-、Fe2+被氧化时,c为
您最近一年使用:0次
2018-12-10更新
|
534次组卷
|
2卷引用:四川省攀枝花市第十五中学2019-2020学年高一上学期期中考试化学试题
解题方法
3 . 3.84 g Fe和Fe2O3的混合物溶于100 mL某浓度的盐酸中,恰好使混合物溶解,生成0.03 mol H2,向反应后的溶液中加入KSCN检验,溶液无明显现象,设HCl无挥发,反应后溶液的体积不变。(已知:氧化性Fe3+>H+,还原性Fe>Cl-)
(1)求标准状况下生成氢气的体积______ ?
(2)求反应后Cl-的物质的量浓度_______ ?
(1)求标准状况下生成氢气的体积
(2)求反应后Cl-的物质的量浓度
您最近一年使用:0次
解题方法
4 . 次氯酸 具有强氧化性,能起到杀菌消毒的作用。实验室制备
具有强氧化性,能起到杀菌消毒的作用。实验室制备 的反应原理为
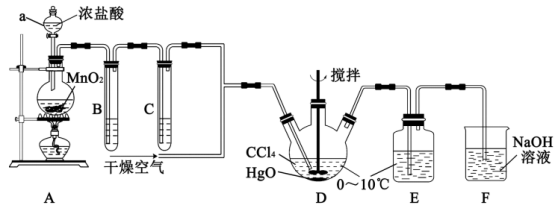
的反应原理为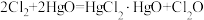 ,其制备装置如图所示,E中得到次氯酸
,其制备装置如图所示,E中得到次氯酸 。回答下列问题:
。回答下列问题:
已知:① 气体
气体 时可分解,且可与水反应生成
时可分解,且可与水反应生成 ;
;
②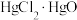 是难溶于水的固体。
是难溶于水的固体。
(1)仪器a的名称是___________ 。写出装置A中反应的离子方程式___________ 。
(2)装置B的作用是___________ ,装置C中盛装的试剂是___________ 。
(3)D中通入 与
与 反应制得
反应制得 ,则E中生成
,则E中生成 的化学反应方程式为
的化学反应方程式为___________ 。
(4)有效含氯量常用来衡量消毒剂的消毒能力,用 标准溶液滴定法测定某市售含氯消毒片的有效氯含量,实验步骤如下:
标准溶液滴定法测定某市售含氯消毒片的有效氯含量,实验步骤如下:
①称取含氯消毒片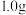 ,用容量瓶配制成
,用容量瓶配制成 溶液,定容时,用
溶液,定容时,用___________ 加蒸馏水至刻度线;
②配置 溶液及浓度标定:称取
溶液及浓度标定:称取 晶体
晶体 于烧杯中,取
于烧杯中,取 蒸馏水溶解均匀,转入
蒸馏水溶解均匀,转入___________ 色试剂瓶中,置于暗处放置7~14天后,用酸性 标准溶液标定上述
标准溶液标定上述 溶液的浓度为
溶液的浓度为 ;
;
③用滴定管量取 待测消毒溶液,置于
待测消毒溶液,置于 碘量瓶中,加入
碘量瓶中,加入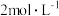 的硫酸
的硫酸 ,10%碘化钾溶液
,10%碘化钾溶液 ,此时溶液出现棕色,用
,此时溶液出现棕色,用 溶液滴定游离碘,边滴边摇匀,待溶液呈浅棕黄色时,加入1~2滴10%淀粉指示剂,继续滴定至
溶液滴定游离碘,边滴边摇匀,待溶液呈浅棕黄色时,加入1~2滴10%淀粉指示剂,继续滴定至___________ 即为终点。记录消耗的 溶液的体积;
溶液的体积;
④重复上述操作三次。四次测定的数据如下表:
根据 溶液的用量,计算消毒片的有效氯含量,已知
溶液的用量,计算消毒片的有效氯含量,已知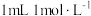 的硫代硫酸钠相当于
的硫代硫酸钠相当于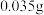 有效氯,则该市售含氯消毒片的有效氯含量为
有效氯,则该市售含氯消毒片的有效氯含量为___________ %。
 具有强氧化性,能起到杀菌消毒的作用。实验室制备
具有强氧化性,能起到杀菌消毒的作用。实验室制备 的反应原理为
的反应原理为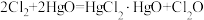 ,其制备装置如图所示,E中得到次氯酸
,其制备装置如图所示,E中得到次氯酸 。回答下列问题:
。回答下列问题:
已知:①
 气体
气体 时可分解,且可与水反应生成
时可分解,且可与水反应生成 ;
;②
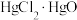 是难溶于水的固体。
是难溶于水的固体。(1)仪器a的名称是
(2)装置B的作用是
(3)D中通入
 与
与 反应制得
反应制得 ,则E中生成
,则E中生成 的化学反应方程式为
的化学反应方程式为(4)有效含氯量常用来衡量消毒剂的消毒能力,用
 标准溶液滴定法测定某市售含氯消毒片的有效氯含量,实验步骤如下:
标准溶液滴定法测定某市售含氯消毒片的有效氯含量,实验步骤如下:①称取含氯消毒片
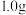 ,用容量瓶配制成
,用容量瓶配制成 溶液,定容时,用
溶液,定容时,用②配置
 溶液及浓度标定:称取
溶液及浓度标定:称取 晶体
晶体 于烧杯中,取
于烧杯中,取 蒸馏水溶解均匀,转入
蒸馏水溶解均匀,转入 标准溶液标定上述
标准溶液标定上述 溶液的浓度为
溶液的浓度为 ;
;③用滴定管量取
 待测消毒溶液,置于
待测消毒溶液,置于 碘量瓶中,加入
碘量瓶中,加入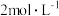 的硫酸
的硫酸 ,10%碘化钾溶液
,10%碘化钾溶液 ,此时溶液出现棕色,用
,此时溶液出现棕色,用 溶液滴定游离碘,边滴边摇匀,待溶液呈浅棕黄色时,加入1~2滴10%淀粉指示剂,继续滴定至
溶液滴定游离碘,边滴边摇匀,待溶液呈浅棕黄色时,加入1~2滴10%淀粉指示剂,继续滴定至 溶液的体积;
溶液的体积;④重复上述操作三次。四次测定的数据如下表:
| 实验序号 | 1 | 2 | 3 | 4 |
消耗 溶液的体积/ 溶液的体积/ | 20.05 | 20.00 | 19.95 | 20.45 |
 溶液的用量,计算消毒片的有效氯含量,已知
溶液的用量,计算消毒片的有效氯含量,已知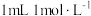 的硫代硫酸钠相当于
的硫代硫酸钠相当于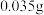 有效氯,则该市售含氯消毒片的有效氯含量为
有效氯,则该市售含氯消毒片的有效氯含量为
您最近一年使用:0次
5 . 将21.6g生锈的铁粉(铁锈主要成分为Fe2O3·xH2O)放入200mL3.5mol/L的盐酸中,完全溶解后产生气体3.36L(标准状况),向反应后的溶液中滴入几滴KSCN溶液,溶液无明显现象,再向溶液中加入NaHCO3至溶液pH=7,又产生气体2.24L(标准状况)。已知:氧化性Fe3+>H+,回答下列问题:
(1)写出铁粉溶解过程中氧化还原反应的离子方程式:___________ 。
(2)反应产生的前后两种气体质量之比为___________ 。
(3)计算生锈铁粉中铁元素的质量分数(无计算过程不给分)___________ 。
(1)写出铁粉溶解过程中氧化还原反应的离子方程式:
(2)反应产生的前后两种气体质量之比为
(3)计算生锈铁粉中铁元素的质量分数(无计算过程不给分)
您最近一年使用:0次
2022-01-20更新
|
414次组卷
|
2卷引用:四川省绵阳市2021-2022学年高一上学期期末考试化学试题
解题方法
6 . 回答下列问题:
(1)已知100℃时,水的离子积常数为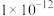 ,该温度下,有pH=11的NaOH溶液100mL,要使它的pH变为10(体积变化忽略不计):
,该温度下,有pH=11的NaOH溶液100mL,要使它的pH变为10(体积变化忽略不计):
①如果加入蒸馏水,应加___________ mL;
②如果加入pH=9的NaOH溶液,应加___________ mL;
③如果加入0.01 的盐酸,应加
的盐酸,应加___________ mL。
(2)在t℃时,测得0.01 NaOH溶液的pH=11,0.1
NaOH溶液的pH=11,0.1 的HA溶液中
的HA溶液中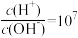 。回答下列问题:
。回答下列问题:
①该温度下,水的离子积常数Kw=___________ ;
②该温度下,0.1 的HA溶液中由水电离出的c(H+)=
的HA溶液中由水电离出的c(H+)=___________  。
。
(3)①明矾溶液呈___________ (填“酸性”“中性”或“碱性”),原因是___________ (用离子方程式表示);
②将氯化铁溶液蒸干灼烧得到的固体物质是___________ (填化学式)。
(1)已知100℃时,水的离子积常数为
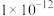 ,该温度下,有pH=11的NaOH溶液100mL,要使它的pH变为10(体积变化忽略不计):
,该温度下,有pH=11的NaOH溶液100mL,要使它的pH变为10(体积变化忽略不计):①如果加入蒸馏水,应加
②如果加入pH=9的NaOH溶液,应加
③如果加入0.01
 的盐酸,应加
的盐酸,应加(2)在t℃时,测得0.01
 NaOH溶液的pH=11,0.1
NaOH溶液的pH=11,0.1 的HA溶液中
的HA溶液中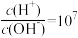 。回答下列问题:
。回答下列问题:①该温度下,水的离子积常数Kw=
②该温度下,0.1
 的HA溶液中由水电离出的c(H+)=
的HA溶液中由水电离出的c(H+)= 。
。(3)①明矾溶液呈
②将氯化铁溶液蒸干灼烧得到的固体物质是
您最近一年使用:0次
2017高一·全国·课时练习
7 . HIO4主要以H5IO6形式存在,H5IO6是白色晶体,易溶于水,具有很强的氧化性,在强酸溶液中能氧化Mn2+。
(1)请完成并配平下列离子反应。
__________ Mn2++________ H5IO6
__________  +
+________ 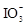 +
+________ H++________
(2)根据以上离子方程式判断H5IO6是________ 电离物质(填“易”或“难”)。
(3)上述反应,被氧化的元素是________ (填元素符号),当1 mol Mn2+参加反应时,转移电子的物质的量为________ 。
(1)请完成并配平下列离子反应。

 +
+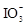 +
+(2)根据以上离子方程式判断H5IO6是
(3)上述反应,被氧化的元素是
您最近一年使用:0次
2017-09-17更新
|
1166次组卷
|
5卷引用:四川省南充市西充中学2020-2021学年高一上学期9月月考化学试题



