解题方法
1 . 铝是中学化学学习阶段的唯一一种既能与酸(非氧化性酸)反应又能与强碱溶液反应放出 的金属,就铝的这一特殊性质,回答下列问题:
的金属,就铝的这一特殊性质,回答下列问题:
(1)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得 的体积之比是
的体积之比是___________ 。
(2)足量的两份铝分别投入到等体积、等物质的量浓度的盐酸和氢氧化钠溶液中,产生 的体积之比是
的体积之比是___________ 。
(3)足量的两份铝分别投入到等体积、一定物质的量浓度的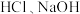 溶液中,二者产生的
溶液中,二者产生的 相等,则
相等,则 和
和 的物质的量浓度之比是
的物质的量浓度之比是___________ 。
(4)甲、乙两烧杯中各盛有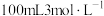 的盐酸和
的盐酸和 溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为
溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为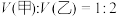 ,则加入铝粉的质量为___________(填字母)。
,则加入铝粉的质量为___________(填字母)。
 的金属,就铝的这一特殊性质,回答下列问题:
的金属,就铝的这一特殊性质,回答下列问题:(1)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得
 的体积之比是
的体积之比是(2)足量的两份铝分别投入到等体积、等物质的量浓度的盐酸和氢氧化钠溶液中,产生
 的体积之比是
的体积之比是(3)足量的两份铝分别投入到等体积、一定物质的量浓度的
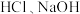 溶液中,二者产生的
溶液中,二者产生的 相等,则
相等,则 和
和 的物质的量浓度之比是
的物质的量浓度之比是(4)甲、乙两烧杯中各盛有
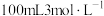 的盐酸和
的盐酸和 溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为
溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为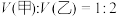 ,则加入铝粉的质量为___________(填字母)。
,则加入铝粉的质量为___________(填字母)。A.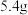 | B.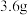 | C.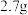 | D.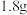 |
您最近一年使用:0次
2023-02-09更新
|
238次组卷
|
10卷引用:2016-2017学年吉林长春外国语学校高一上期末理化学卷
2016-2017学年吉林长春外国语学校高一上期末理化学卷(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第2讲 镁、铝及其重要化合物【教学案】(已下线)专题3.2 铝及其重要化合物(讲)——2020年高考化学一轮复习讲练测(已下线)3.2.2 物质的量在化学方程式计算中的应用(精练)-2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)(已下线)考点15 铝及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第08讲 金属材料(练)-2023年高考化学一轮复习讲练测(新教材新高考)黑龙江省虎林市高级中学2022-2023学年高三上学期第一次月考化学试题黑龙江省齐齐哈尔市三立高级中学2022-2023学年高三上学期期中考试化学试题第三章 金属及其化合物 第15讲 金属材料 金属冶炼(已下线)考点15 铝及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
解题方法
2 . (1)反应3A(g)+B(g)=2C(g)在三种不同的条件下进行反应,一段时间后,测得的反应速率用不同的物质表示为:①vA=1mol/(L·min);②vC=0.5mol/(L·min);③vB=0.5mol/(L·min),则在三种不同条件下该反应速率由大到小的关系是___ (请用序号表示)。
(2)某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
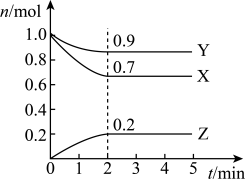
①该反应的化学方程式为___ 。
②反应开始至2min,以气体Z表示的平均反应速率为___ 。
③若2min后反应达平衡,与初始时刻相比,此时容器内混合气体的平均相对分子质量___ (填“增大”、“减小”或“不变”,下同),混合气体密度比起始时___ 。
④上述反应,在第2min时,X的转化率为___ 。
(2)某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

①该反应的化学方程式为
②反应开始至2min,以气体Z表示的平均反应速率为
③若2min后反应达平衡,与初始时刻相比,此时容器内混合气体的平均相对分子质量
④上述反应,在第2min时,X的转化率为
您最近一年使用:0次
2021-06-02更新
|
384次组卷
|
6卷引用:吉林省长春市农安县2019-2020学年高一下学期期末考试化学试题
3 . (1)等物质的量的CO和CO2中所含O原子个数之比_______ ,原子数之比_______ ,二者的质量之比_______ 。
(2)已知1.2gRSO4中含0.01molR2+,则RSO4的摩尔质量是_______ ;R的相对原子质量是_______ 。
(2)已知1.2gRSO4中含0.01molR2+,则RSO4的摩尔质量是
您最近一年使用:0次
4 . 过氧化钙晶体(CaO2·8H2O)可用于改善地表水质、处理含重金属粒子废水、应急供氧等。
(1)已知:I2+2 =2I-+
=2I-+ ,测定制备的过氧化钙晶体中CaO2的含量的实验步骤如下:
,测定制备的过氧化钙晶体中CaO2的含量的实验步骤如下:
第一步:准确称取a g产品放入锥形瓶中,再加入过量的b g KI晶体,加入适量蒸馏水溶解,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。第二步:向上述锥形瓶中加入几滴淀粉溶液。第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液发生反应,滴定达到终点时出现的现象是___________ 。若滴定消耗Na2S2O3溶液V mL,则样品中CaO2的质量分数为___________ (用字母表示)。
(2)已知过氧化钙加热至350 ℃左右开始分解放出氧气。将过氧化钙晶体(CaO2·8H2O)在坩埚中加热逐渐升高温度,测得样品质量随温度的变化如图所示,则350 ℃左右所得固体物质的化学式为___________ 。

(1)已知:I2+2
 =2I-+
=2I-+ ,测定制备的过氧化钙晶体中CaO2的含量的实验步骤如下:
,测定制备的过氧化钙晶体中CaO2的含量的实验步骤如下:第一步:准确称取a g产品放入锥形瓶中,再加入过量的b g KI晶体,加入适量蒸馏水溶解,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。第二步:向上述锥形瓶中加入几滴淀粉溶液。第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液发生反应,滴定达到终点时出现的现象是
(2)已知过氧化钙加热至350 ℃左右开始分解放出氧气。将过氧化钙晶体(CaO2·8H2O)在坩埚中加热逐渐升高温度,测得样品质量随温度的变化如图所示,则350 ℃左右所得固体物质的化学式为

您最近一年使用:0次
名校
5 . 在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)⇌3C(g)+nD(g),开始时A为4mol,B为6mol,5min末时测得C的物质的量为3mol,D的化学反应速率v(D)=0.2mol/(L·min)。请回答:
(1)5min末A的物质的量浓度为_______ ;
(2)前5min内用B表示的化学反应速率v(B)为_______ ;
(3)前5min内A的转化率为_______ ;(转化率是指某一反应物的转化百分率)
(4)化学方程式中n的值为_______ ;
(5)此反应在四种不同情况下的反应速率分别为:
①v(A)=5mol/(L·min) ②v(B)=6mol/(L·min)
③v(C)=4.5mol/(L·min) ④v(D)=8mol/(L·min)
其中反应速率最快的是_______ (填编号)。
(1)5min末A的物质的量浓度为
(2)前5min内用B表示的化学反应速率v(B)为
(3)前5min内A的转化率为
(4)化学方程式中n的值为
(5)此反应在四种不同情况下的反应速率分别为:
①v(A)=5mol/(L·min) ②v(B)=6mol/(L·min)
③v(C)=4.5mol/(L·min) ④v(D)=8mol/(L·min)
其中反应速率最快的是
您最近一年使用:0次
2021-04-17更新
|
875次组卷
|
5卷引用:湖南省长沙市明德中学2019-2020学年高一下学期第八次阶段性检测化学试题
湖南省长沙市明德中学2019-2020学年高一下学期第八次阶段性检测化学试题吉林省白城市第一中学2020-2021学年高一下学期期中考试化学试题(已下线)【浙江新东方】双师208高一下(已下线)第二章 第一节 化学反应速率(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)河北省唐山市第十一中学2021-2022学年高二上学期期中考试化学试题
名校
解题方法
6 . 某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

①该反应反应物是_____ ,生成物是_______ ,化学方程式为_______ 。
②反应开始至2min,以气体Z表示的平均反应速率为_______ 。

①该反应反应物是
②反应开始至2min,以气体Z表示的平均反应速率为
您最近一年使用:0次
2021-04-15更新
|
864次组卷
|
2卷引用:吉林省长春市第二十中学2020-2021学年高一下学期第一次质量检测化学试题
解题方法
7 . 下列溶液,c(H+)由小到大的排列顺序是___ ;pH由小到大的排列顺序是___ 。
①0.1mol/LHCl溶液;②0.1mol/LH2SO4溶液;③0.1mol/LNaOH溶液;④0.1mol/LCH3COOH溶液
①0.1mol/LHCl溶液;②0.1mol/LH2SO4溶液;③0.1mol/LNaOH溶液;④0.1mol/LCH3COOH溶液
您最近一年使用:0次
2021-03-03更新
|
654次组卷
|
3卷引用:吉林长春市榆树高级中学2019-2020学年高二下学期期末考试化学试题
吉林长春市榆树高级中学2019-2020学年高二下学期期末考试化学试题人教2019版选择性必修一第三章 第二节 水的电离和溶液酸碱性 课后习题(已下线)3.1.2 pH的计算与测量-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)
8 . (1)同温同压下,同体积的氨气和硫化氢(H2S)气体的质量比为_______ ;同质量的氨气和硫化氢气体体积比为_______ ,若二者氢原子数相等,则它们的体积比为_______ 。
(2)一氧化碳和二氧化碳的混合气体18 g,完全燃烧后测得二氧化碳的体积为11.2 L(标准状况)。试回答:
①混合气体中一氧化碳的质量是_______ 。
②混合气体中二氧化碳在标准状况下的体积是_______ 。
(3)实验室用密度为1.25 g·mL-1,质量分数为36.5%的浓盐酸配制240 mL 0.1 mol·L-1的盐酸,请回答下列问题:
①浓盐酸的物质的量浓度为_______ 。
②配制240 mL 0.1 mol·L-1的盐酸,应量取浓盐酸体积_______ mL。
(2)一氧化碳和二氧化碳的混合气体18 g,完全燃烧后测得二氧化碳的体积为11.2 L(标准状况)。试回答:
①混合气体中一氧化碳的质量是
②混合气体中二氧化碳在标准状况下的体积是
(3)实验室用密度为1.25 g·mL-1,质量分数为36.5%的浓盐酸配制240 mL 0.1 mol·L-1的盐酸,请回答下列问题:
①浓盐酸的物质的量浓度为
②配制240 mL 0.1 mol·L-1的盐酸,应量取浓盐酸体积
您最近一年使用:0次
12-13高三上·安徽滁州·阶段练习
名校
解题方法
9 . 在标准状况下,将224LHCl气体溶于635mL水中,所得盐酸的密度为1.18g·cm-3试计算:
(1)所得盐酸的质量分数和物质的量浓度分别是___________ 、___________ 。
(2)取这种盐酸100 mL,稀释至1.18L,所得稀盐酸的物质的量浓度是___________ 。
(3)在40.0 mL 0.065 mol·L-1Na2CO3溶液中,逐滴加入上述稀释后的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过___________ mL。
(4)将不纯的NaOH样品1g(样品含少量Na2CO3和水),放入50mL2mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL1mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到___________ g固体。
(1)所得盐酸的质量分数和物质的量浓度分别是
(2)取这种盐酸100 mL,稀释至1.18L,所得稀盐酸的物质的量浓度是
(3)在40.0 mL 0.065 mol·L-1Na2CO3溶液中,逐滴加入上述稀释后的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过
(4)将不纯的NaOH样品1g(样品含少量Na2CO3和水),放入50mL2mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL1mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到
您最近一年使用:0次
2021-01-11更新
|
752次组卷
|
22卷引用:2015-2016学年吉林省松原市油田高中高二下期中化学试卷
2015-2016学年吉林省松原市油田高中高二下期中化学试卷(已下线)2013届安徽省来安县半塔中学高三上学期第一次月考化学试卷(已下线)2014年高考化学苏教版一轮复习1-2-2溶液的配制及误差分析练习卷2017届江西省新余一中、宜春一中高三7月联考化学试题2015-2016学年贵州省思南中学高二下学期期末化学卷安徽省阜阳市第三中学2019-2020学年高一上学期期末考试化学试题(已下线)第04讲 一定物质的量浓度的溶液及其配制(精练)——2021年高考化学一轮复习讲练测(已下线)第02章 海水中的重要元素——钠和氯(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)安徽省六安中学2021届高三上学期开学考试化学试题湖南省邵阳市邵东县创新实验学校2021届高三上学期第一次月考化学试题甘肃省武威市第十八中学2021届高三上学期第一次月考化学试题黑龙江省实验中学2020-2021学年高一12月月考化学试题河南省新蔡县第一高级中学2020-2021学年高一上学期1月月考化学试题(已下线)第02讲 物质的量浓度与溶液的配制(精练)-2022年高考化学一轮复习讲练测(已下线)考点03 物质的量的浓度及溶液配制-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点03 物质的量的浓度及溶液配制-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题一 能力提升检测卷 (测) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第02讲 物质的量浓度(练)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第一单元 化学计量在实验中的应用(A卷 新题基础练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)考点03 物质的量的浓度及溶液配制-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第02讲 物质的量浓度与溶液的配制(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)考点03 物质的量浓度及溶液配制(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
解题方法
10 . (1)9.03×1024个H2O分子的物质的量为___________ ,在标准状况下4.48 LSO2的质量为___________ 。
(2)在标准状况下,22.4L由氮气和氧气组成的混合气体,其质量为30g,则其中氧气的质量为___________ g。
(3)某金属氯化物MClx的摩尔质量为133.5g/mol,取该金属氯化物26.7g配成水溶液,与足量AgNO3溶液完全反应,生成86.1g白色沉淀。则金属M的摩尔质量___________ 。
(4) 溶液分别恰好使相同体积的硫酸铁、硫酸铜两种溶液中的
溶液分别恰好使相同体积的硫酸铁、硫酸铜两种溶液中的 完全转化成沉淀,则硫酸铁、硫酸铜两种溶液的物质的量浓度之比是
完全转化成沉淀,则硫酸铁、硫酸铜两种溶液的物质的量浓度之比是___________ 。
(2)在标准状况下,22.4L由氮气和氧气组成的混合气体,其质量为30g,则其中氧气的质量为
(3)某金属氯化物MClx的摩尔质量为133.5g/mol,取该金属氯化物26.7g配成水溶液,与足量AgNO3溶液完全反应,生成86.1g白色沉淀。则金属M的摩尔质量
(4)
 溶液分别恰好使相同体积的硫酸铁、硫酸铜两种溶液中的
溶液分别恰好使相同体积的硫酸铁、硫酸铜两种溶液中的 完全转化成沉淀,则硫酸铁、硫酸铜两种溶液的物质的量浓度之比是
完全转化成沉淀,则硫酸铁、硫酸铜两种溶液的物质的量浓度之比是
您最近一年使用:0次



